-
随着工农业的发展,城市生活污水、工业废水以及矿山开采和金属冶炼等所产生的有机和无机污染物通过不同方式排入水体中。菲和镉作为有机和无机污染的典型污染物,在渤海湾天津海域都有较高的检出率[1 − 2],对实验动物染毒和人类暴露的研究表明可产生严重的毒性效应[3 − 4],已引起国内外学者的广泛关注。调查表明,镉在锦州湾、渤海等水域均有分布,浓度分别为1.65~2.01 µg·L−1[5]和0.007~5.000 µg·L−1[6]。我们之前的研究报道发现,太平洋牡蛎(Crassostrea gigas)的外套膜、消化腺和闭壳肌中镉(Cd)浓度的背景值为(0.75±0.07)、(1.50±0.26)和(0.45±0.06)µg·g−1[7]。镉对太平洋牡蛎的急性和慢性毒性已有研究[8]。镉对太平洋牡蛎胚胎的半数效应浓度(median effect concentration, EC50)为272.2 µg·L−1,对幼体的96 h半数致死浓度(median lethal concentration, LC50)为353.3 µg·L−1。镉暴露下,太平洋牡蛎组织病理学发生显著变化,如血细胞鳃部可见浸润和丝状肿胀,消化腺小管浸润、变薄。此外,环渤海地区所有养殖水产品中多环芳烃的污染状况特别普遍,其中菲的检出率和平均含量最高,分别为88.5%和6.53 µg·kg−1[9]。水环境中的菲可以在鱼类、贝类等体内富集[10 − 11],可对鱼[10]、太平洋牡蛎[12]、扇贝(Nodipecten nodosus)[13]、厚壳贻贝(Mytilus coruscus)[14]等产生毒理效应。研究发现,扇贝暴露在菲水溶液中,其体内CYP2U1、CYP2D20、CYP3A11等基因的转录水平增加[13];菲对厚壳贻贝Hsp70mRNA诱导表达具有组织特异性,在外套膜中表达最高[14]。
水生动物体内镉和菲的积累会催化活性氧(ROS)的产生,从而产生氧化应激。在各种抗氧化机制中,超氧化物歧化酶(SOD)是第一个对抗 ROS 产生的氧化应激防御系统。SOD 将超氧阴离子转化为过氧化氢[15]。过氧化氢酶(CAT)通过将 H2O2 分解成水来保护细胞免受 H2O2 的毒性作用[16]。在CAT不存在的情况下,H2O2 会积累,导致羟基自由基的产生增加。谷胱甘肽S-转移酶(GST)是一种抗氧化剂和 II相解毒酶,是水生动物氧化损伤的可靠生物标志物[17]。丙二醛(MDA)是脂质过氧化的分解产物,也常被用作分析镉暴露后脂质过氧化自由基反应的常见指标[18]。Macías-Mayorga等[19]设置了3种镉浓度(0.088 、0.44 、2.22 µmol·L−1)对牡蛎暴露28 d的毒性效应,发现高浓度镉(2.22 µmol·L−1)能够抑制SOD酶和CAT酶活性,对抗氧化系统具有不利影响。Benali等[20]用紫贻贝(Mytilus galloprovincialis)作为指示生物,测定了镉对CAT酶 和GST 酶活性的影响,发现CAT酶活性与Cd浓度呈负相关。将海洋腹足类生物(Morula granulata)暴露于不同浓度的菲污染时,能明显诱导机体产生氧化应激,导致 DNA 损伤,研究者也报道谷胱甘肽硫转移酶(GST)可作为检测菲污染的有效氧化应激指标[21]。Bhuyan等[22]也报道一定浓度的菲污染胁迫可以改变蝌蚪的氧化应激指标,并诱导其产生遗传毒性。镉和菲对动物应氧化应激反应都是通过催化活性氧(ROS)而产生的[23 − 24],存在部分一致性,但在关键生物标志物和时相上是否表现出显著差异性犹未可知。
在机体的解毒过程中,金属硫蛋白(metallothionein, MT)是一类富含半胱氨酸的小分子蛋白质,参与机体重金属解毒和金属元素代谢等生理过程[25 − 26]。MT基因在水生无脊椎动物中既参与必需金属的代谢稳态调节,也通过结合非必需金属发挥解毒功能[27]。热休克蛋白(heat shock protein, Hsp)的表达被用作动物细胞应激的指标,其参与维持蛋白质完整性,以及校正细胞内蛋白质的折叠[28]。珍珠贝海洋热浪的响应通过hsp70指示,hsp70 在急性热浪中快速上调,长期重复暴露可缓解热应激,为贝类适应气候变化提供分子证据[29]。
在海洋环境中,多种污染物共存会对海洋生物产生复合污染和联合毒性。单一机制较难解释多种污染物共存时的联合效应,有必要开展多种污染物复合污染条件下对生物体的联合作用。目前关于镉和菲联合暴露对生物体影响的研究还较少,仅在毛蚶(Scapharca subcrenata)上有报道[30 − 31]。文蛤(Meretrix meretrix)是广泛生长在滩涂与浅海水域的双壳贝类,其滤食特性使其较易富集海洋环境中的污染物。文蛤作为一种经济贝类,因肉质鲜美、营养丰富,含有人体所需多种营养成分,被誉为“天下第一鲜”,其安全性与人类健康息息相关。本研究的主要目的是研究镉和菲单一作用和联合作用下,文蛤体内氧化应激相关酶与解毒代谢基因的变化情况,以期为掌握海洋重金属与多环芳烃复合污染的生态毒理效应,并为贝类的健康养殖提供科学依据。
-
实验用文蛤捕捞自山东东营市河口区近海,选择活力好、大小均匀的个体进行实验,规格为壳长(30±2) mm。实验前暂养7 d,暂养期间海水盐度(32±2),每日换水1次,持续充氧,定时投喂角毛藻,投喂量为5×108个·mL−1,及时拣出死亡、活力差(用玻璃棒碰触外套膜边缘时无收缩反应)的个体。
实验用试剂:CdCl2为分析纯,购自阿拉丁公司;菲购于美国Sigma公司,粉末状,纯度>98%。SOD、CAT、GST酶活性以及MDA含量的检测试剂盒均购自南京建成生物工程研究所。试剂还包括RNA提取液、三氯甲烷、异丙醇、无水乙醇、HyPure TMMolecular Biology Grade Water、Servicebio®RT First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master Mix(None ROX)。
实验仪器:匀浆器台式高速冷冻型微量离心机、荧光定量PCR仪、超微量分光光度计。
-
镉与菲的富集实验在塑料水槽中进行,养殖水体为80 L。共设置3个实验组,分别为10 µg·L−1镉单一处理组、100 µg·L−1菲单一处理组、10 µg·L−1镉+100 µg·L−1菲联合处理组,设空白对照组。其中菲用二甲基亚砜溶解。镉和菲的暴露浓度根据文献报道来设置[32 − 35]。实验组和对照组均设置3个平行,每水槽放入100粒文蛤。实验持续7 d,期间每24 h全量更换实验溶液,其他管理与暂养期间一致[36]。第3天和第7 天从每个平行随机取6粒文蛤,各取3粒分别用于酶活测定与基因表达测定。
-
快速取文蛤外套膜,用滤纸吸去表面水分,称重后剪碎,放入玻璃匀浆器中,按照质量(g)∶体积(mL)=1∶9的比例加入9倍的生理盐水,在冰浴中制备成10%的组织匀浆,经冷冻离心机(0~4 ℃,
3500 r·min−1)离心15 min后,取上清液,置于−20 ℃下待测。SOD、CAT、GST酶活性以及MDA含量的测定均按照试剂盒说明进行。 -
总RNA提取。称取0.1 g外套膜置于1.5 mL离心管中,加入1 mL TriPure Isolation Reagent,振荡混匀,在冰上裂解5 min后,4 ℃、12 000 r·min−1离心10 min;取上清850 µL置于新离心管中,加入200 µL三氯甲烷,剧烈震荡15 s,冰上静置2 min,于4 ℃、12 000 r·min−1离心15 min;取上清350 µL置于新离心管中,再加入200 µL三氯甲烷,震荡混匀,冰上静置5 min后,4 ℃、12 000 r·min−1离心15 min;取上清250 µL置于新离心管中,加入等体积异丙醇,上下颠倒混匀,室温静置10 min(出现絮状沉淀);4 ℃、12 000 r·min−1离心15 min,弃上清后加入1 mL 75%乙醇洗沉淀;4 ℃、7 500 r·min−1离心5 min,弃上清,室温风干去除乙醇后加入100 µL DEPC处理水,溶解RNA,−80 ℃保存。
RNA质量检测。采用Nanodrop 2000检测RNA的纯度。实时荧光定量PCR (qPCR)参照SYBR® Premix Ex TaqTM Ⅱ(TaKaRa)的说明,内参基因使用文蛤ß-actin rRNA 基因。20 µL扩增体系为:SYBR® Premix Ex TaqTM Ⅱ 10 µL;PCR Forward Primer(10 µmol·L−1) 0.8 µL; PCR Reverse Primer(10 µmol·L−1) 0.8 µL; ROX Reference Dye Ⅱ(50X) 0.4 µL; cDNA模板 2.0 µL;DEPC水 6.0 µL。反应程序为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。qPCR所用引物见表1。
基因名称
Gene基因库号
Gene bank number引物序列 (5'-3' )
Primer sequences (5'-3' )扩增片段大小/bp
Amplified fragment size/bpMT KU301770.1 F: CGAGGACTGTTCATCAACCACTG
R: GCAAACAACTTTACACCCTGGAC629 Hsp70 HQ256748.1 F: GGACCACATACTCCTGCGTTG
S: CTGGGTCATCAAACTTCCTTCC210 Actin JN084197.1 F: TGTCCCTATCTACGAAGGTTACGC
R: CTCGGTCAGGATCTTCATCAAGTA1 259 Table 1. Primer sequences for qRT-PCR
-
根据2−ΔΔCт法计算目标基因的相对表达量[37]。实验结果均采用平均值±标准差(mean±S.D.)表示,采用Excel 2016对数据进行作图。运用SPSS16.0对数据进行分析,用单因素方差分析法分析同一时间点不同处理组之间的差异,用独立样本t检验分析不同时间点相同处理组之间的差异,用双重分析法分析镉和菲单一与联合处理后的交互作用,以P<0.05作为显著差异性的标准。
-
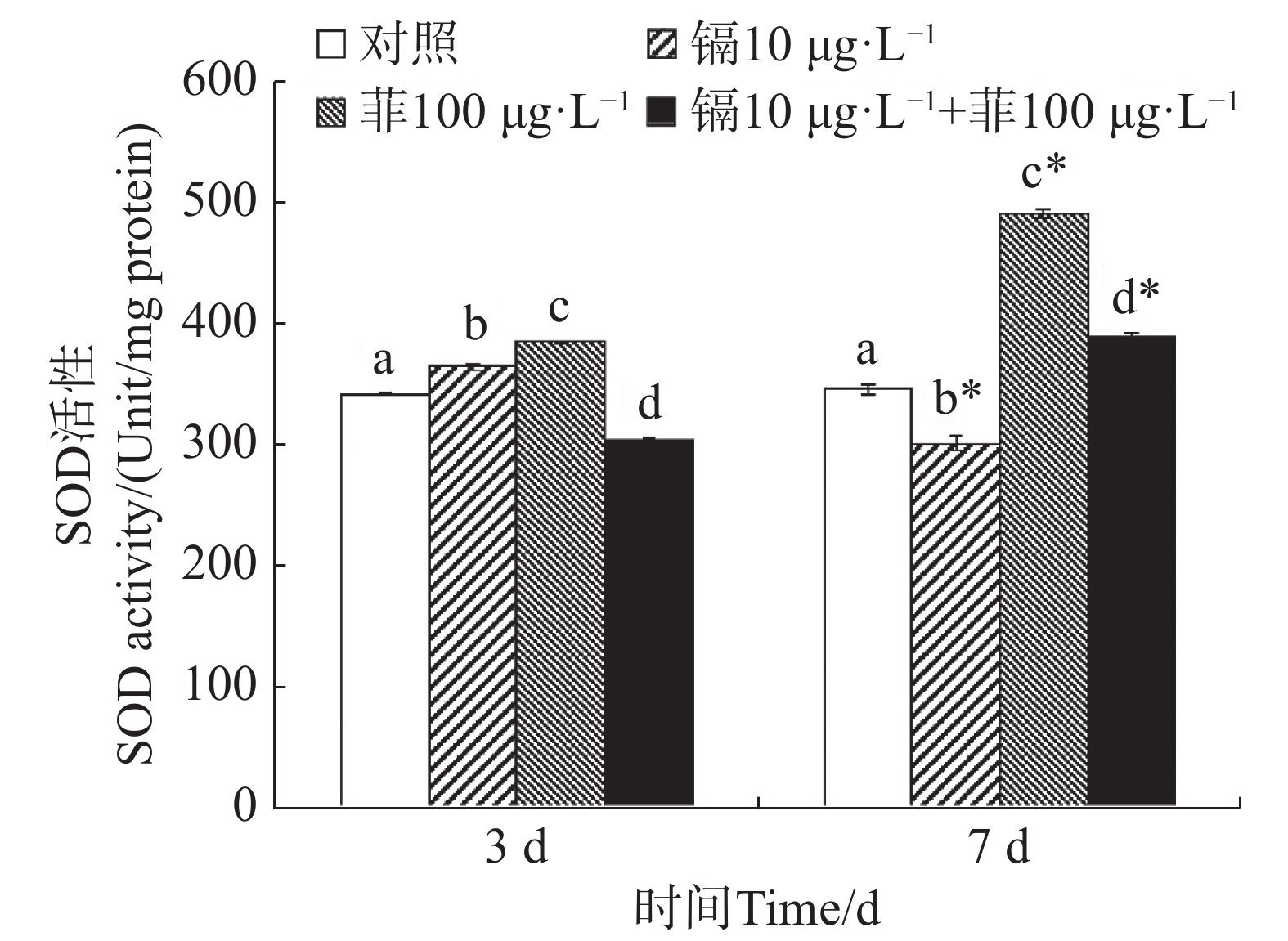
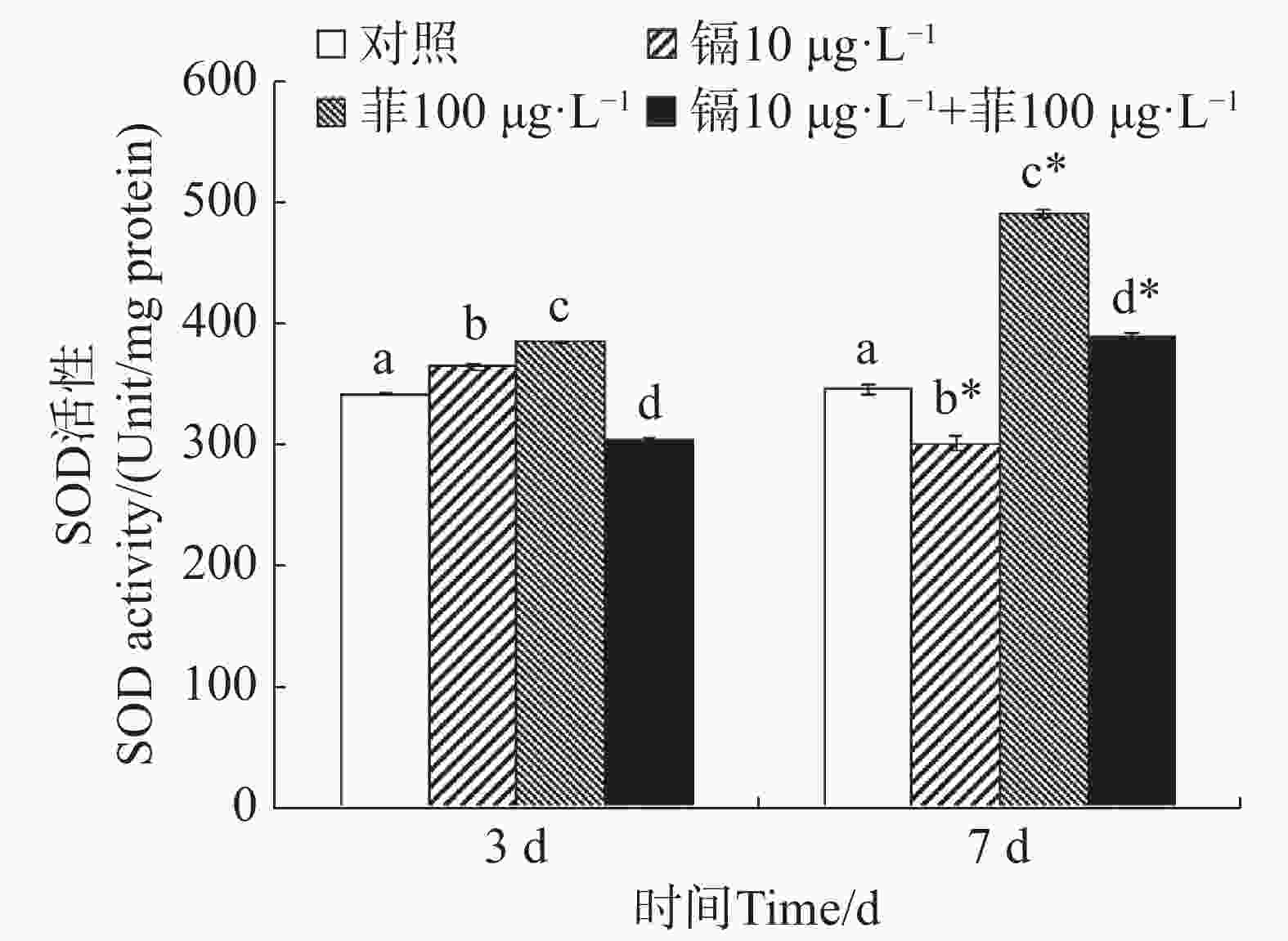
镉暴露对文蛤外套膜SOD活性的影响如图1所示。暴露3 d时,镉单一处理组和菲单一处理组的文蛤外套膜SOD活性均显著高于空白对照组(P<0.05),镉-菲联合暴露组显著低于空白对照组(P<0.05)。暴露7 d时,镉单一处理组显著低于空白对照组(P<0.05),菲单一处理组和镉-菲联合暴露组均显著高于空白对照组,其中菲单一处理组SOD活性最高。
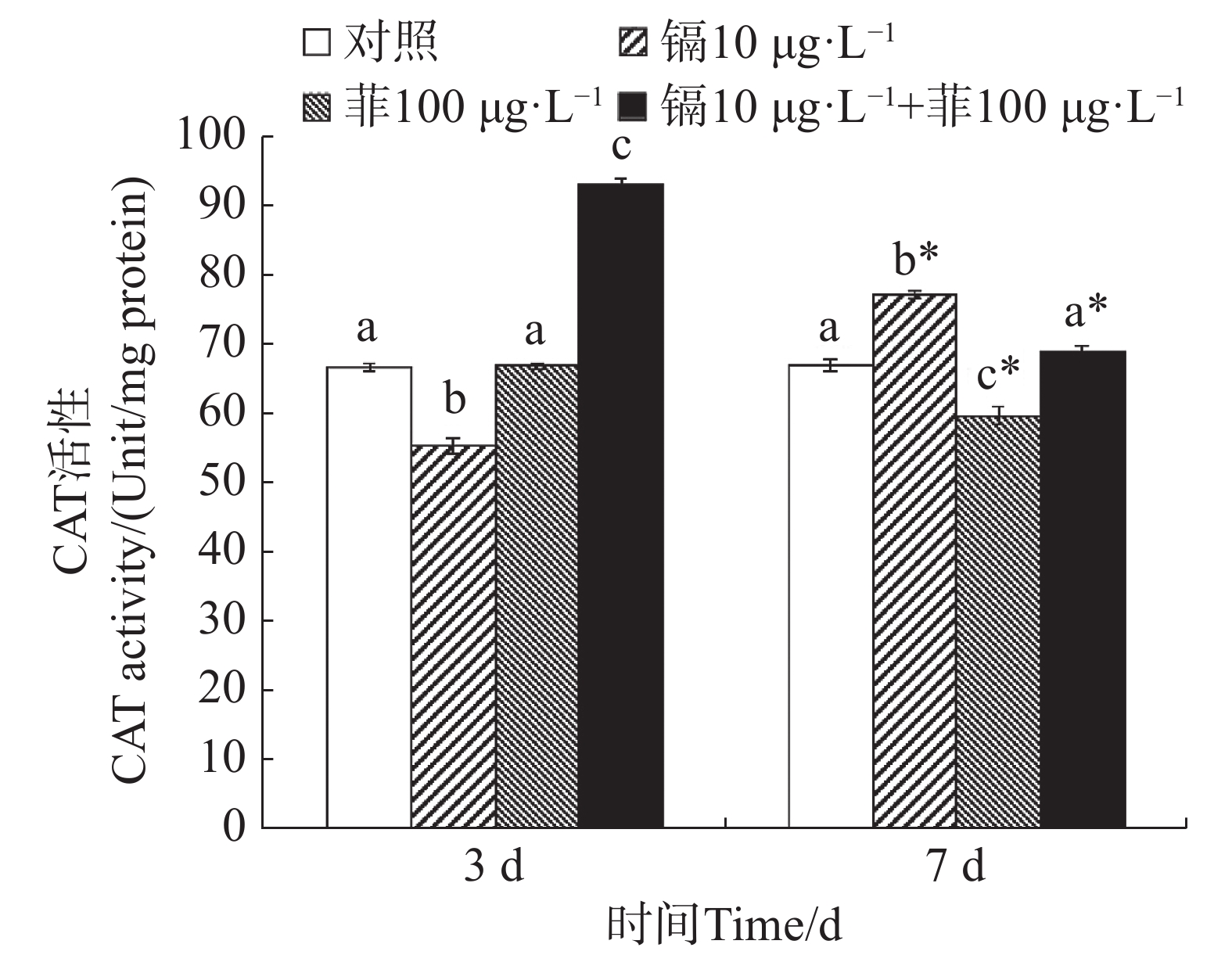
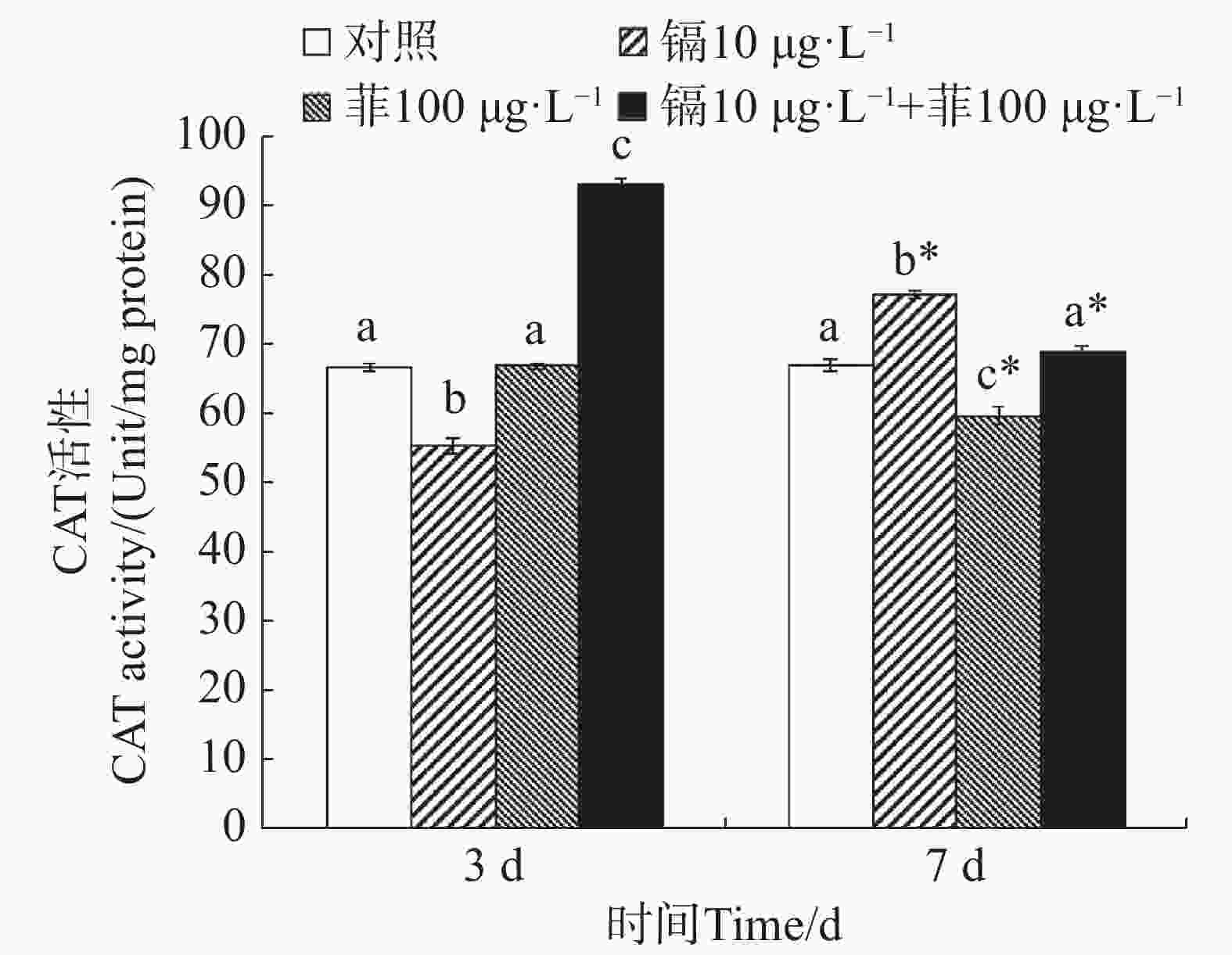
镉暴露对文蛤外套膜CAT活性的影响如图2所示。暴露3 d时,镉单一处理组CAT活性显著低于空白对照组(P<0.05),镉-菲联合暴露组显著高于空白对照组(P<0.05)。暴露7 d时,镉单一处理组显著高于空白对照组(P<0.05),菲单一处理组显著低于空白对照组(P<0.05),镉-菲联合暴露组中CAT活性与空白对照组比较无显著性差异。
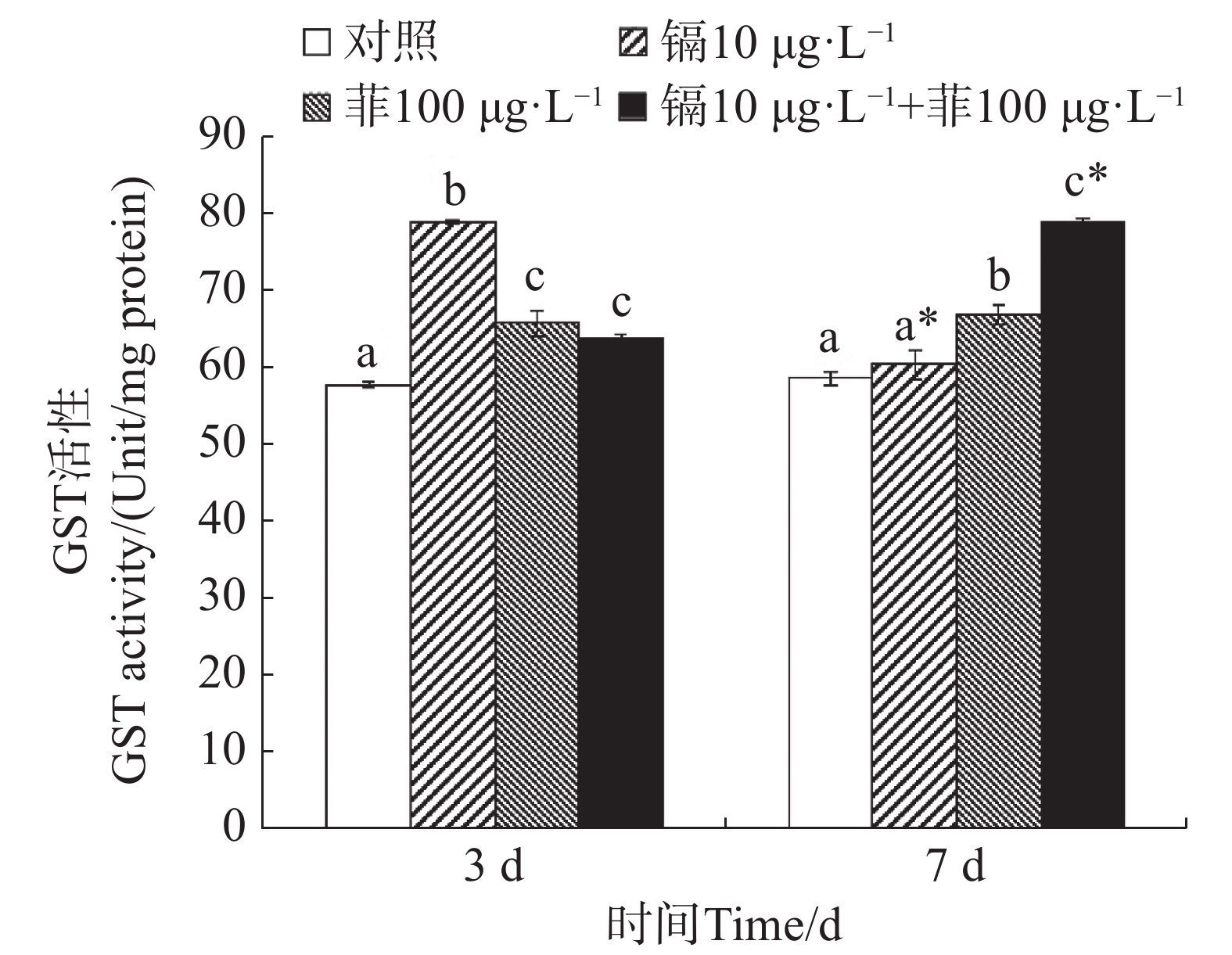
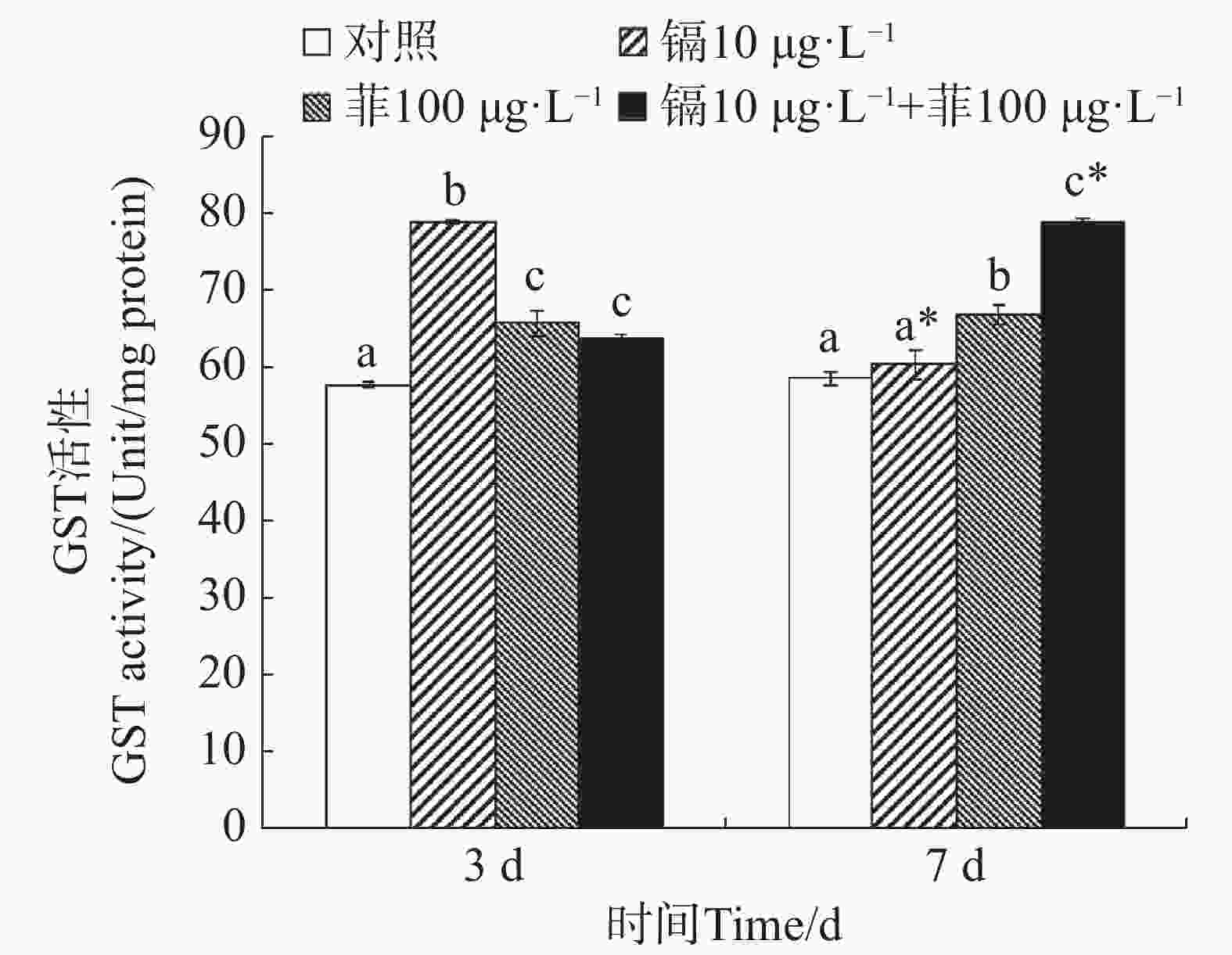
镉暴露对文蛤外套膜GST活性的影响如图3所示。暴露3 d时,3个处理组文蛤外套膜GST活性均显著高于空白对照组(P<0.05),其中镉单一处理组GST活性最高。暴露7 d时,菲单一处理组和镉-菲联合暴露组GST活性均显著高于空白对照组(P<0.05),其中镉-菲联合暴露组GST活性最高。
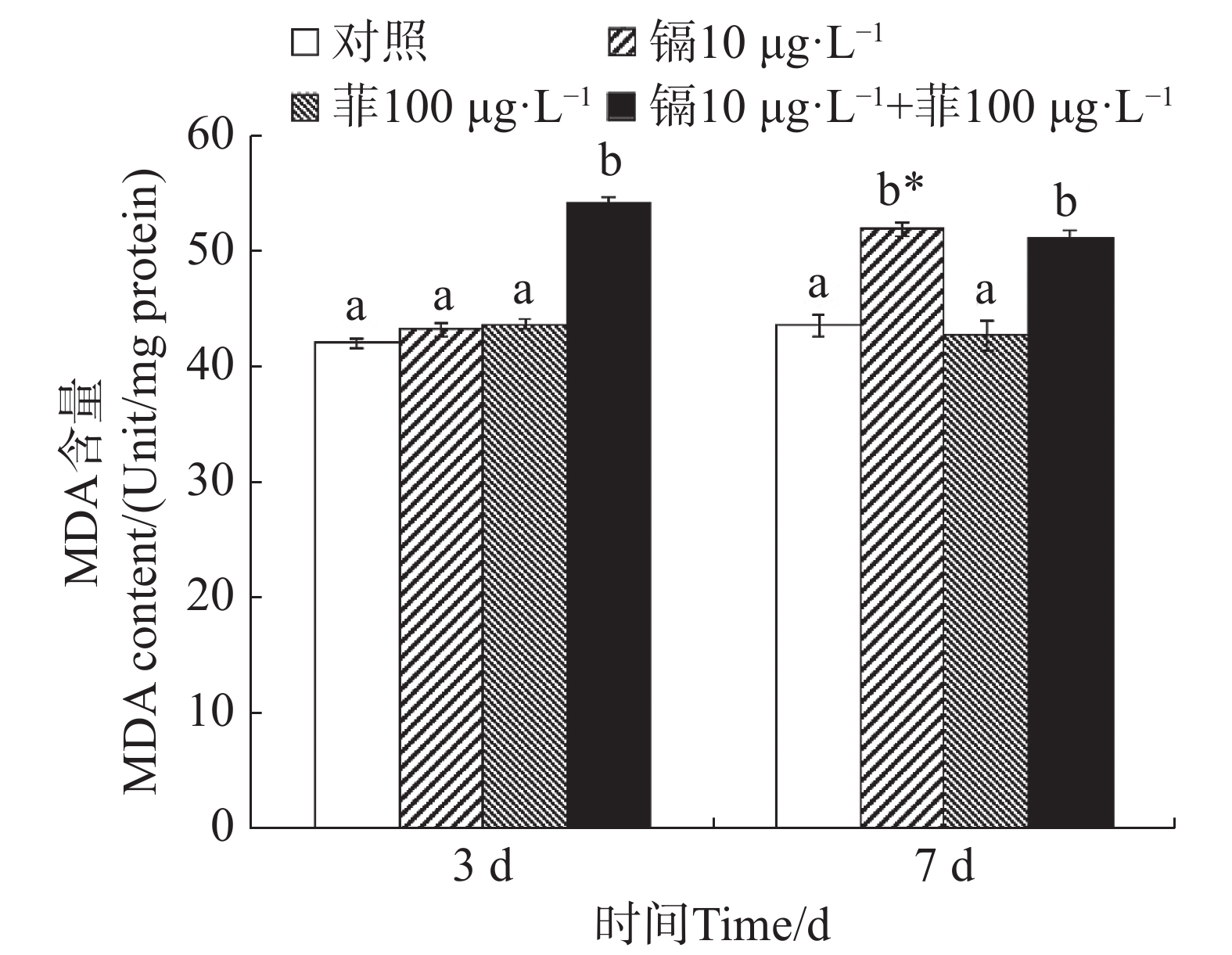
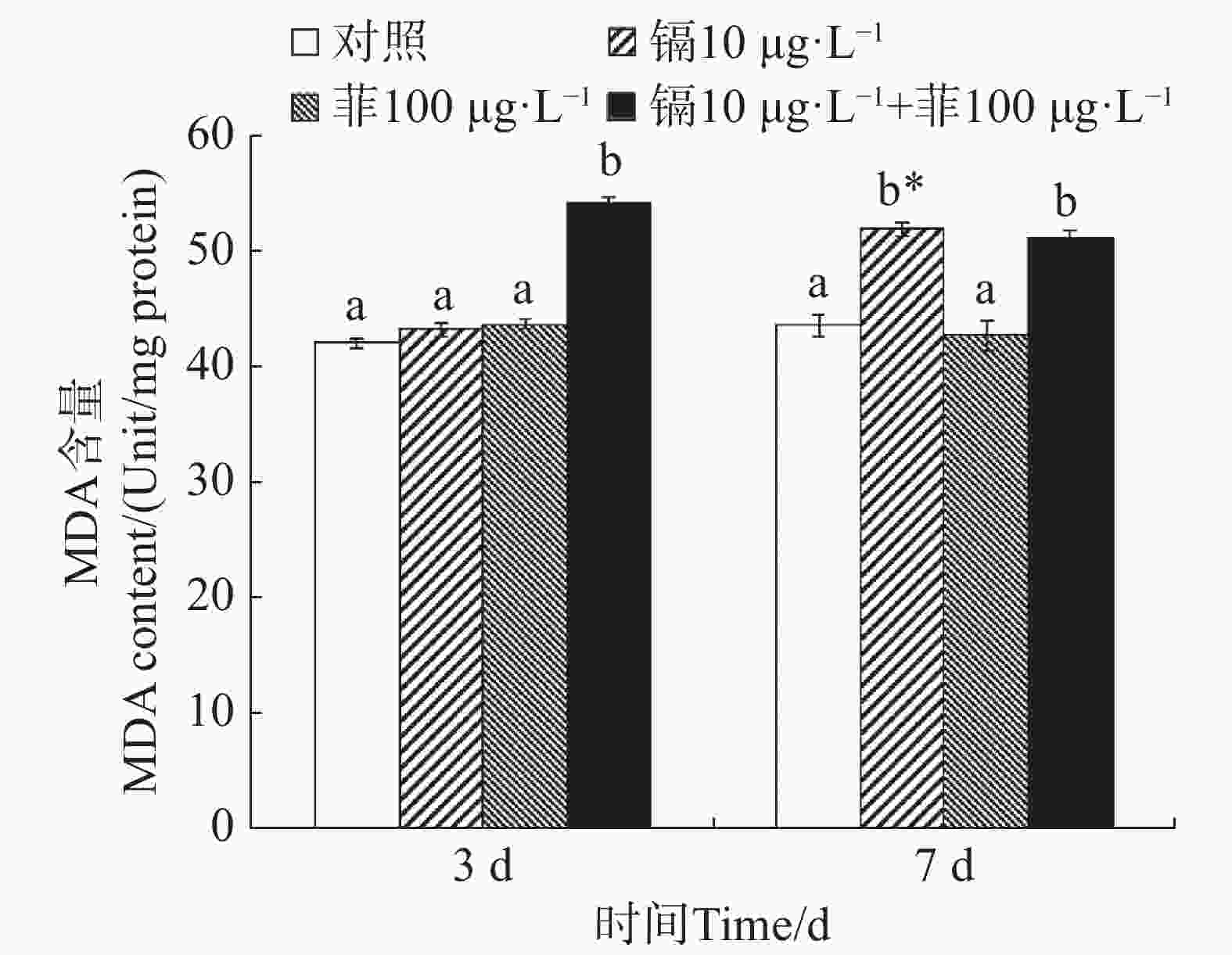
镉暴露对文蛤外套膜MDA含量的影响如图4所示。暴露3 d时,镉-菲联合暴露组MDA含量显著高于空白对照组(P<0.05),镉单一处理组和菲单一处理组MDA含量与空白对照组差异不显著(P>0.05)。暴露7 d时,镉单一处理组MDA含量与空白对照组差异不显著(P>0.05),菲单一处理组和镉-菲联合暴露组MDA含量显著高于空白对照组(P<0.05)。
-
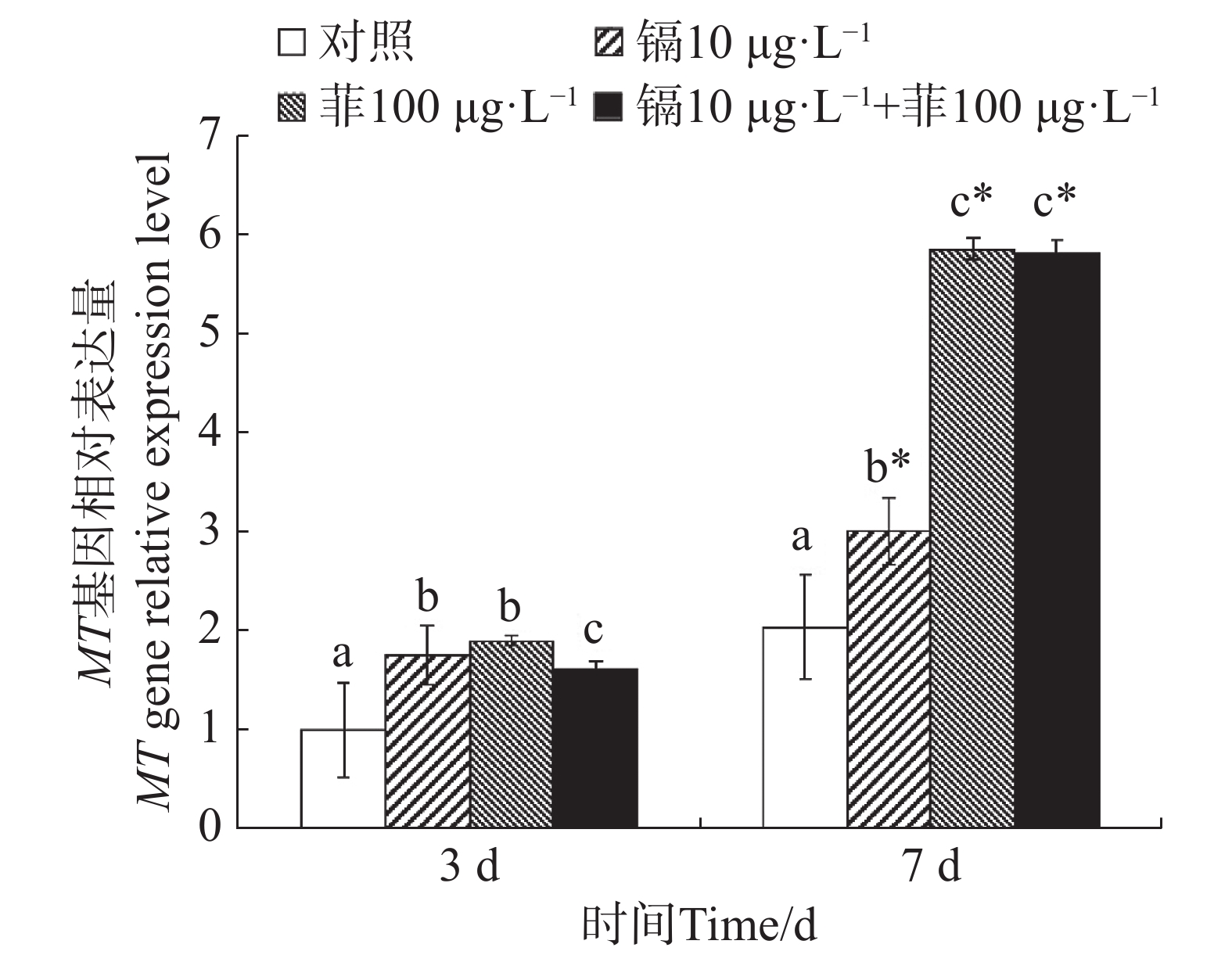
镉暴露对文蛤外套膜MT基因表达的影响如图5所示。暴露3 d时,3个处理组MT基因表达量均显著高于空白对照组(P<0.05)。暴露7 d时,3个处理组MT基因表达量也均显著高于空白对照组(P<0.05),其中菲单一处理组和镉-菲联合暴露组MT基因被诱导程度较高。
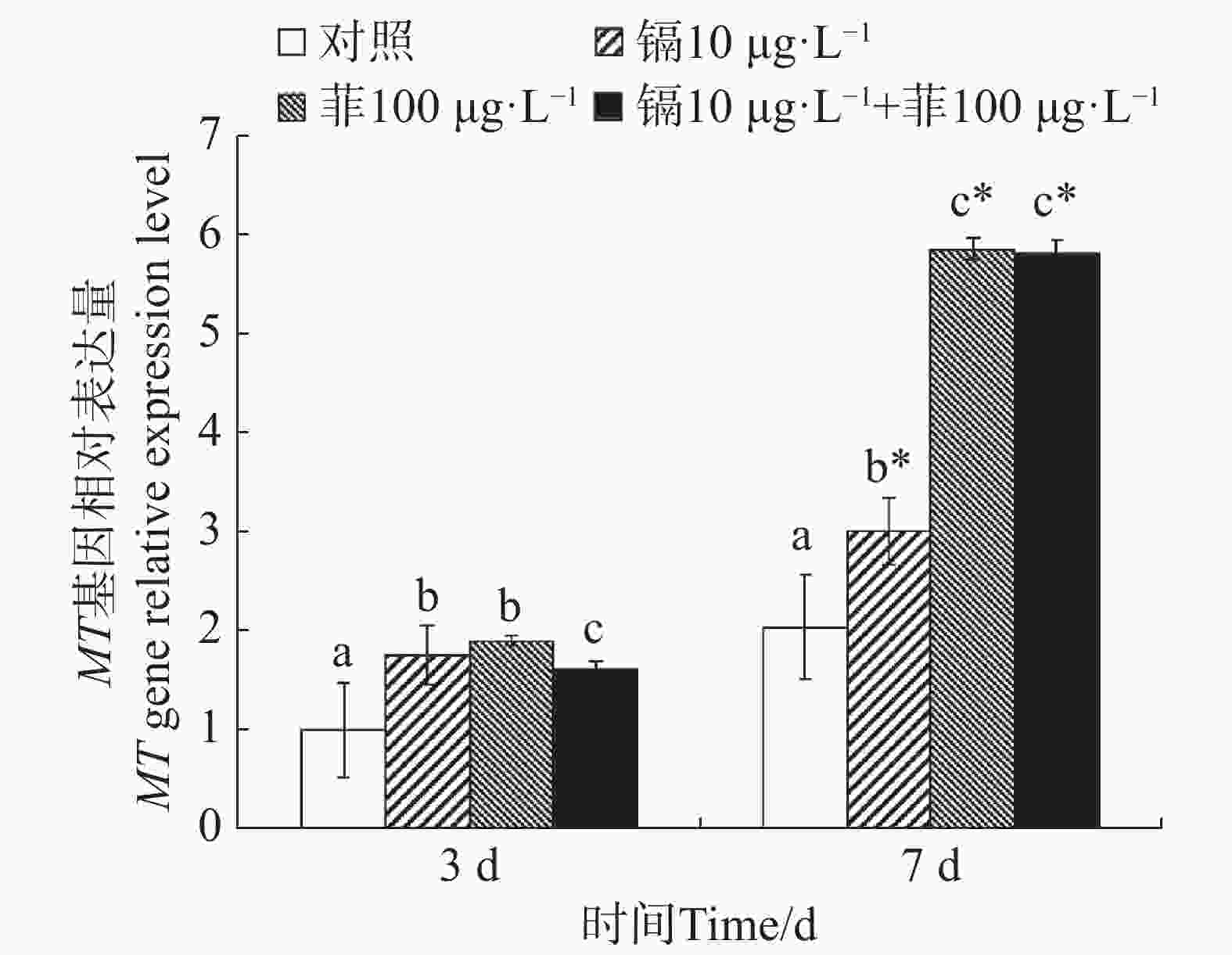
Figure 5. Effect of cadmium and phenanthrene on MT gene relative expression level in mantle of Meretrix meretrix
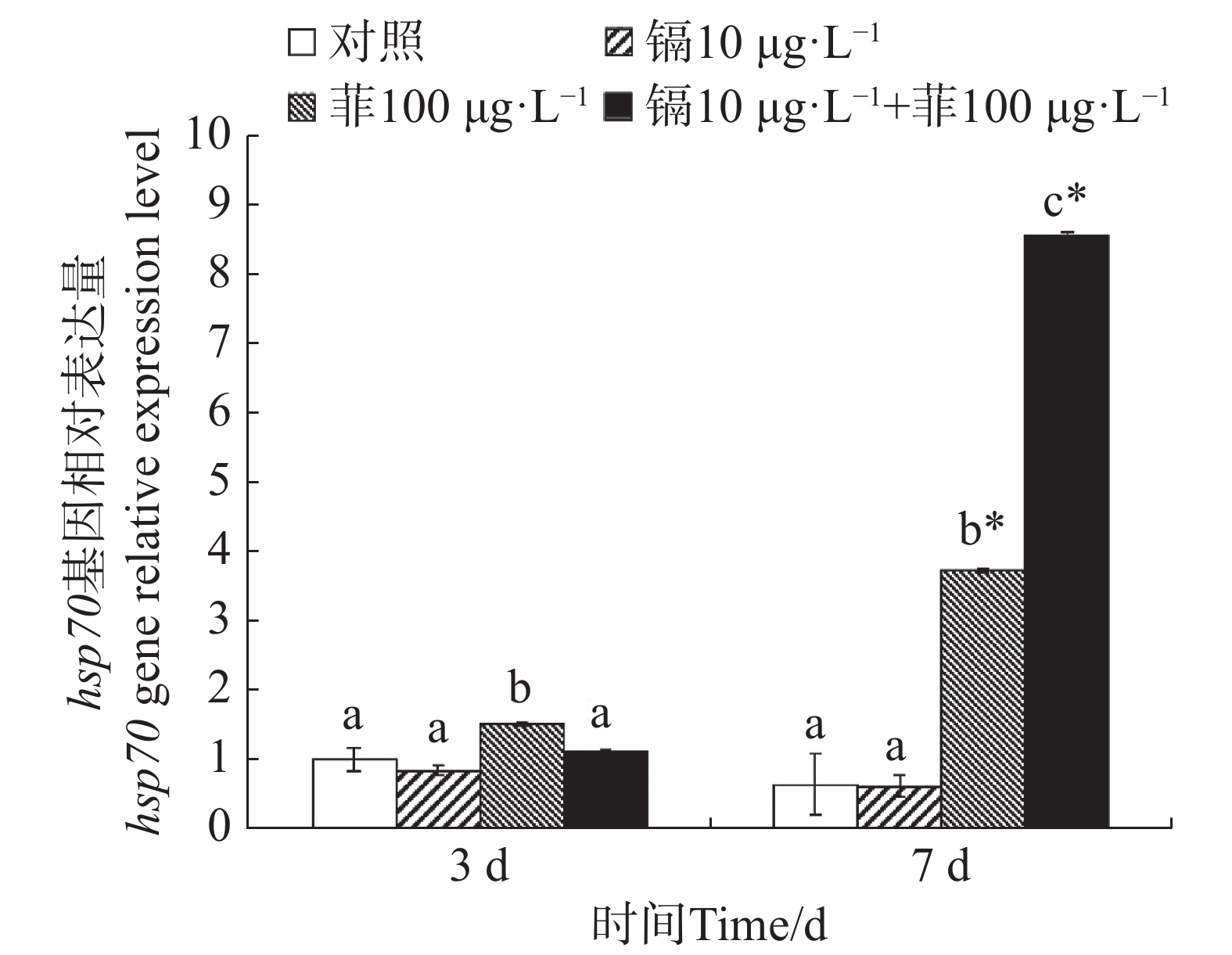
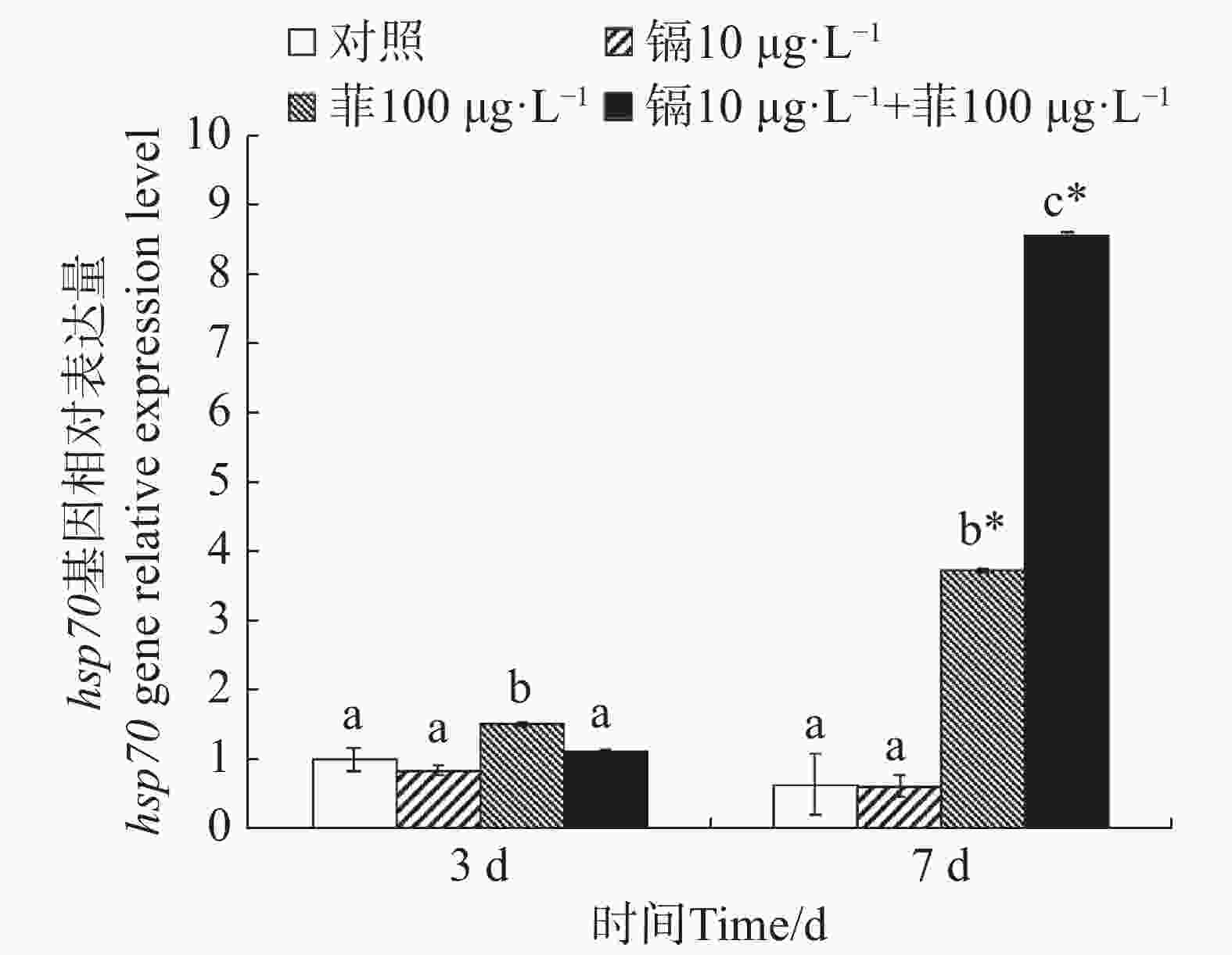
镉暴露对文蛤外套膜hsp70基因表达的影响如图6所示。暴露3 d时,菲单一处理组hsp70基因表达量显著高于空白对照组(P<0.05)。暴露7 d时,菲单一处理组和镉-菲联合暴露组显著高于空白对照组(P<0.05),其中镉-菲联合暴露组hsp70基因表达量最高。
-
双因素方差分析表明,3 d时,镉单一暴露和菲单一暴露均可显著影响抗氧化酶(SOD、CAT、GST)酶活性、MDA含量以及MT、Hsp70的表达水平(P<0.05),且除了hsp70基因的表达,对其他指标均存在显著交互作用(P<0.05)。7 d时,镉单一暴露均可显著影响各指标的变化(P<0.05);菲单一暴露组,除了MT基因的表达,可显著影响其他各指标的变化(P<0.05);除了CAT酶活性及MDA含量,对其他指标均存在显著交互作用(P<0.05)(表2)。
胁迫时间Stress time 处理Treatment SOD CAT GST MDA MT hsp70 3 d 镉单一 F 102.615 2.007E3 49.054 513.311 17.538 29.439 P 0.000 0.000 0.000 0.000 0.003 0.001 菲单一 F 1.067E3 313.415 371.224 436.282 6.425 13.250 P 0.000 0.000 0.000 0.000 0.035 0.007 镉菲联合 F 3.276E3 1.971E3 524.489 280.220 32.842 2.495 P 0.000 0.000 0.000 0.000 0.000 0.153 7 d 镉单一 F 1.914E3 217.771 339.240 2.495 231.134 1.733E3 P 0.000 0.000 0.000 0.153 0.000 0.000 菲单一 F 715.713 340.473 88.964 261.199 4.575 327.583 P 0.000 0.000 0.000 0.000 0.065 0.000 镉菲联合 F 110.628 0.787 49.734 0.013 5.396 333.065 P 0.000 0.401 0.000 0.911 0.049 0.000 Table 2. The interaction between Cd and Phe
-
重金属和多环芳烃暴露对贝类体内SOD和CAT活性有直接影响。太平洋牡蛎在蒽的胁迫下,SOD和CAT活性出现先诱导后抑制的动态变化过程[38]。镉和菲单一和联合作用下,毛蚶体内SOD和CAT活力呈现被诱导的趋势[28]。文蛤鳃组织SOD活性在0.41和0.82 mg·L−1镉胁迫下,试验前期(0~48 h)呈现诱导效应,试验后期(48~96 h)呈现抑制效应;CAT活性在低质量浓度(0.41 mg·L−1)镉胁迫下出现阶段性抑制效应,接着呈现诱导-抑制过程[39]。本研究中,镉单一暴露下,SOD活性先被显著性诱导又被显著性抑制,而CAT活性先被显著性抑制,后被显著性诱导;菲单一暴露下,SOD活性均被显著诱导,CAT活性与对照组无显著性变化,镉-菲联合暴露下,SOD活性先被显著抑制,后被显著诱导,而CAT活性均被显著诱导。500 µg·L−1镉和50 µg·L−1菲单一和联合暴露9 d,毛蚶体内SOD活性和CAT活性均呈现出被诱导的趋势[28],与本实验结果有差异,可能与镉-菲的暴露浓度、染毒时间及生物体的敏感性等多种因素的差异有关。本实验中,镉-菲单一与联合暴露组中实验过程中,SOD活性均较对照组有显著增高,说明暴露过程中可导致自由基产生。CAT活性在镉-菲联合暴露组最高,这可能与CAT酶的功能有关。CAT酶利用铁或锰作为辅助因子,可以催化过氧化氢(H2O2)降解或者还原为水和分子氧,从而完成SOD代谢的解毒过程[40 − 41],因此,SOD酶和CAT酶通过共同作用清除多余的ROS来解毒。在有机体中,SOD将O2− 转化为O2和H2O2,然后CAT将H2O2转化为H2O。暴露3 d时,镉和菲的联合暴露对文蛤SOD酶和CAT酶具有交互作用,说明其共存对于文蛤体内自由基的产生具有协同作用;暴露7 d时,镉和菲的联合暴露对文蛤SOD酶表现出交互作用,而对CAT酶的交互作用不明显,说明暴露时间是决定混合污染物对机体免疫毒性的重要因素。镉和菲联合暴露的交互作用在蚯蚓中也有报道,结果表明镉和菲联合暴露对SOD酶不存在显著交互作用[42],而对CAT酶具有显著交互作用,该结果与本文研究结果的差异推测与物种差异有关。SOD和CAT的协同作用通过清除超氧阴离子(
${\mathrm{O}}^-_2 $ )和过氧化氢(H2O2)减轻氧化损伤,其活性的阶段性抑制可能暗示抗氧化系统超负荷,导致机体修复能力衰退,这直接威胁底栖生物的生存适应性,进而影响其在生态系统中的功能角色。GST是一种重要的生物转移酶,它可以在GSH参与下催化分解氧化应激过程中产生的脂质过氧化产物,修复或缓解机体细胞的氧化损伤[17]。作为第二阶段解毒酶,又可以催化污染物与GST结合,生成水溶性的GSH硫结合物,起到解毒作用。研究报道紫贻贝暴露于六价铬中GST活性显著增加[43];Cd或苯并芘可分别诱导梨型环棱螺(Bellamya purificata)、栉孔扇贝(Chlamys farreri)鳃、消化盲囊GST活性升高[44 − 45]。本研究中,镉和菲联合暴露在3 d和7 d时对文蛤GST酶活性均具有交互作用。这表明镉和菲暴露造成的氧化应激可以使机体通过反馈调节提高GST活性,通过结合谷胱甘肽(GSH)加速污染物代谢,以对抗氧化损伤,降低镉和菲的细胞毒性[17,46],同时也是一种机体的保护性反应,将外源污染物排出体外,减少在机体中的蓄积,这一机制在贝类应对复合污染时具有关键作用。镉和菲联合暴露对GST的影响在贝类中未见报道,但菲和微塑料联合暴露对四角蛤蜊GST酶活性的影响已有研究,研究发现高浓度的菲(50 µg·L−1)与小粒径微塑料(17 µm)复合可以显著诱导四角蛤蜊GST酶活性,而高浓度的菲(50 µg·L−1)与大粒径微塑料(150 µmol·L−1)复合可以显著抑制四角蛤蜊GST酶活性[18]。
当机体受到氧化应激产生的大量自由基与细胞膜上的多不饱和脂肪酸发生过氧化反应时,产生的过氧化物进一步分解成具有细胞毒性的MDA。因此,MDA质量浓度上升往往代表着机体受到了氧化损伤[18]。研究表明,紫贻贝暴露于镉时MDA含量会增加[47]。96 h的镉胁迫试验后,各胁迫组文蛤鳃组织中MDA含量显著上升,Cd对MDA的诱导作用显著且存在剂量-效应关系[39]。本研究中,镉单一处理组在7 d时MDA含量较对照组显著增加,镉-菲联合暴露组在3 d和7 d时均较对照组显著增加,说明文蛤体受到严重的氧化损伤,而相比单一菲暴露,镉单一处理组及镉-菲联合暴露组造成更严重的氧化损伤。MDA含量的升高反映了脂质过氧化损伤的累积,降低了文蛤的抗逆能力,若自然界或养殖水域内镉、菲超标,则会导致此类生理损伤长期存在,可能导致种群衰退,并通过食物链传递给更高营养级,加剧生态风险。
-
MT是一种富含半胱氨酸(Cys)并广泛存在于生物体内的小分子蛋白,有结合金属离子的能力,也有效调节生物体细胞内的金属离子平衡的能力,具有重金属解毒、清除自由基等的功能。有关贝类 MT 基因作为环境污染物的分子标记物一直以来是研究重点,但是关于有机污染物对贝类体内MT基因表达影响的相关报道还较少。目前仅见苯并芘对毛蚶体内MT基因具有诱导作用[48]。本研究中,文蛤受到水环境中镉和菲的胁迫,外套膜中MT基因在不同的处理组均被显著性诱导,说明外套膜中产生大量的金属硫蛋白来对污染物进行解毒代谢。菲对MT基因的诱导程度比镉对MT基因的诱导程度高,可能与暴露浓度有关,高浓度的菲刺激了文蛤启动解毒代谢机制。有研究报道,牡蛎(Crassostrea brasiliana)中与解毒代谢有一定关联的基因,如CYP2-like1和CYP2AU1基因也会被菲激活[49, 35]。在其他有机污染物的报道中也发现相似的研究结果。苯并芘暴露下,厚壳贻贝鳃和消化腺中与解毒代谢相关的基因McCYP3A1被诱导,栉孔扇贝中CYP3A-like基因表达量显著上升[50]。
Hsp70是一类应激蛋白,在结构上高度保守。在细胞受到外界环境胁迫时应激表达,帮助变性蛋白复性和清除永久性变性蛋白,在污染物刺激下,其表达量会显著增加。本研究中,暴露7 d时,与对照组相比,镉单一处理组hsp70表达量无显著性差异,而菲单一处理组及镉-菲联合暴露组hsp70基因均被显著性诱导,且镉-菲联合暴露组hsp70表达量是菲单一处理组hsp70表达量的3.12倍。双因素方差分析表明,暴露7 d时,镉菲联合暴露对文蛤hsp70表达量具有显著的交互作用,说明镉-菲联合暴露下,文蛤受到胁迫时,为防止细胞内蛋白凝聚或变性,维持细胞内环境稳定,hsp70 mRNA被诱导表达来增强机体抗刺激及生存能力。
本研究中,MT的长期诱导可能反映重金属在食物网中的潜在累积风险[48],hsp70的高表达可能预示生态系统面临持续污染压力[14,22, 28]。当污染物浓度超过阈值时,抗氧化系统可能暂时崩溃,但通过基因调控(如MT基因和hsp70的诱导)实现长期耐受。这种耐受性对维持潮间带贝类种群的稳定性至关重要,尤其在渤海湾等镉-菲复合污染频发的区域,文蛤可能通过此类机制成为生态系统的“缓冲物种”,延缓污染物向高营养级的传递[51]。
-
研究镉菲单一与联合暴露对文蛤外套膜抗氧化酶及解毒代谢基因的影响,结果表明,文蛤具有较好的抗氧化性和解毒代谢功能。实验结果表明,镉和菲联合暴露对文蛤的氧化胁迫大于菲和镉单独作用。说明抗氧化酶和解毒代谢基因等指标可以作为镉和菲污染的早期预警分子,外套膜可以作为合适的材料。
Effects of phenanthrene and cadmium on oxidative stress and detoxification in Meretrix meretrix
DOI: 10.15886/j.cnki.rdswxb.20240157
- Received Date: 2024-10-21
- Accepted Date: 2025-07-20
- Rev Recd Date: 2025-03-20
- Available Online: 2025-08-21
-
Key words:
- cadmium /
- phenanthrene /
- Meretrix meretrix /
- oxidative stress /
- detoxification
Abstract: In order to understand the effects of cadmium and phenanthrene on the oxidative stress and detoxification in the mantle of Meretrix meretrix, the SOD, CAT, GST activities and MDA content were detected under single and combined exposure to cadmium and phenanthrene. The metallothionein (MT) and heat shock protein) hsp70 gene expressions were also measured. The results showed that the SOD activity and GST activity in all the treatments were significantly increased compared with those in the control group (P<0.05), that the CAT activity and MDA content were significantly increased compared with that in the control group (P<0.05) except for the group exposed to Cd. MT gene expression was significantly induced in all treatments, and that the hsp70 gene expression was significantly induced except for the group exposed to Phe. At the 3 d of exposure, interactive effects were observed in all the indexes except for hsp70; at the 7 d of exposure, interactive effects were observed in all the indexes except for CAT activity and MDA content. It is indicated that Cd and Phe have significant effects on the oxidative stress responses in M. meretrix. The MT gene and hsp70 gene are induced to detoxify and regulate the body, improving its ability to resist stimuli and survive.
| Citation: | LIU Xue, JING Yuanyuan, SUN Ming, HU Fanguang, ZHANG Tianwen, LIU Guangbin, GAO Fei. Effects of phenanthrene and cadmium on oxidative stress and detoxification in Meretrix meretrix[J]. Journal of Tropical Biology. doi: 10.15886/j.cnki.rdswxb.20240157 |







 DownLoad:
DownLoad: