-
植物激素是植物生长和发育的关键调节因子,广泛参与植物抵御环境胁迫[1]。植物面对外界胁迫时,一般会激活其体内复杂的免疫调控网络,包括植物体内激素浓度的变化、活性氧(Reactive oxygen species,ROS)的爆发、丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)的激活、胼胝质沉积增加和防御相关基因表达等[2]。生长素几乎存在于所有植物中,参与植物细胞发育的各个阶段。此外,还作为植物免疫信号网络的调节因子参与调节植物发育和防御之间的平衡[3]。Aux/IAA(Auxin/indoleacetic acid)、SAUR(small auxin-up RNA)、GH3(Gretchen Hagen 3)3个家族属于生长素早期应答基因家族[4]。其中,Aux/IAA家族在生长素早期响应中起核心作用,调控生长素信号转导的整个过程[5]。目前,Aux/IAA蛋白已被证实是生长素反应的负调节因子,其可通过与生长素反应因子ARF(Auxin response factor)相互作用进而调节其转录活性发挥作用[4]。在番茄(Solanum lycopersicum)、拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、高粱(Sorghum bicolor)、玉米(Zea mays)和马铃薯(Solanum tuberosum)等植物中分别鉴定26、34、31、25、31和26个Aux/IAA基因成员[6-11]。研究表明,拟南芥的AtIAA3,AtIAA19,AtIAA28参与其侧根的形成[12]。小麦(Triticum aestivum)TaIAA1参与调控其根、叶、花等器官的发育[13]。而番茄的SlIAA27沉默植株可提高对生长素的感应,导致胚珠和花粉的发育均明显下降[14]。此外,有研究报道,Aux/IAAs在各种逆境胁迫中起着关键作用,如OsIAA18通过调节ABA信号传导,参与水稻的耐旱和耐盐性[15];AtIAA5,AtIAA6,AtIAA19则通过调节脂肪族硫代葡萄糖苷(Glucosinolate,GLS)的水平进而调控拟南芥耐旱性[16]。也有研究表明,IAAs参与植物的生物胁迫应答反应,如棉花(Gossypium hirsutum)的GhIAA43表达量受黄萎菌Verticillium dahliae 侵染影响,且通过调节水杨酸合成和信号传导相关基因表达介导棉花对V. dahliae抗性[17],目前,关于热带作物木薯(Manihot esculenta )Aux/IAAs的相关研究鲜见报道,在不同品种(‘SC124’、‘F01’、‘16P’、‘F9I’、‘KU50’和‘C4’)中,通过脱落酸、盐、低温、高温、干旱胁迫仅处理分析了Aux/IAAs的表达量[18],具体功能有待进一步探究。
木薯(Manihot esculenta)是重要的粮食作物和经济作物,是世界热带和亚热带地区近10亿人赖以生存的主粮[19],也被广泛用于制药、造纸及饲料加工等行业,是我国生产饲料、乙醇和工业淀粉等的重要原材料。在农业生产中,木薯产量受到诸多生物和非生物因素的制约。本研究从木薯‘SC124’品种克隆了MeIAA19基因,通过生物学信息分析、蛋白亚细胞定位和蛋白的生物学功能分析,初步明确了MeIAA19蛋白功能,现报道如下。
-
试验材料为木薯品种‘SC124’ (‘South China 124’)的后代,种植于海南大学海甸校区热带农业试验基地(20°03′N,110°19′E)。
-
取适量木薯叶片进行液氮速冻,将其充分研磨至粉末,使用CTAB法[20]提取RNA,反转录为cDNA后,−80 ℃低温储存。
根据Phytozome数据库中木薯MeIAA19基因的序列信息,设计全长扩增引物MeIAA19-F(ATGGCGAGCGTGCTAGGAGGC)和MeIAA19-R(TCAGGTTCTGCTCTTGCATTT)。以木薯cDNA为模板,扩增MeIAA19片段。产物经琼脂糖凝胶电泳检测后进行切胶回收,并连接至pEASY-T3载体中。转化后经菌落PCR检测,挑选条带单一的阳性克隆测序验证。将测序对比结果与目的片段一致的菌液低温保存备用。
-
通过在线软件ProtParam分析MeIAA19编码蛋白的理化性质。使用在线网站InterPro鉴定MeIAA19蛋白序列内的保守结构域。通过数据库Phytozome13查找MeIAA19在其他物种中的同源序列,并运用DNAMAN软件进行比对。
-
利用数据库UniProt对木薯MeIAA19蛋白进行亚细胞定位预测。构建植物表达载体pEGAD-MeIAA19,与空载pEGAD分别转入GV3101农杆菌感受态,并侵染烟草叶片48 h后,通过激光共聚焦显微镜观察侵染的叶片。
-
根据同源重组原理重新设计引物,并在R端加Flag标签,以测序正确MeIAA19-T3的质粒为模板扩增目的片段,连接至BamHI和EcoRI酶切回收后的pET32a载体上,进一步挑取单菌落进行PCR并酶切验证。将验证成功的质粒转入DE3大肠菌株中,并诱导蛋白。菌液OD600值为0.6左右时,加入IPTG,并取0、1、3、6 h样品,离心后弃上清,留存菌体。最后使用磷酸盐缓冲液(Phosphate Buffered Saline,PBS)重悬菌体后进行检测[21]。
-
将37 ℃条件下诱导0、1、3、6 h的蛋白样品,离心并重悬。在其中加入蛋白上样缓冲液,涡旋充分,进行SDS-PAGE电泳检测。电泳完成后,分别进行考马斯亮蓝染色和WB检测[22]。
-
按照1.5步骤摇菌诱导蛋白后,测定MeIAA19-pET32a和pET32a蛋白浓度,以0.5 mg·mL−1的浓度进行早晚喷施木薯叶片。3 d后取样测活性氧并提RNA反转录cDNA,分析MePR1和MePR2的表达量。
-
所用Xam菌株由实验室自行分离鉴定。将Xam菌株活化后用无抗LB在28 ℃条件下培养12 h后,将菌液放入离心机中4 000 r·min−1,离心10 min得到菌体,用渗透液(100 mL ddH2O中含1 mL 1 mol·L−1 的MgCl2,pH5.7)重悬菌体后接种处理木薯叶片。
-
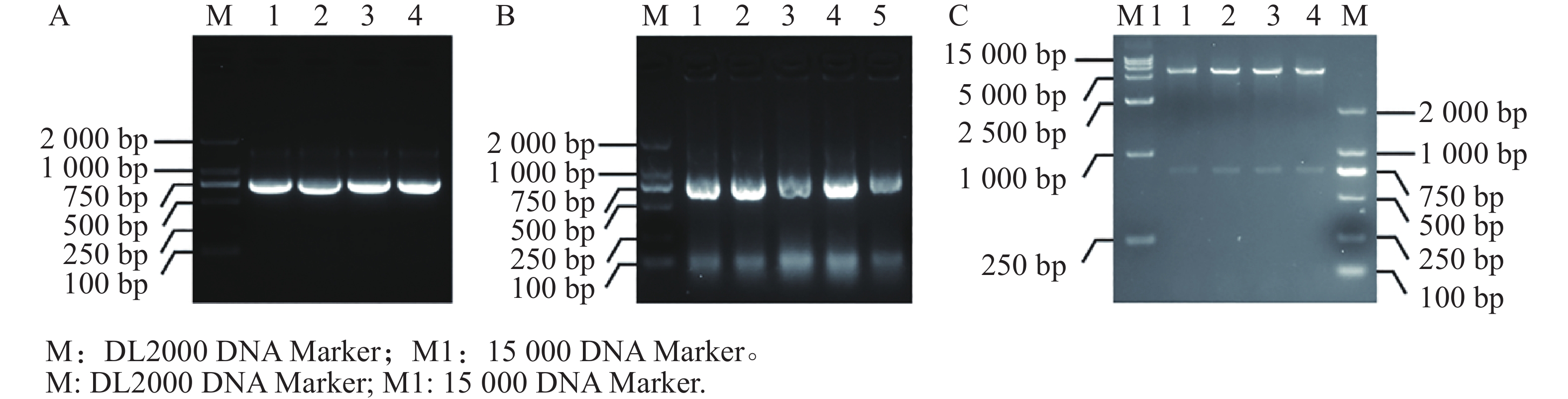
使用引物对MeIAA19-F/R对木薯叶片的cDNA进行PCR扩增,获得约750 bp大小的特异亮带(图1),将目的片段进行回收纯化后连接pEASY-T3载体并转化至大肠杆菌中。通过单菌落PCR验证,得到条带大小与目的片段一致的阳性克隆,并将以上单克隆摇菌送测序。测序结果显示扩增序列片段长732 bp,序列比对后发现其与木薯基因组数据库中的MeIAA19基因序列一致。
-
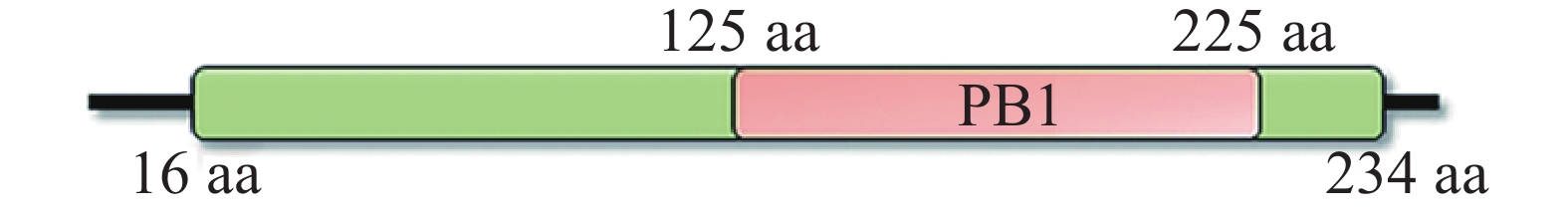
使用在线工具ProtParam分析MeIAA19编码蛋白的理化性质,结果显示:MeIAA19编码244 aa,等电点为6.63,蛋白分子量为26.64 kDa,脂肪系数为67.90,亲水系数为−0.515(<0),不稳定系数为37.71(<40),属于稳定亲水蛋白(表1)。同时,使用InterPro在线网站鉴定MeIAA19蛋白序列内的保守结构域,发现MeIAA19蛋白在其16~234 aa中含有AUX/IAA结构域,其中,125~225 aa处含有1个PB1保守结构域,与AUX/IAA家族的特征一致(图2)。
基因
Gene蛋白分子量/kDa
Protein molecular weight/kD等电点
Isoelectric pointGRAVY
亲水性平均值脂肪系数
Aliphatic index不稳定指数
Instability Index氨基酸数量
Number of amino acidsIAA19 26.64 8.20 −0.515 67.90 37.71 244 Table 1. The physical and chemical properties of MeIAA19
-
为了研究MeIAA19蛋白在不同植物中是否具有较高的同源性,将MeIAA19与杨树(Populus deltoides)、水稻、拟南芥、大豆(Glycine max)、香蕉(Musa acuminata)、番茄、马铃薯的IAAs序列进行同源比对,发现IAAs蛋白在不同的植物中具有较高的特异性,且在C端具有较高的保守性(图3)。MeIAA19与杨树中IAA蛋白的同源性最高,同源性为84.67%。
-
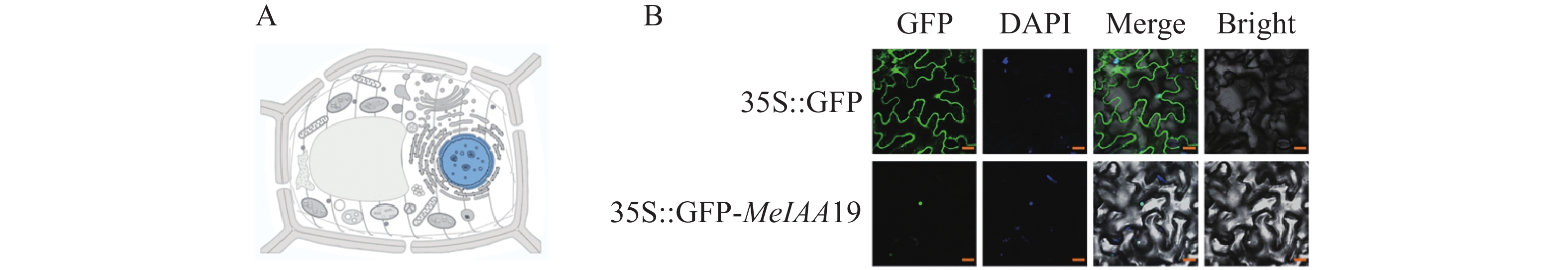
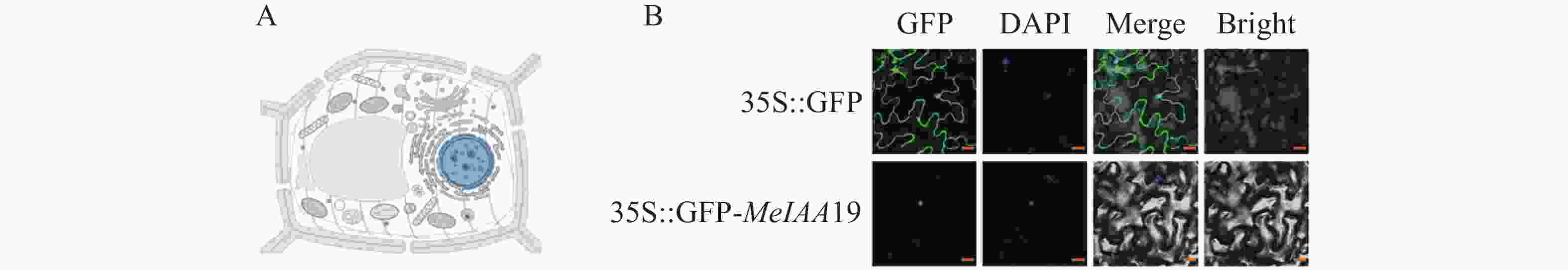
为了探究MeIAA19蛋白在植物体内的亚细胞定位,对MeIAA19蛋白的定位进行预测,结果表明:MeIAA19蛋白定位于细胞核中(图4−A)。同时,为了进一步确定其定位,通过农杆菌侵染烟草观察荧光发现对照组pEGAD空载在细胞核和细胞质均分布较强的绿色荧光信号,而融合表达载体MeIAA19-pEGAD只在细胞核观察到绿色荧光,与DAPI染色结果一致,说明MeIAA19蛋白定位于细胞核中(图4−B)。
-
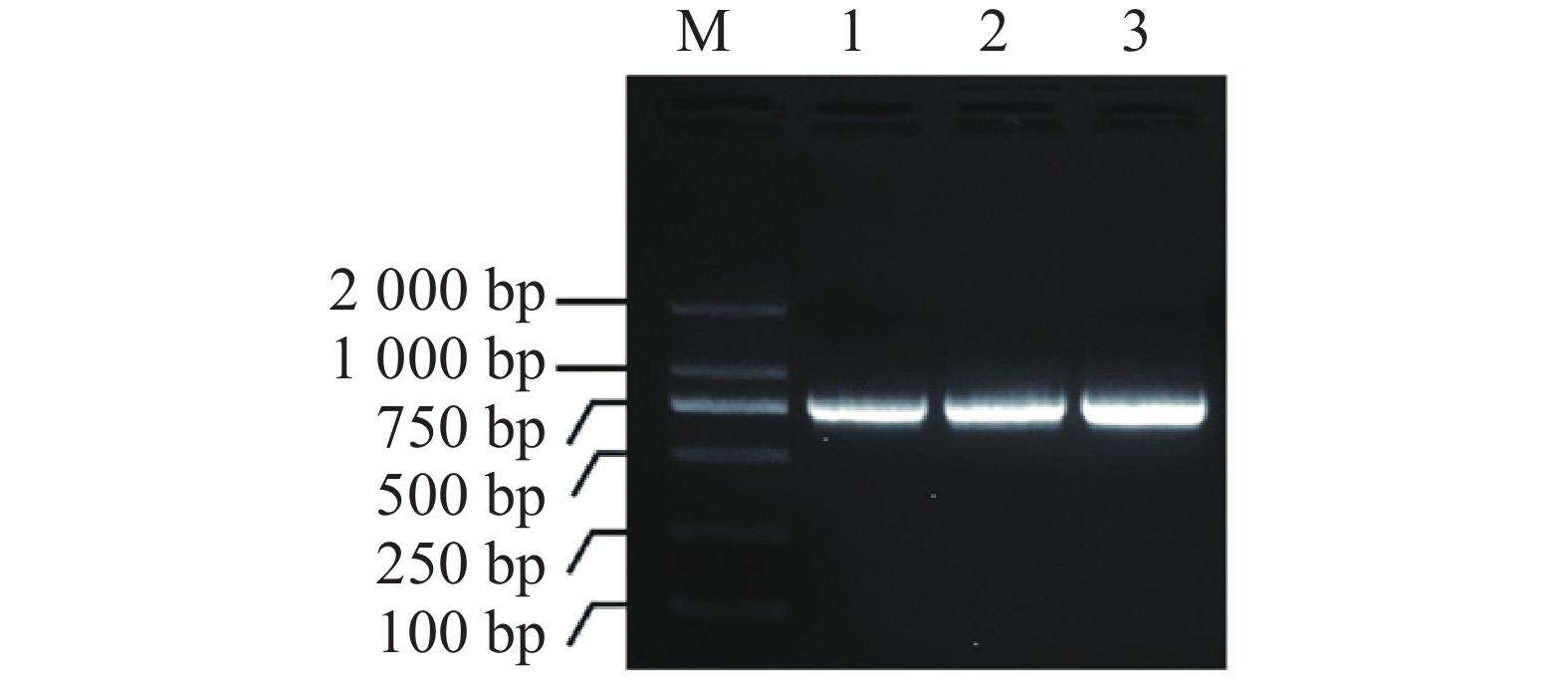
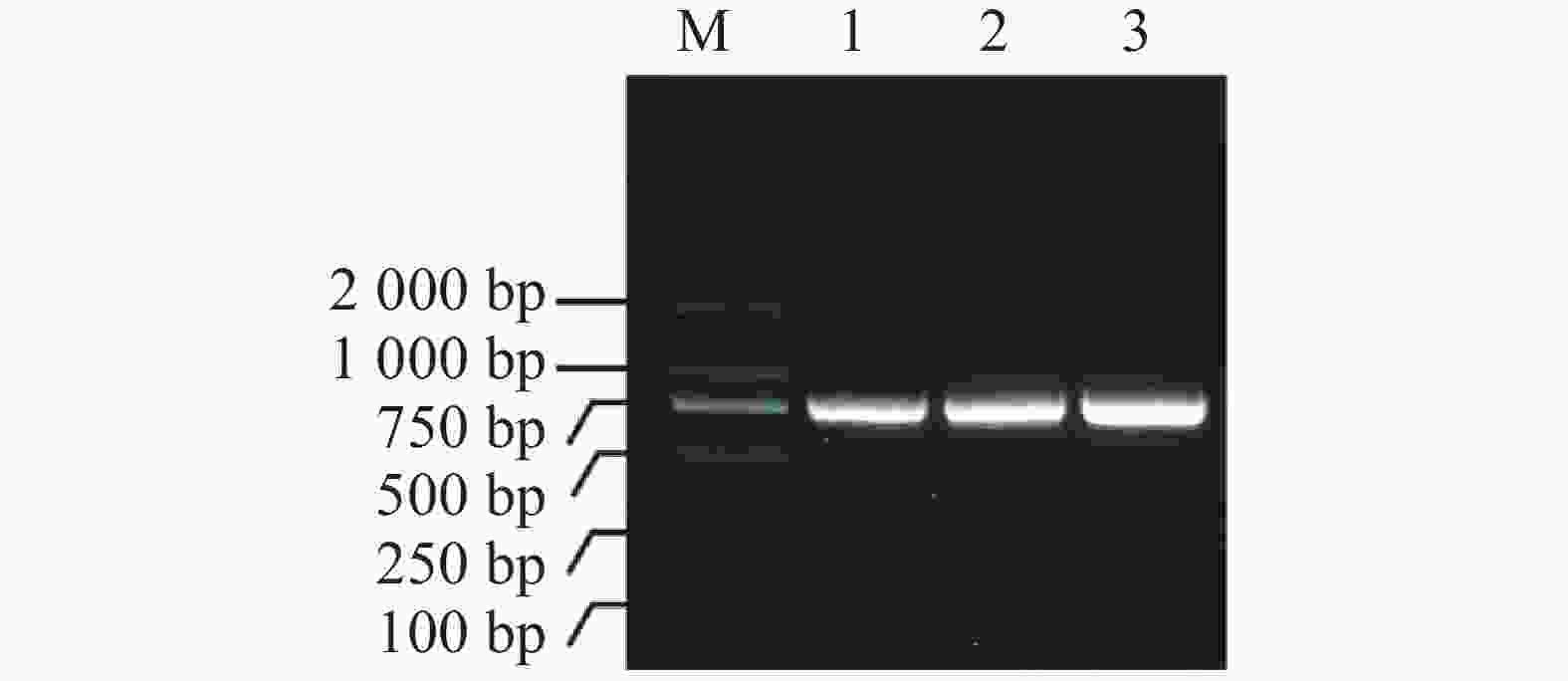
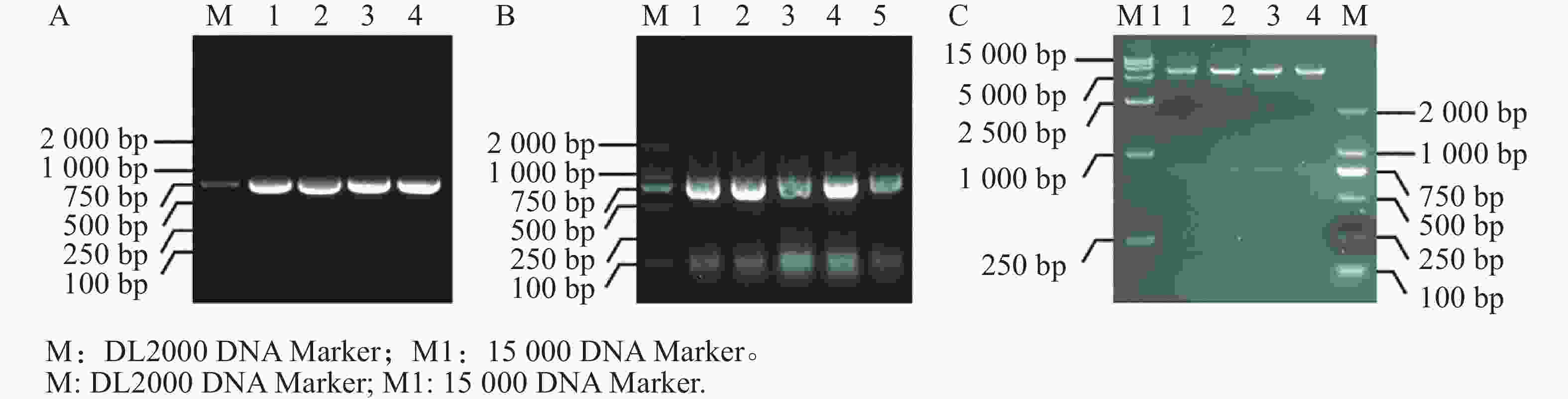
提取测序正确的MeIAA19-T3菌株质粒,并通过PCR扩增得到目的片段(图5−A),通过同源连接法将MeIAA19连接到pET32a载体上,再进行菌落PCR验证(图5−B),进一步双酶切验证获得4个阳性克隆(图5−C),表明MeIAA19-pET32a融合载体构建成功。将构建好的MeIAA19-pET32a (DE3)菌株置于37 ℃诱导蛋白,分别于诱导表达0、1、3、6 h取蛋白样品。
-
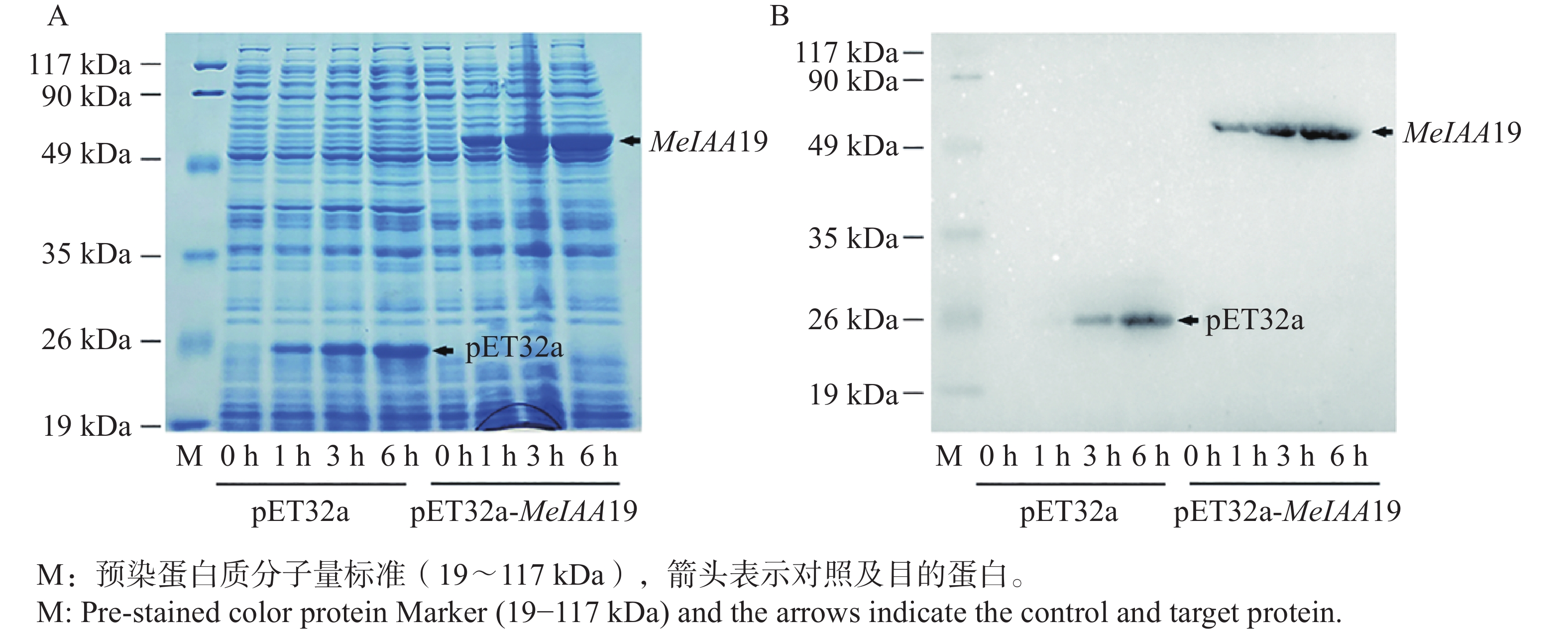
将不同时间点的蛋白样品进行超声破碎、离心,通过考马斯亮蓝染色(图6−A)和Western blot(图6−B)进行验证。结果显示,该温度下可以成功诱导目的蛋白,并且随着诱导时间的增加,其蛋白浓度也随之增加。
-
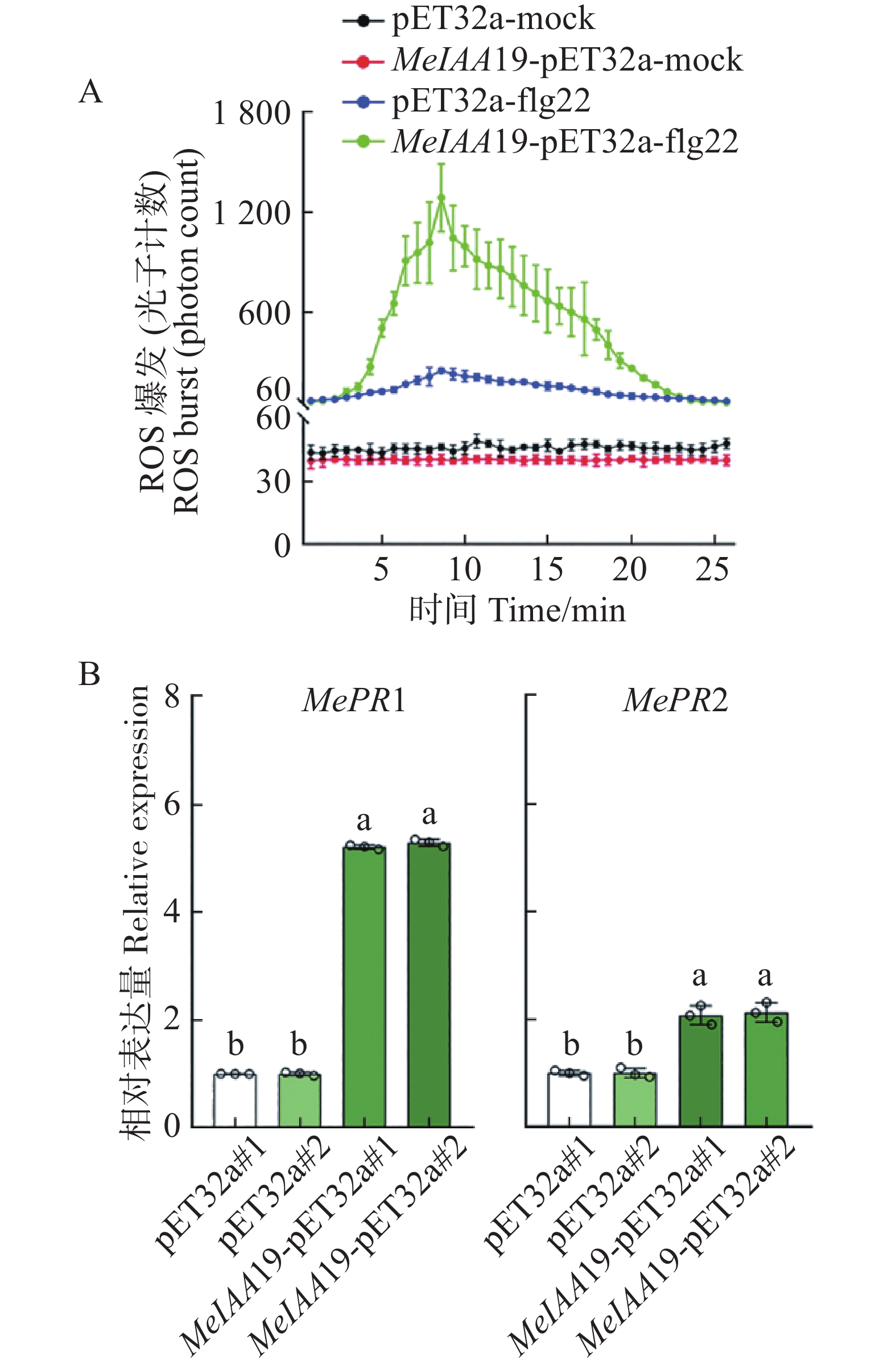
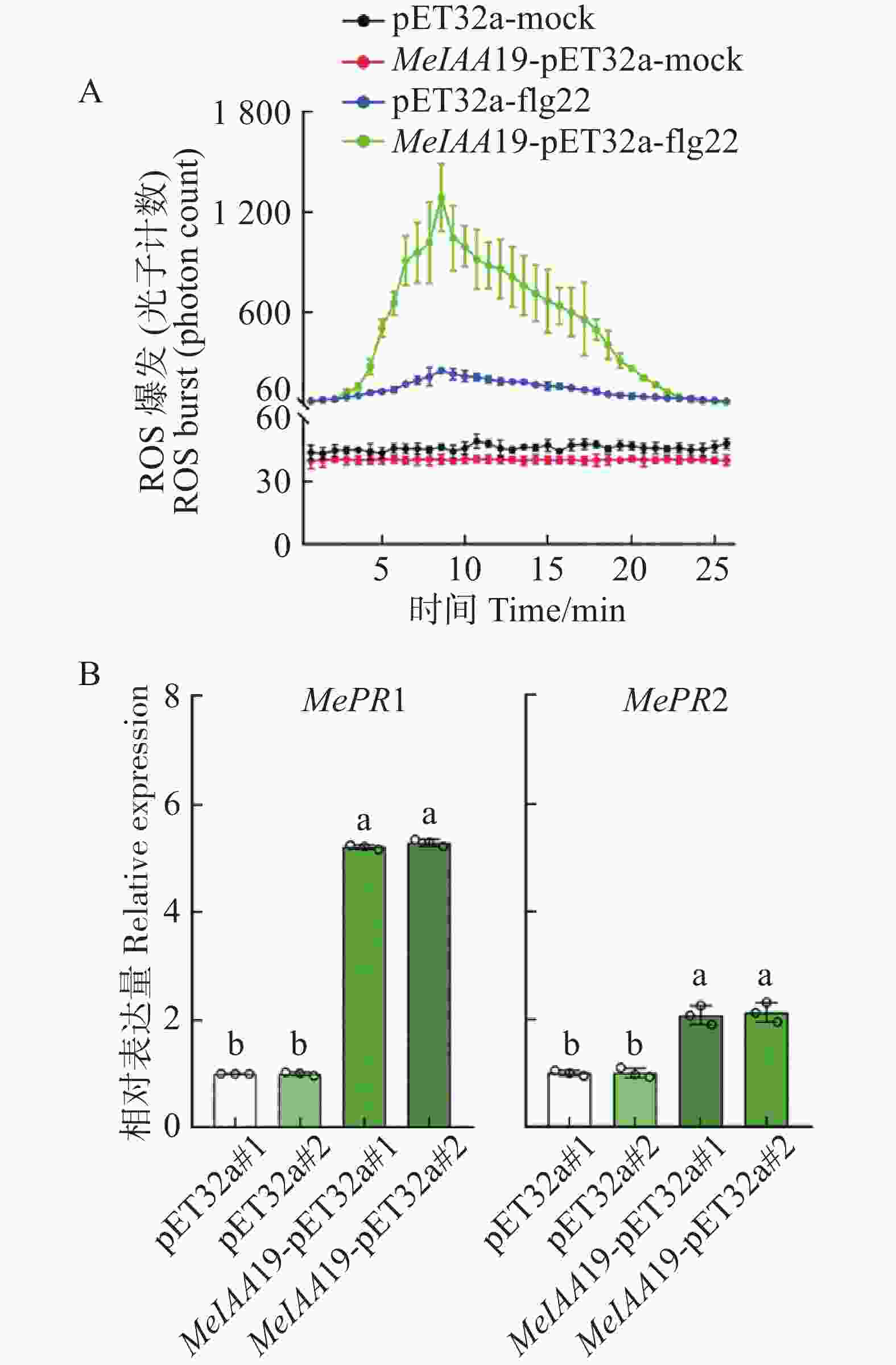
为了探究MeIAA19蛋白是否参与木薯的免疫反应,将MeIAA19-pET32a和对照pET32a蛋白分别喷施于木薯叶片上,发现喷施MeIAA19-pET32a蛋白后,其活性氧爆发明显增加与对照组相比(图7−A)。同时,实验组中MePR1的表达量是对照组5倍、MePR2表达量是对照组的2倍(图7−B),差异极显著,推测该蛋白参与木薯免疫反应。
-
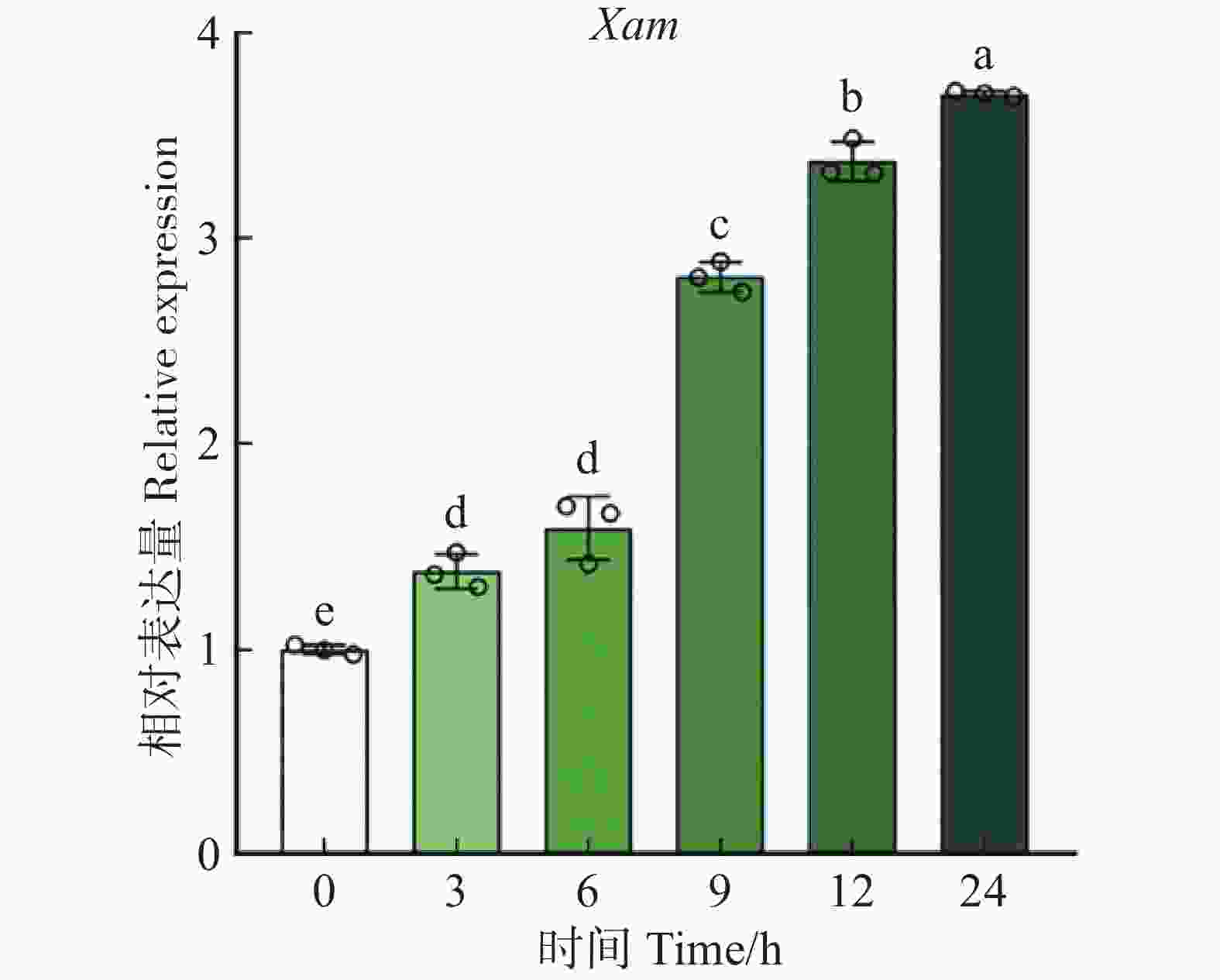
为进一步探究MeIAA19在响应生物胁迫中的功能,分析其在Xam胁迫处理下的表达模式,发现接种Xam后MeIAA19的转录水平在0~24 h内随时间的增加呈现上升的变化趋势(图8),进一步表明MeIAA19可能参与木薯的免疫反应。
-
生长素几乎在所有植物中都有存在,广泛参与植物生长、发育及各种逆境胁迫等过程[3, 23 − 24]。AUX/IAA家族是生长素早期响应的关键家族,是调控植物生长素反应的重要转录调节因子,与生长素反应因子相互作用发挥功能[5 − 6]。
本研究从木薯中克隆并鉴定MeIAA19基因,其编码蛋白包含1个Phox and Bem1p(PB1)保守结构域,该结构域促进Aux/IAA和ARF蛋白的相互作用[25],推测MeIAA19可能与ARF蛋白互作,进而通过IAA信号介导木薯的生长发育和响应胁迫反应,还需进一步的深入探究。通过烟草瞬时转化证实MeIAA19定位于细胞核。此外,外源施加该蛋白可显著诱导木薯的活性氧爆发和免疫相关基因MePRs的表达。这些结果表明MeIAA19可能通过活性氧信号和水杨酸信号调节木薯的免疫反应,与前人的研究结果基本一致[26]。本研究通过原核表达蛋白并分析该蛋白的功能,缩短研究周期,是一种快速研究基因功能的简单便捷的方法。
研究表明,AUX/IAA基因家族参与植物免疫[17],通过对木薯叶片进行Xam胁迫处理,发现MeIAA19转录水平随Xam侵染时间的增加呈现上升的变化趋势。在拟南芥中,AUXIN RESISTANT2 (AXR2)(编码IAA7蛋白)和AUXIN RESISTANT3 (AXR3)(编码IAA17蛋白)的表达量在Fusarium oxysporum处理下被显著诱导表达,且负调控拟南芥对F.oxysporum的抗性[27]。此外,棉花的GhIAA43通过调节水杨酸合成和信号传导相关基因(PAL、PAD4、NPR1、EDS1、PR1、PR2、PR3和PR4)表达介导棉花对V.dahliae抗性[17]。同样,水杨酸通过稳定IAA7蛋白从而介导拟南芥对Pseudomonas syringae pv. tomato DC3000 (PstDC3000) 的抗性[28],推测MeIAA19可能通过介导多个信号通路参与木薯对细菌性枯萎病的抗性。同时,这些结果表明IAAs广泛参与介导植物对细菌性和真菌性病害的免疫反应。此外,研究表明MeIAA19主要在不同品种苗期和主根的形成期表达,且低温、高温、盐胁迫等非生物胁迫处理抑制其表达[18],说明MeIAA19可能参与木薯苗期的发育和主根的形成。总之,MeIAA19有望作为潜在的木薯抗病育种候选基因。这对后续探究木薯MeIAA19抗逆的调控机理奠定基础,也为发掘MeIAA19在木薯遗传改良或生物技术应用中的潜在价值提供参考。
Cloning and preliminary functional analysis of MeIAA19 in cassava
DOI: 10.15886/j.cnki.rdswxb.20240145
- Received Date: 2024-09-14
- Accepted Date: 2025-02-28
- Rev Recd Date: 2024-11-05
- Available Online: 2025-05-23
- Publish Date: 2025-05-25
-
Key words:
- cassava /
- Aux/IAA proteins /
- prokaryotic expression /
- expression analysis /
- functional analysis
Abstract: Auxin is widely present in plants and plays an important role in mediating plant development and disease resistance. The Aux/IAA family are widely involved in the early response of auxin and regulate the entire process of auxin signal transduction. In order to study the characteristics of Aux/IAA and their roles in reponse to stresses, this study cloned and identified the MeIAA19 from cassava, which encodes 244 aa with a typical PB1 conserved domain of Aux/IAA proteins. Additionally, MeIAA19 protein, expressed and purified from DE3 strains, could significantly induced ROS burst and MePR1 and MePR2 expression. Moreover, the expression level of MeIAA19 significantly increased with time under Xam infection. These results will provide a certain theoretical basis for exploring the function and mechanism of action of the MeIAA19 in cassava.
| Citation: | LIU Xiaoli, WEI Yunxie. Cloning and preliminary functional analysis of MeIAA19 in cassava[J]. Journal of Tropical Biology, 2025, 16(3): 363-369. doi: 10.15886/j.cnki.rdswxb.20240145 |









 DownLoad:
DownLoad: