-
抗菌肽(antimicrobial peptides, AMPs)也称抗微生物肽和宿主防御肽,是一类具有抗菌活性的小分子量多肽,一般由20 ~ 50个氨基酸组成,具有净正电荷,广泛存在于各类植物、动物、真菌、细菌以及人体中[1-3]。依据来源的不同,可将抗菌肽划分为动物抗菌肽、微生物抗菌肽及人造抗菌肽等[4]。抗菌肽参与多种生物学功能,比如免疫调节、血管生成、伤口愈合、抗炎活性和抗肿瘤活性。随着对抗菌肽研究的不断深入,人们发现与传统抗生素相比,抗菌肽会作用于病原菌细胞膜,通过物理方式使病原菌死亡,因而不易使病原菌产生耐药性,其作为抗生素的替代药物具有巨大发展潜力[5-6]。相关研究表明,抗菌肽在临床试验中已取得成功,但受限于其来源,难以投入实际应用[7]。Cathelicidin-1是2006年从鸡(Gallus domesticus)中分离鉴定出来的一种抗菌肽,由26个氨基酸组成,一级结构为NH2-RVKRVWPLVIRTVIAGYNLYRAIKKK-COOH,其具有广谱抑菌活性,能有效抑制单核细胞增多性李斯特氏菌(Listeria monocytogenes)、淋球菌(Neisseria gonorrhoeae)和大肠杆菌(Escherichia coli)等细菌的生长[8-9]。目前,对于该抗菌肽,获取途径仍局限于天然提取和化学合成,成本高昂,而通过基因工程技术构建工程菌株可以高效、低廉、大量生产抗菌肽。因此,笔者拟通过分子克隆技术构建抗菌肽Cathelicidin-1重组载体,在毕赤酵母(Pichia pastoris)GS115中表达,并鉴定包含该抗菌肽的发酵液的抑菌活性,旨在获得体外表达的高活性抗菌肽,为纯化抗菌肽 Cathelicidin-1、研究其作用机制及实际应用奠定基础。
-
本研究使用的菌株与质粒见表1。
实验材料 相关属性 来源 菌株 Strains E. coli DH5α 野生型,
用于质粒克隆实验室保存 P. pastoris GS115 野生型,
用于表达外源蛋白实验室保存 E. coli K88 野生型,
用作指示菌实验室保存 S. aureus ATCC25923 野生型,
用作指示菌实验室保存 质粒 Plasmids pGAPZαA 毕赤酵母蛋白胞
外表达载体实验室保存 pGAPZαA- Cathelicidin-1 用于表达蛋白 本实验构建 -
从美国 NEB 公司选购限制性核酸内切酶和T4 DNA 连接酶;2×Phanta Max Master Mix,DL5000 DNA Marker、质粒提取试剂盒、胶回收试剂盒、PCR 纯化试剂盒购自中国Vazyme公司;双色预染蛋白Marker、酵母基因组提取试剂盒和蛋白上样缓冲液购于中国生工公司;其他所用试剂为国产分析级。
-
抗菌肽Cathelicidin-1的全长核苷酸序列由中国生工公司合成,以该核苷酸序列为模板,通过引物对 Cathelicidin-1-F/ Cathelicidin-1-R扩增 Cathelicidin-1 目的基因(Cathelicidin-1-F:5′-CCGGAATTCCGAGTAAAGCGAGTTTGGCC-3′ ; Cathelicidin-1-R: 5′-TGCTCTAGAGCACCTTGAAAGTACAAGTTTTCCTTC-3′)。 PCR 总反应体系为 12 μL,体系包括:0.5 μL上游引物 ,0.5 μL下游引物,1 μL模板 , 6 μL 2×PCR mix,4 μL ddH2O。PCR 产物经由电泳进行检测,依照试剂盒操作,回收目的条带。
-
首先用限制性核酸内切酶Xba Ⅰ与EcoR Ⅰ消化pGAPZαA质粒与目的基因片段,酶切总体系共 100 μL,组分如下:1 μL内切酶Xba Ⅰ,1 μL内切酶EcoR Ⅰ,10 μL Cutsmart缓冲液 ,500 ng目的基因和500 ng空载质粒 ,60 μL ddH2O 。依照试剂盒说明书,回收酶切产物,使用酶标仪测定浓度,并通过T4 DNA 连接酶20 ℃连接1 h 。通过热激法转化E.coli DH5α 细胞, 37 ℃ 孵育 1 h 后涂布到含 25 mg·L−1博莱霉素的 LB 固体培养基上, 37 ℃ 恒温过夜培养 ,随机选取单菌落至 LB 培养基中,恒温过夜培养12 h ,过夜培养物提取质粒,用目的基因扩增引物对 Cathelicidin-1-F/ Cathelicidin-1-R 进行PCR,将待测样品送至海南楠山生物技术有限公司测序。
-
选取测序正确的阳性转化子到含有25 mg·L−1 博莱霉素的 LB 培养基中,37 ℃ 恒温振荡过夜。用质粒萃取试剂盒纯化回收pGAPZαA-Cathelicidin-1重组载体,并用内切酶BamH I酶切消化,处理体系为50 μL,包括:内切酶BamH I 1 μL,Cutsmart缓冲液 5 μL,质粒 600 ng,ddH2O 30 μL。依照试剂盒操作步骤回收单酶切产物,电转至毕赤酵母GS115感受态细胞中。酵母细胞在 30℃ 孵育 1 h 后涂布到含 50 mg·L−1博莱霉素的YPDS固体培养基上,30 ℃ 恒温培养48 h,随机选取单克隆菌落转移到 YPD 培养基中30 ℃恒温振荡培养,经蜗牛酶处理1 h后,提取酵母基因组,用验证性引物pGAP-F/ 3′AOX1进行PCR以验证阳性克隆子(pGAP-F:5′-GTCCCTATTTCAATCAATTGAA-3′; 3′AOX1:5´-GCAAATGGCATTCTGACATCC-3′),将待测阳性克隆子送至海南楠山生物技术有限公司测序。
-
挑经测序的酵母阳性转化子单菌落至含50 mg·L−1 博莱霉素的5 mL YPD培养基中,30 ℃ 恒温振荡培养 48 h。将酵母培养物按初始浓度106 CFU·mL−1转接到 200 mL YPD 培养基中, 于30 ℃ 发酵培养72 h,然后5 000 r·min−1离心10 min,经滤膜过滤并收集发酵液。取20 μL发酵液与20 μL 2×蛋白上样缓冲液混匀,以转入空载质粒的酵母发酵液为对照,使用试剂盒配置18% Tricine-SDS-PAGE 凝胶,随后进行电泳分析,使用考马斯亮蓝处理1 h,经脱色液处理3 h 后观察结果。
-
以大肠杆菌和金黄色葡萄球菌为指示菌,使用牛津杯法与抑菌曲线法分别测定发酵液抑菌活性。对于牛津杯法,先将转接培养的2种指示菌恒温培育12 h,取5×106 CFU的初始菌量涂板,待平板晾干后,将牛津杯竖直放置其上,往其中加入100 μL发酵液,37 ℃放置12 h后,观察有无抑菌圈,使用游标卡尺记录其直径。对于抑菌活性测定,先使用96孔板接种107 CFU初始指示菌菌量,培养总体积200 μL,然后加入不同体积的发酵液,使其体积分数分别达到25%、50%、75%和100%,以转入空载质粒重组菌株等体积分数的发酵液体为阴性对照,设置3个生物学重复,37 ℃恒温培养24 h,在培养期间,每3 h测定1次OD600吸光值,绘制抑菌曲线。
-
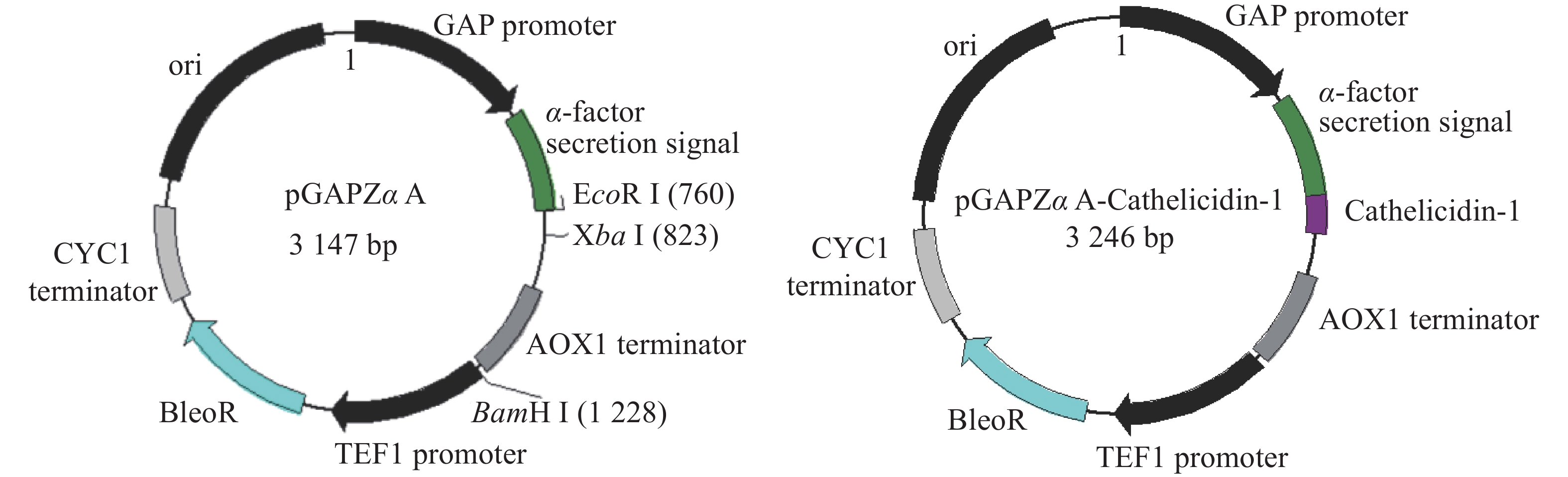
为了获得分泌至P. pastoris胞外的抗菌肽,以便于后续检测,选用pGAPZαA为载体,将外源片段插入其中α−因子分泌信号肽编码序列下游。从图1可知,重组载体在其表达的蛋白N−端添加酿酒酵母α−因子分泌信号肽,使得表达的抗菌肽可以分泌到发酵液中。pGAPZαA的GAP启动子为组成型启动子,无需诱导物即可表达重组蛋白。
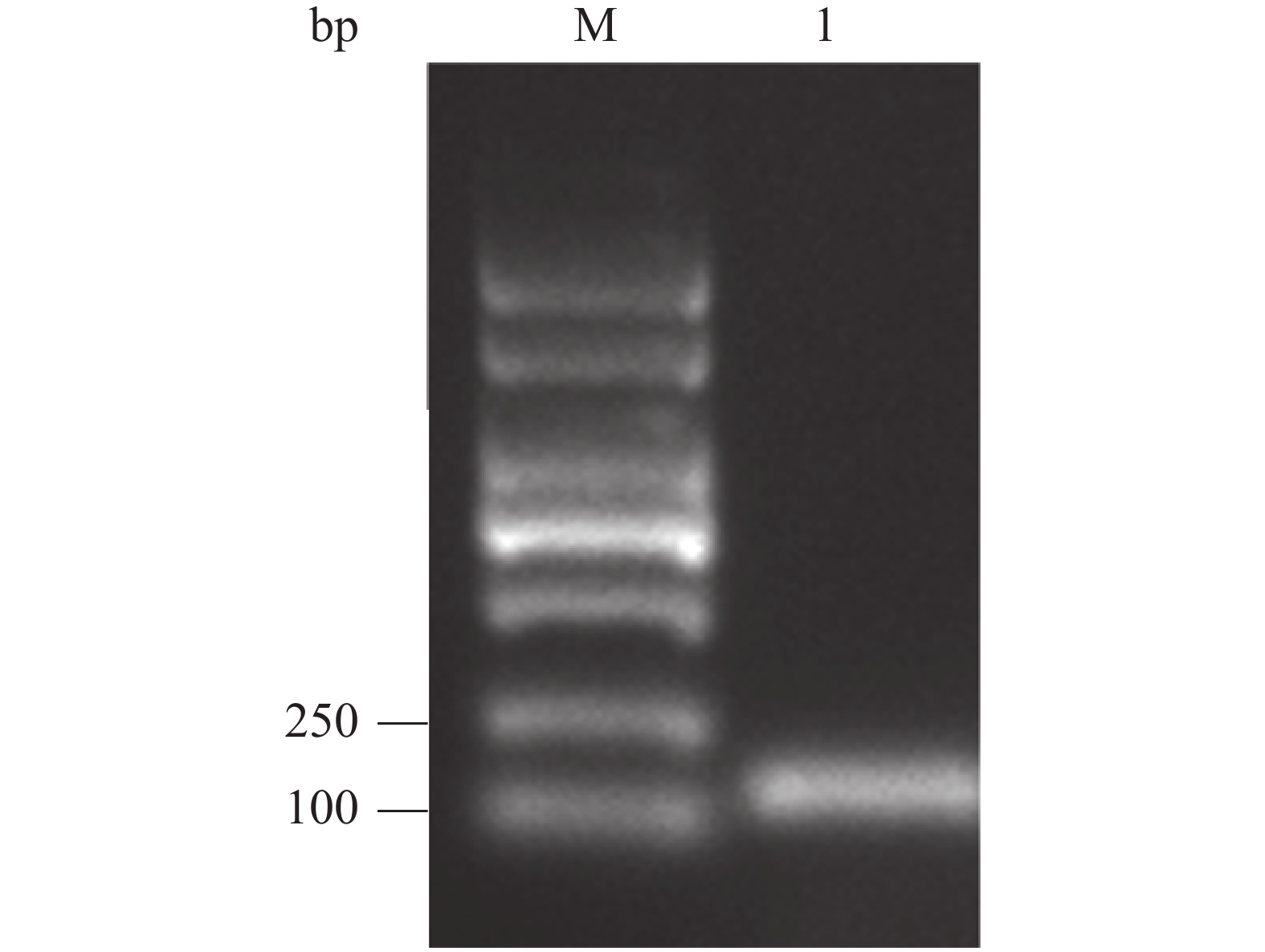
通过PCR扩增Cathelicidin-1全长序列(123 bp),并在其5′及3′端分别引入相应的酶切位点。通过电泳分析PCR产物,由图可知在大约 120 bp处存在1条明亮单一的条带,即为目的条带,表明获得符合预期的PCR产物(图2)。
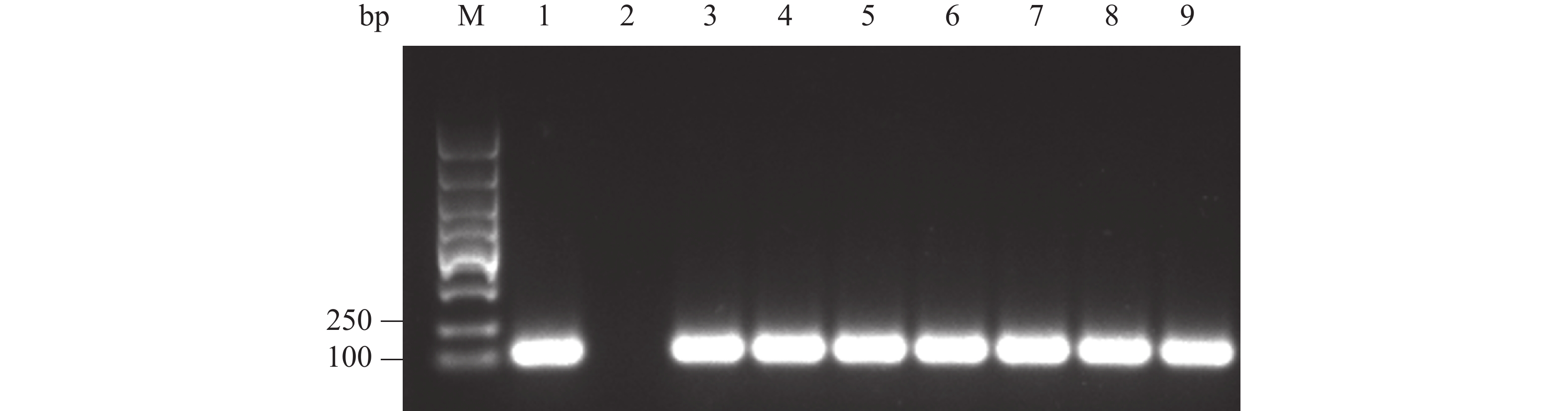
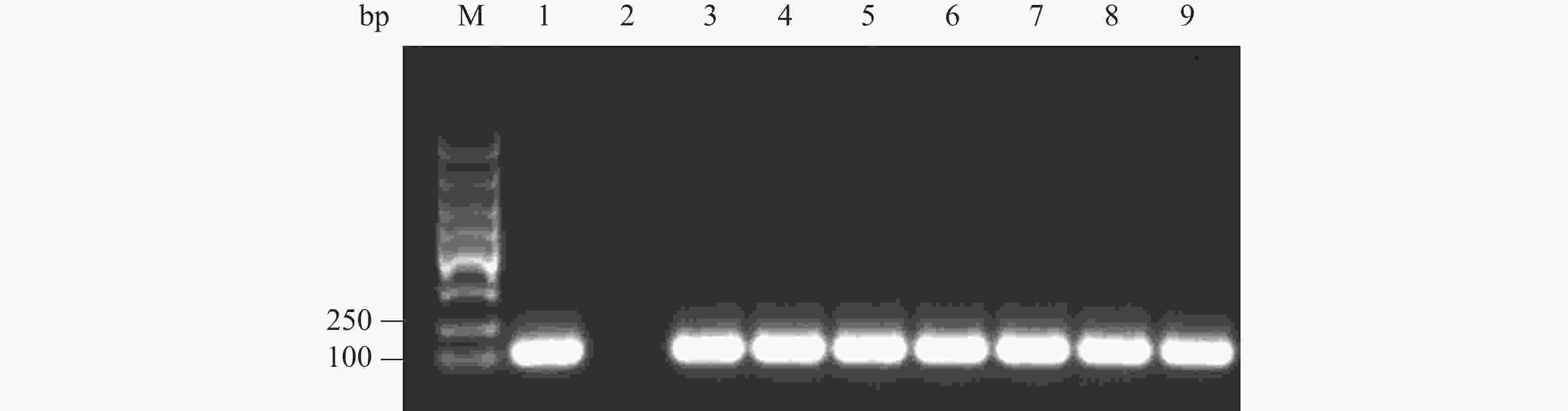
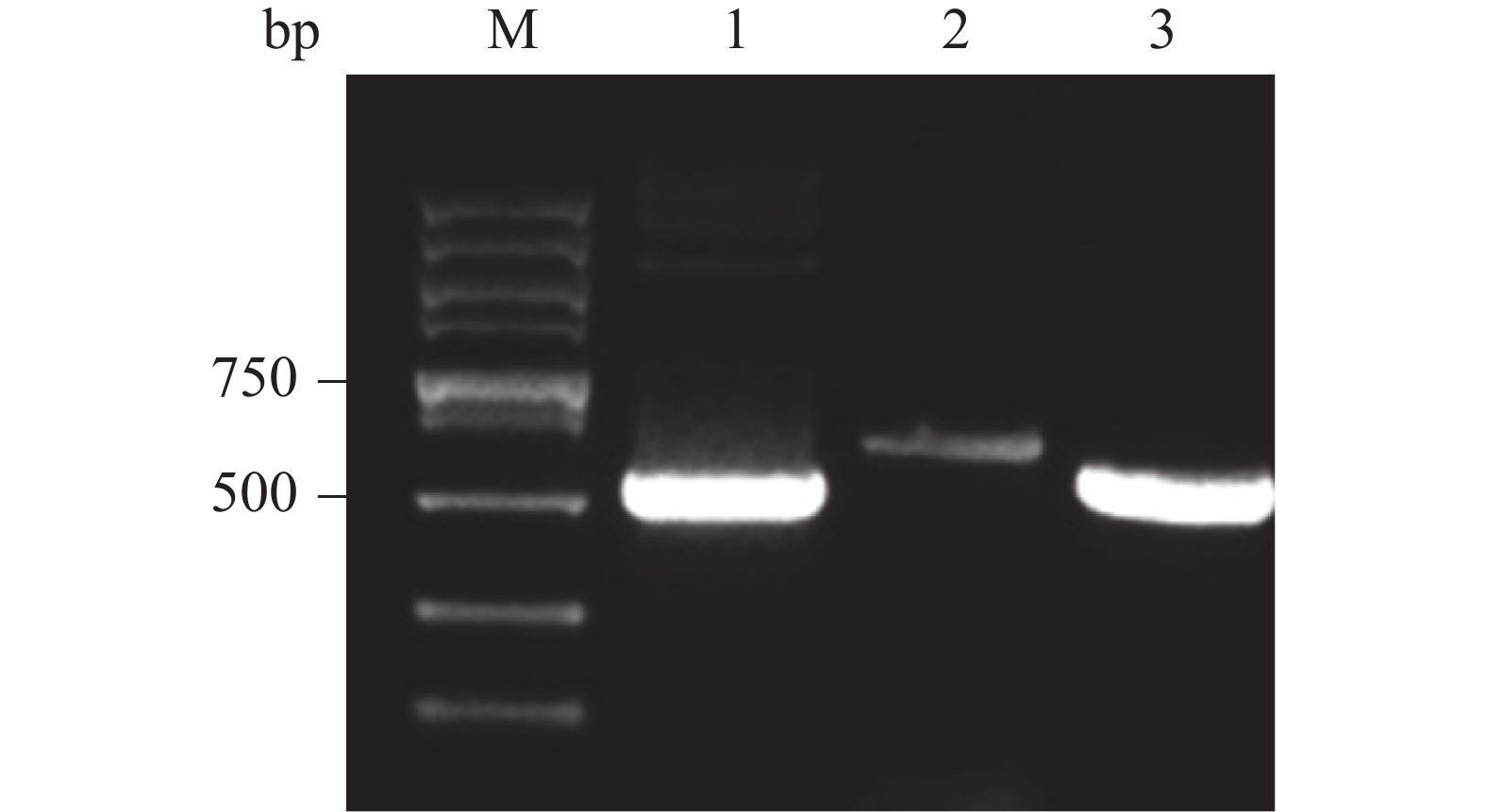
纯化 PCR 产物,与pGAPZαA载体用相同的内切酶Xba Ⅰ和EcoR Ⅰ双酶切处理,回收酶切产物。接着,将酶切产物连接,构建融合表达载体pGAPZαA- Cathelicidin-1,通过热激导入E. coli DH5α 细胞中,均匀涂布到有25 mg·L−1 博莱霉素的抗性平板上。最后,随机挑取抗性平板的单菌落,通过菌液 PCR验证是否为阳性。 电泳结果表明,可以获得 120 bp左右 的目的条带,PCR产物条带单一且浓度丰富(图3,泳道 3~9)。随后提取质粒,送至海南楠山生物技术有限公司,测序对比表明已构建成功重组载体。
-
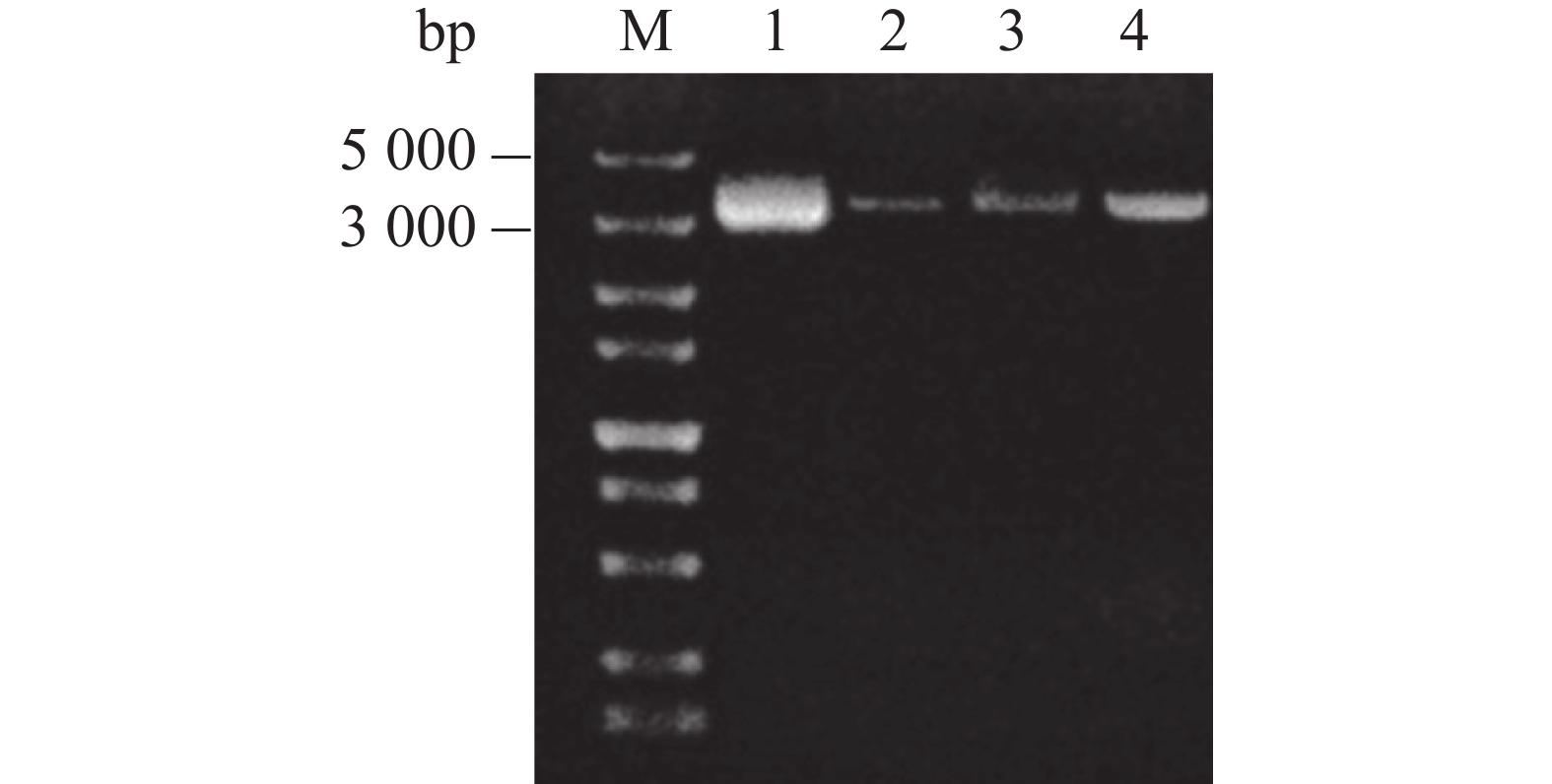
pGAPZαA载体能够整合到酵母染色体上,具有较高遗传稳定性。为了防止环状载体与染色体整合时发生随机断裂,在将重组载体pGAPZαA- Cathelicidin-1转化酵母之前首先对其进行单酶切,以固定断裂位点。由图4可知,通过内切酶BamH I对重组载体进行单酶切后,酶切后的线性质粒(图4,泳道2~4)泳动速度要低于未酶切的环状质粒(图4,泳道1),证明酶切成功,随后纯化单酶切产物。
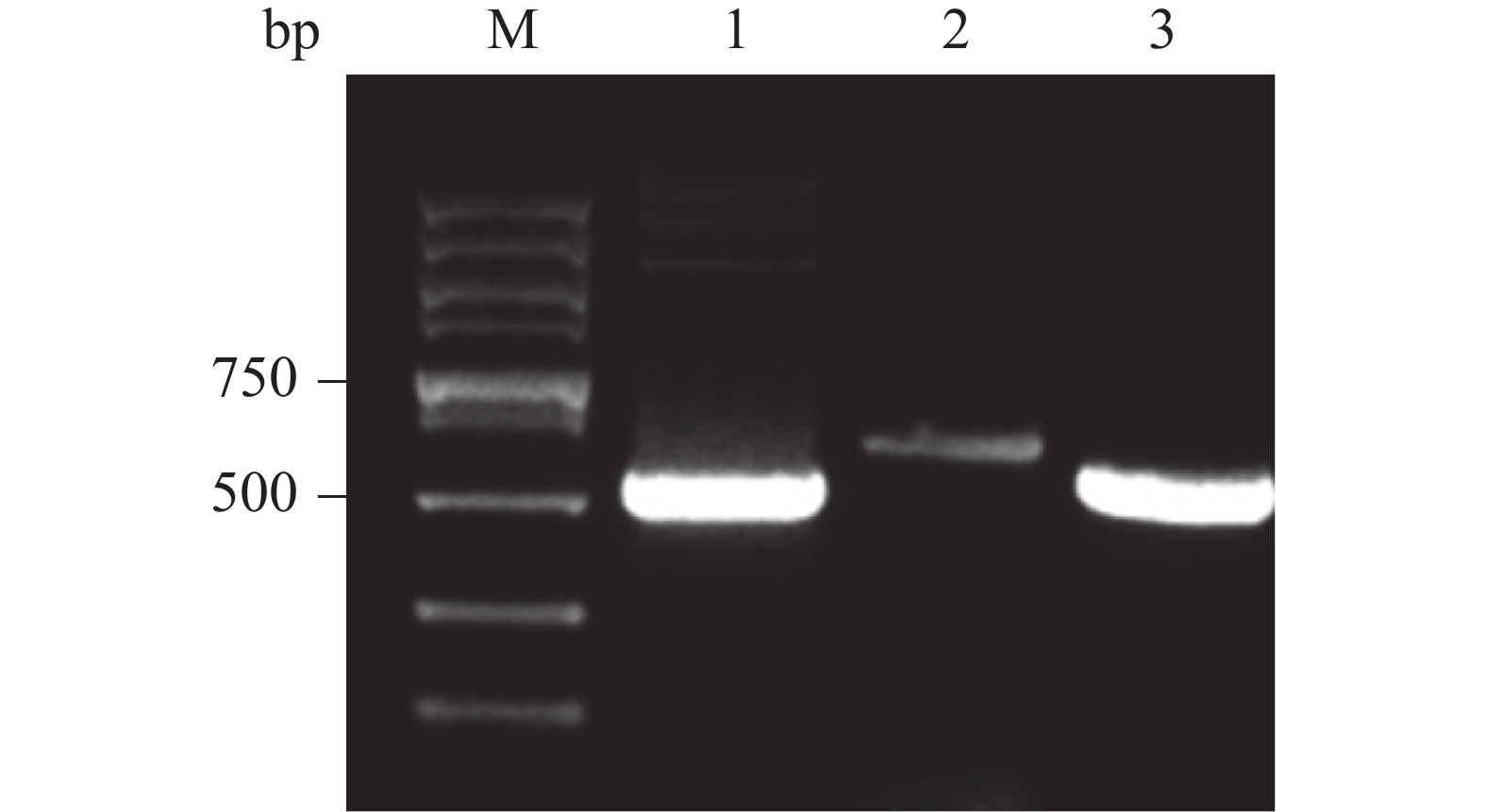
将重组载体单酶切产物电转化至P. pastoris GS115感受态细胞中,均匀涂布在有50 mg·L−1博莱霉素抗性平板上,挑选阳性克隆,转接到5 ml YPD培养基中,培养24 h,经蜗牛酶处理后,提取基因组,通过PCR扩增后,电泳验证。由图可知,能够获得与阳性对照大小一致的目的产物,PCR产物条带单一且浓度丰富(图5,泳道3)。
回收PCR产物,送至海南楠山生物技术有限公司分析,结果表明,重组载体已整合到酵母基因组中,且开放阅读框未出现突变,一致性达100%(图6-A和图6-B)。最后,将重组酵母转接到YPD培养基中发酵72 h,离心收集发酵液,进行Tricine-SDS-PAGE分析,结果表明,与转化空载体的菌株相比,表达抗菌肽的重组菌株发酵液在10 kDa处出现显著目的条带,与预期大小一致,表明抗菌肽以胞外分泌形式表达(图7)。
-
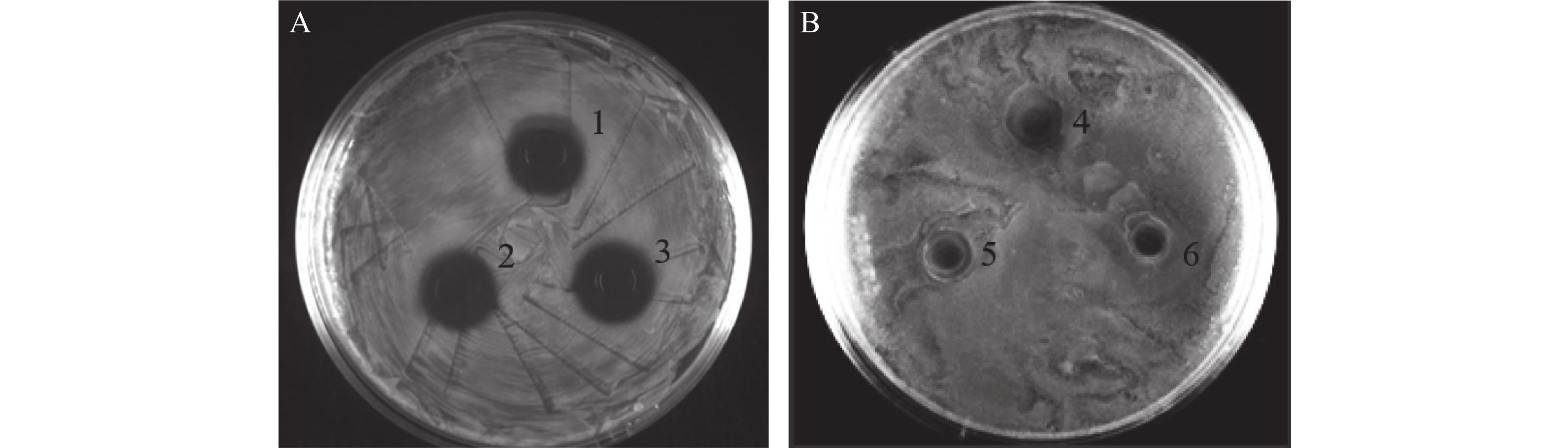
以大肠杆菌和金黄色葡萄球菌分别为革兰氏阴性与阳性指示菌,分别采用牛津杯法和抑菌曲线测定法鉴定本研究重组菌株的发酵液抑菌活性。牛津杯法结果表明,表达抗菌肽Cathelicidin-1的重组酵母发酵液对于大肠杆菌有明显的抑菌效果,产生抑菌圈直径达15 mm(图8-A),而对于金黄色葡萄球菌则观察不到明显的抑菌圈(图8-B),几乎没有抑菌效果。
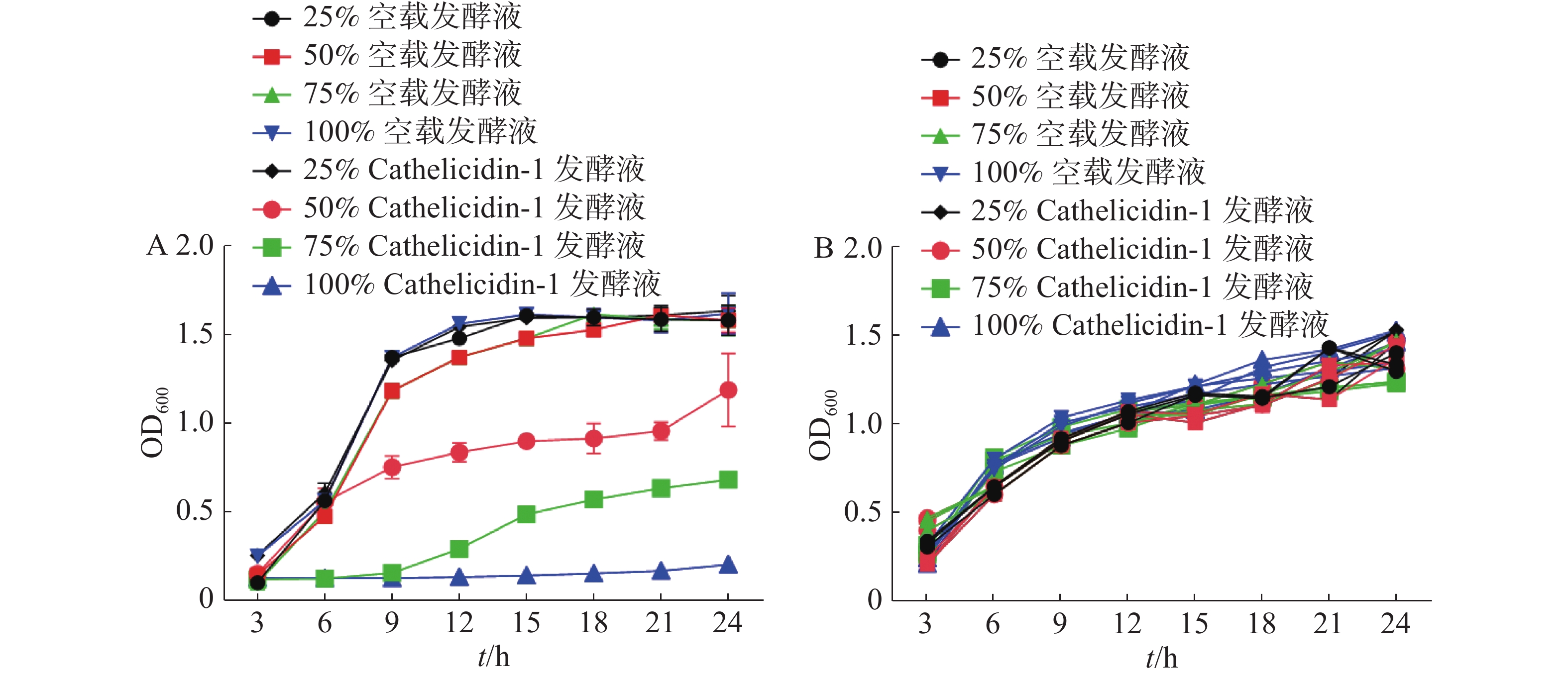
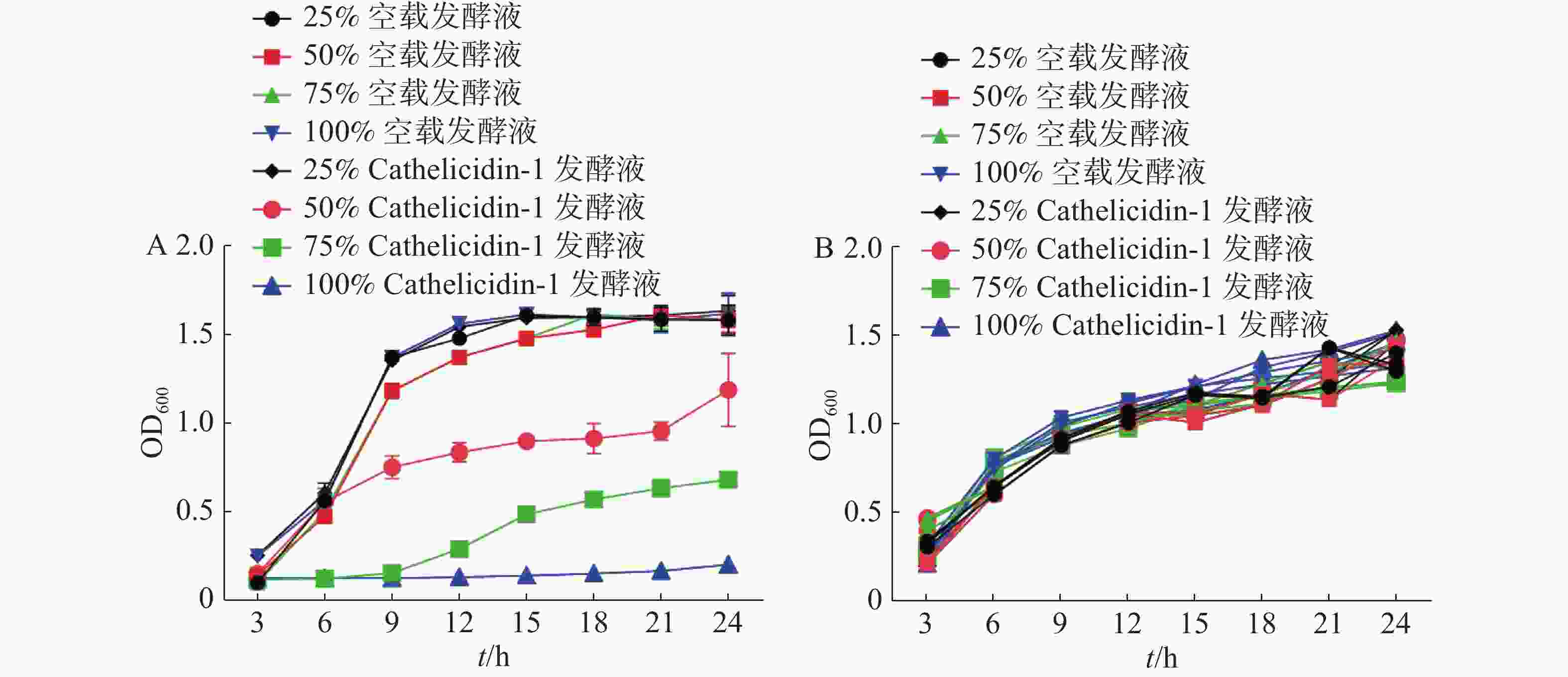
经SPSS 23对24 h时的OD值进行统计分析,结果表明添加50%、75%、100%抗菌肽 Cathelicidin-1发酵液与其他组存在显著差异(P<0.05),与表达空白载体的重组酵母发酵液相比,随着表达Cathelicidin-1的酵母发酵液所占体积分数的提高,大肠杆菌的生长速度逐渐减缓,表明发酵液对于大肠杆菌呈现浓度依赖性的抑菌活性,在发酵液达到100%的情况下,大肠杆菌无法生长,被完全抑制(图9-A)。与此不同,对于金黄色葡萄球菌,各个组别在24 h时的OD值都无显著差异,说明表达Cathelicidin-1的酵母发酵液对于金黄色葡萄球菌的生长并未产生显著抑制效果,甚至100%体积分数的发酵液也并未对金黄色葡萄球菌的生长造成任何显著影响(图9-B)。
-
抗菌肽是近年来受到普遍关注,有望替代抗生素的一类抗菌剂, 与大多数主要通过阻断有限的细胞内靶点发挥作用的常规抗生素不同,它们的杀菌活性通常来自于破坏细菌膜完整性的能力[10]。目前,已有多个模型对抗菌肽的抗菌机制进行解析,其中多数模型提出抗菌肽主要靶向破坏细胞膜[11]。膜靶向模型解释抗菌肽对细菌细胞的选择性依赖于带负电荷的细菌细胞和两性离子真核细胞之间的表面电荷差异[12]。阳离子抗菌肽被吸引到阴离子细菌细胞表面并与之结合,从而破坏生物膜完整性,最终导致细胞死亡[13-14]。由于抗菌肽是对细菌细胞膜造成物理破坏从而抑菌,细菌不能针对这种作用方式产生耐药性,因此,抗菌肽被认为是前景巨大的抗菌候选药物,有可能解决迅速增长的抗微生物药物耐药性危机[15]。
有研究表明,抗菌肽Cathelicidin-1具有良好抗菌活性,对多种细菌病原菌都具有较好的抑菌效果[8]。然而,目前获取Cathelicidin-1的方式仍局限于天然提取和化学合成,成本高昂,相比之下,通过基因工程表达Cathelicidin-1抗菌肽无疑是降低生产成本、提高产量的有效途径。
近年来,许多报道通过毕赤酵母表达蛋白系统表达蛋白,并且酵母表达系统也在逐年优化,本研究采用的pGAPZαA表达载体中的GAP类启动子为组成型的启动子,不同于诱导型启动子,无需添加有毒的诱导物即可高效诱导表达外源蛋白,且该载体中含有的α分泌信号肽编码序列可以与外源蛋白融合表达,引导外源蛋白一同分泌到胞外,并且α分泌信号肽在分泌过程中会发生自剪切,从而不对外源蛋白的最终结构产生影响。本研究采用上述经过优化的毕赤酵母表达系统,旨在获得高效表达且具有显著抗菌活性的抗菌肽Cathelicidin-1。测序对比结果证明,Cathelicidin-1基因已正确整合到毕赤酵母基因组中,而且,Tricine-SDS-PAGE分析表明,Cathelicidin-1抗菌肽以分泌方式表达于酵母发酵液中。进一步通过抑菌圈和抑菌曲线测定实验可知,含有外泌Cathelicidin-1抗菌肽的酵母发酵液对以浓度依赖的方式对大肠杆菌产生良好抑菌效果,只需少量即可显著抑制大肠杆菌的生长,在100%添加时完全抑制其生长。本研究构建的Cathelicidin-1抗菌肽酵母表达系统,以及获得的外源分泌表达Cathelicidin-1抗菌肽,为后续进一步研究Cathelicidin-1抗菌肽的抑菌机制及应用奠定了基础。
Eukaryotic expression of Cathelicidin-1 and validation of its antimicrobial activity in the fermentation broth
DOI: 10.15886/j.cnki.rdswxb.20230010
- Received Date: 2023-02-09
- Accepted Date: 2023-03-20
- Rev Recd Date: 2023-03-20
- Available Online: 2023-09-25
- Publish Date: 2023-09-25
-
Key words:
- antimicrobial peptides /
- eukaryotic expression /
- fermentation broth /
- bacteriostatic activity
Abstract: In order to obtain exogenously expressed antimicrobial peptide, cathelicidin-1 expression recombinant vector was constructed using molecular cloning technique, and the secreted cathelicidin-1 was expressed in Pichia pastoris. The antimicrobial activity of the fermentation broth containing Cathelicidin-1 was evaluated. The full-length gene encoding cathelicidin-1 was synthesized by total DNA synthesis and amplified by PCR. The full-length gene was linked to the eukaryotic expression vector pGAPZαA, and the recombinant plasmid pGAPZαA-Cathelicidin-1 was transformed into Escherichia coli DH5α for multiplication. The multiple plasmids were extracted, single digested, and transformed into the yeast Pichia pastoris GS115. The transformed yeast was cultured in the YPD culture medium, and the fermentation broth was collected after 72 hrs of culture and used to express the antimicrobial peptide Cathelicidin-1 in a secreted form by using Tricine-SDS-PAGE. The antimicrobial activities of the fermentation broth were evaluated by using inhibition zone of the antimicrobial peptide and the microbial growth curve. Measurements of inhibition zone and growth curve showed that the fermentation broth from the yeast expressing Cathelicidin-1 exhibited significant inhibitory activity against E. coli, but did not show any bacteriostatic effect on Staphylococcus aureus.
| Citation: | LI Feihang, WU Haoheng, LI Hong, LI Juanjuan, MA Xiang, TANG Yanqiong, LIU Zhu. Eukaryotic expression of Cathelicidin-1 and validation of its antimicrobial activity in the fermentation broth[J]. Journal of Tropical Biology, 2023, 14(5): 474-480. doi: 10.15886/j.cnki.rdswxb.20230010 |












 DownLoad:
DownLoad: