-
由于沿海养殖业发展、施肥量增加和土地利用的变化,地表水污染程度稳步上升[1],导致径流污染严重。湿地作为天然的环境屏障,能够降低陆地向海洋的径流污染排放。红树林生态系统是全球湿地的重要组成部分[2],由于其高效的营养循环系统而具有极高的生产力[3],能够净化和过滤由内陆向海洋的径流中的有机物质和营养盐[4]。1960年以来,不合理的开发活动使得红树林面积锐减[5]。由于其独特的地理环境和系统特点[6],近年来红树林的研究日益增加,在红树林的清退修复工作及可持续发展方面,先后实施了蓝碳战略和“蓝色港湾”、“南红北柳”等生态工程[7]。
氮素循环是整个生物地球循环的重要组成部分,对维持整个生物圈的生态平衡意义重大。氮循环过程主要有硝化过程、固氮过程、反硝化过程、硝酸盐铵化过程、厌氧氨氧化过程和氨化过程等重要步骤。其中反硝化和厌氧氨氧化过程被广泛认为是环境中活性氮去除的最主要途径[8],其中反硝化是全球氮循环的关键步骤,其贡献远远超出其他过程。反硝化是在低氧条件下的反硝化菌将硝酸盐或者亚硝酸盐转化为氮气或者氧化二氮的过程,可以降低活性氮,维护氮循环平衡[9]。厌氧氨氧化则指在厌氧条件下, 以亚硝酸盐作为电子受体, 将氨氮氧化成氮气的过程。不同种类的生态环境中,厌氧氨氧化在氮循环中的贡献比例有较大差异,但仍旧不可忽视[10]。反硝化和厌氧氨氧化作用能将固定态的氮素转化为气态氮归还大气圈,被广泛认为是海洋生态系统中活性氮去除的两个主要途径,在维持各个圈层的氮素平衡中极其重要[11] ,而微生物是物质循环的主要驱动者。随着越来越多针对红树林物质循环的研究,人们对红树林在全球生物化学循环中的作用越来越重视。氮素作为生物的必须元素,往往是湿地沉积物中的主要限制性养分,因此研究不同生态系统氮循环具有十分重要的意义。已有部分研究发现,反硝化和厌氧氨氧化受到温度、溶解氧(DO)、硝氮、pH、有机碳、总铁等许多因素的影响,存在明显的时空异质性[12-13]。为了研究红树林退塘还林过程对沉积物氮循环速率的影响,实验选取海南省文昌市丹场村红树林清退工作区域,探究红树林修复过程的不同生境对沉积物理化因子、反硝化及厌氧氨氧化速率的影响,旨在为红树林的生态修复和清退工作的效果及阶段评估提供科学支持。
-
文昌市红树林地处海南省东北部,地理坐标为110°30′~110°02′E,19°15′~20°09′N。属于热带海洋性季风气候,全年日照时间长,年均气温约24.1℃,年均降雨量约1 750 mm,雨季为5—10月,旱季11至翌年4月[14]。文昌市自2017年开始启动保护红树林工程,计划3内退塘还林还湿760 hm2。本研究在2021年3月(旱季)及8月(雨季)于文昌市丹场村(19.62°N,110.81°E)的原生红树林湿地(原生区)、红树林修复区(修复区)及退养鱼塘区域(鱼塘区)3个区域选取样点进行采集,原生红树林湿地未进行开垦养殖,优势树种为对叶榄李(Laguncularia racemosa),修复区为进行了人工种植的幼年红树区域,鱼塘区为已经退养的原养殖鱼塘(已经推翻围墙与外界红树林水体相连接)。
-
采样使用内径8 cm、长50 cm的透明亚克力管垂直采集10~25 cm深度的红树林沉积物,在每个样点进行3次随机采样,带回实验室后将平行样在厌氧培养箱中使用聚乙烯无菌密封袋进行混匀,混匀后将样品存放于4℃冰箱,等待进行速率测定和相关理化性质测定[15]。
-
沉积物的温度、盐度、pH等在现场用土壤YSI(COMBI 5000)采集数据。沉积物可溶性硝酸盐氮(NO3−-N)、氨氮(NH4+-N)的测定参照《中华人民共和国国家环境保护标准》(HJ634-2012)进行。沉积物TOC使用重铬酸钾外加热法进行测定[16]。实验吸光度使用 Perkin-Elmer Lambda-25 分光光度计进行测定。所有环境参数进行3次重复测定。
-
沉积物反硝化及厌氧氨氧化速率采用同位素示踪法结合泥浆培养实验测定[15],将沉积物与同盐度人工海水按照1∶7的质量比例混匀制成均质泥浆,通入氦气充分曝气20 min以上,使用无菌注射器将泥浆注入到Labco顶空进样瓶内,放入与原位温度相同的恒温培养箱内预培养24 h。选取其中1个小瓶测定硝酸根离子浓度,用以计算Fn(Fn = 100×15NO3−/14+15NO3−),其余所有小瓶加入0.1 mL浓度为12.5 mmol·L−1 的 15NO3−,加入后充分摇匀,起始样加入200 μL 质量分数为50%的ZnCl2,终止样继续培养8 h之后加入ZnCl2。反硝化与厌氧氨氧化速率通过培养过程产生的溶解性气体29N2和30N2来确定。溶解性气体29N2和30N2采用薄膜进样质谱仪(Membrane Inlet Mass Spectrometry,MIMS)测定。
-
使用IBM SPSS Statistics 25软件对环境因子与速率的相关性数据进行Person和Spearman分析,并使用Origin 2018以及Adobe Illustrator 2021进行实验结果的柱状图绘制,使用word插件对数据进行单因素方差分析以确定显著性关系。
-
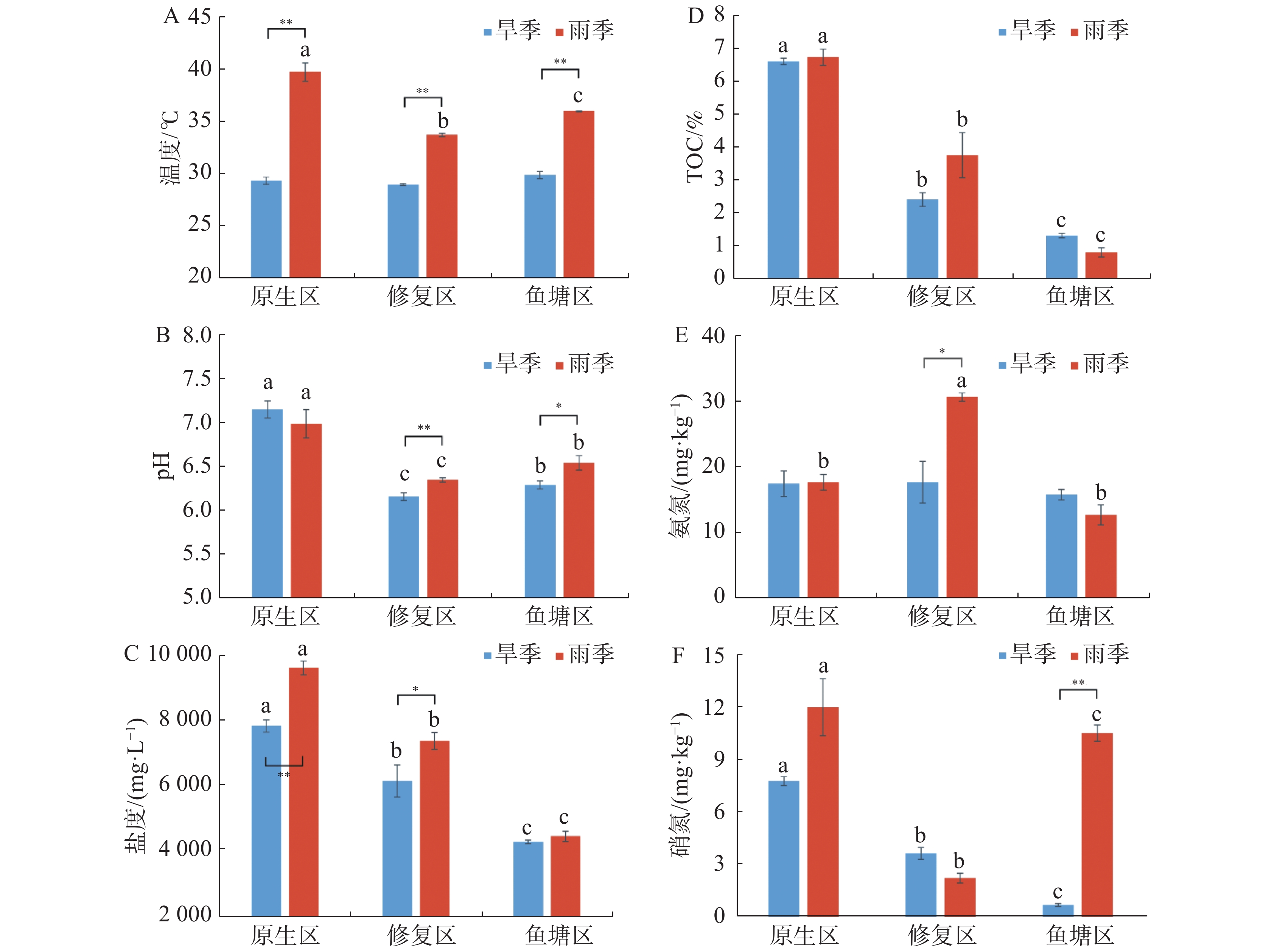
采样区域不同生境沉积物理化因子随着季节和生境的变化而发生改变,并存在时空分布差异(图1)。除TOC外,其余理化因子均受到季节的显著影响;所有理化因子都受到采样生境的显著影响。
沉积物温度范围为旱季29.03~29.93℃,均值29.46℃、雨季为33.80~39.84℃,均值36.57℃,不同生境沉积物温度存在极显著季节差异(P<0.01),雨季采样点之间也存在极显著差异(P<0.01)。
旱季沉积物pH范围为6.17~7.17,均值6.55;雨季pH为6.36~7.01,均值6.64,其中修复区pH存在极显著的季节差异(P<0.01),鱼塘区存在显著的季节差异(P<0.05)。沉积物pH呈现原生区极显著高于鱼塘区(P<0.01)和鱼塘区显著高于修复区的趋势(P<0.05)。
旱季沉积物盐度范围为4 338~7 902 mg·L−1,均值6 151 mg·L−1;雨季为4 509~9 691 mg·L−1,均值7 214 mg·L−1。总体呈原生区高于修复区和修复区高于鱼塘区的趋势,并且除旱季原生区和修复区差异显著外,其余差异均极显著。沉积物盐度在原生区表现出极显著的季节差异(P<0.01),修复区表现出显著的季节差异(P<0.05)。
旱季沉积物氨氮(NH4+-N)范围为15.92~17.59 mg·kg−1,均值17.11 mg·kg−1,雨季12.78~30.93 mg·kg−1,均值为20.51 mg·kg−1。旱季修复区氨氮显著地低于雨季(P<0.05),且雨季修复区显著极显著地高于其余2个区域(P<0.01)。
旱季沉积物硝氮(NO3−-N)范围为0.72~7.86 mg·kg−1,均值4.09 mg·kg−1,雨季2.27~12.11 mg·kg−1,均值8.33 mg·kg−1。整体两个季节沉积物硝氮具有显著的季节差异(P<0.05),原生区和修复区季节差异不显著,鱼塘区季节差异极显著(P<0.01)。且生境之间均具有极显著的差异(P<0.01)。
相同生境的沉积物TOC没有季节性差异,不同生境的沉积物TOC存在明显的季节性差异(P<0.05),原生区沉积物TOC均显著高于修复区和鱼塘区(P<0.05)。
-
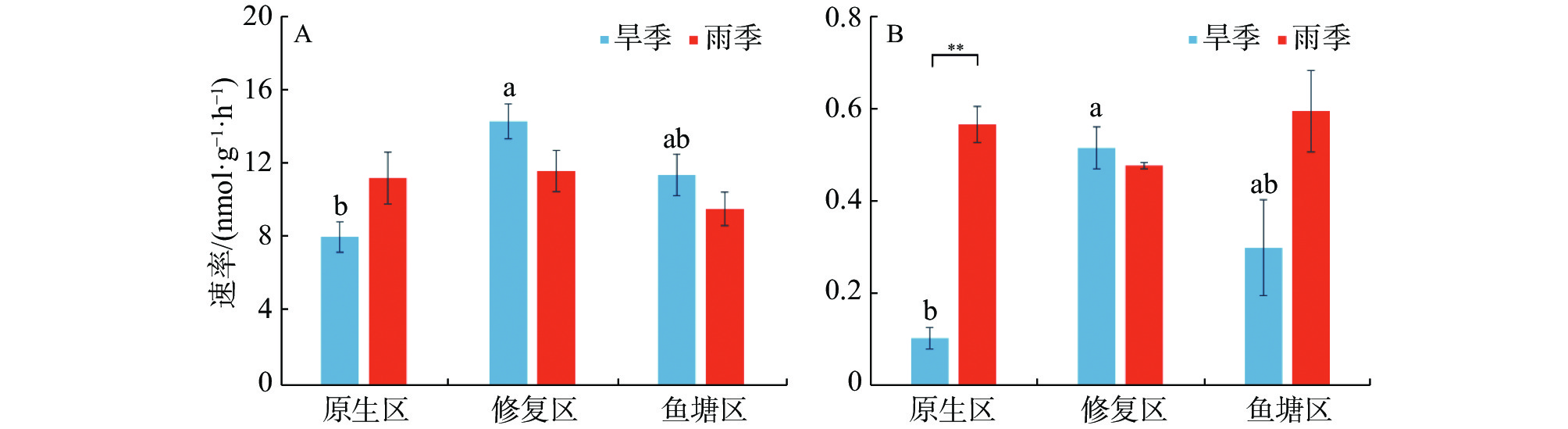
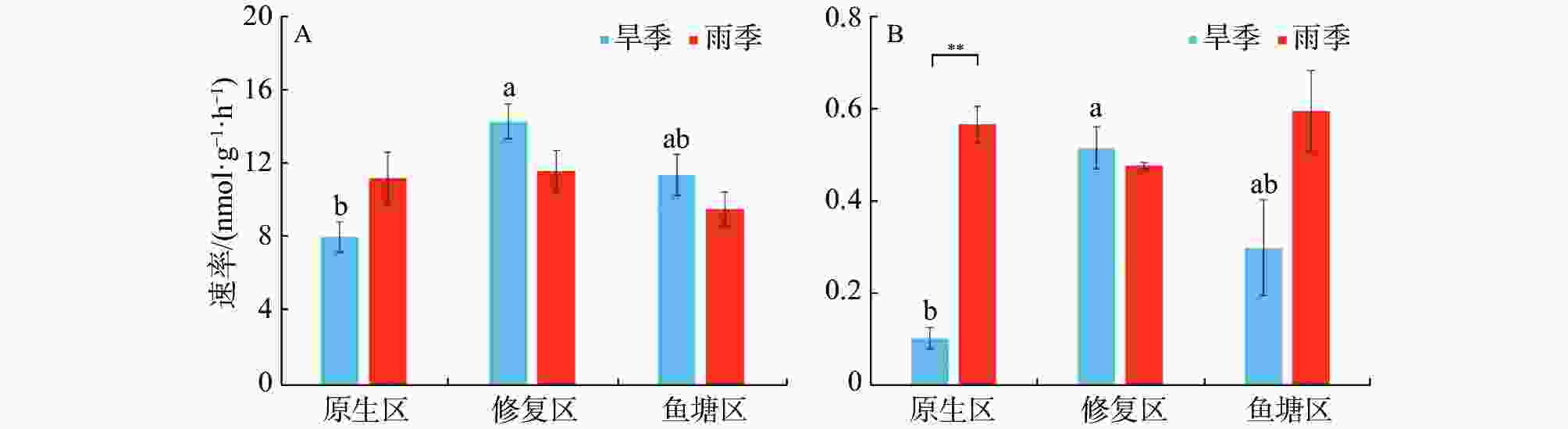
不同生境红树林沉积物的反硝化和厌氧氨氧化速率见图2。由图2可知,沉积物速率指标之间存在较大时空差异。旱季反硝化速率区间为8.08~14.39 nmol·g−1·h−1,其中修复区的反硝化速率最高(14.39 nmol·g−1·h−1),显著高于原生区(P<0.05);雨季反硝化速率则介于9.62~11.67 nmol·g−1·h−1之间,无显著生境差异。同生境下反硝化速率没有显著季节差异。
旱季厌氧氨氧化速率区间为0.10~0.52 nmol·g−1·h−1,修复区的反硝化速率最高(0.52 nmol·g−1·h−1),显著高于原生区(P<0.05)。雨季厌氧氨氧化速率介于0.48-0.60 nmol·g−1·h−1之间,不同生境之间没有显著差异。原生区厌氧氨氧化速率存在极显著的季节差异,雨季明显高于旱季(P<0.01)。
-
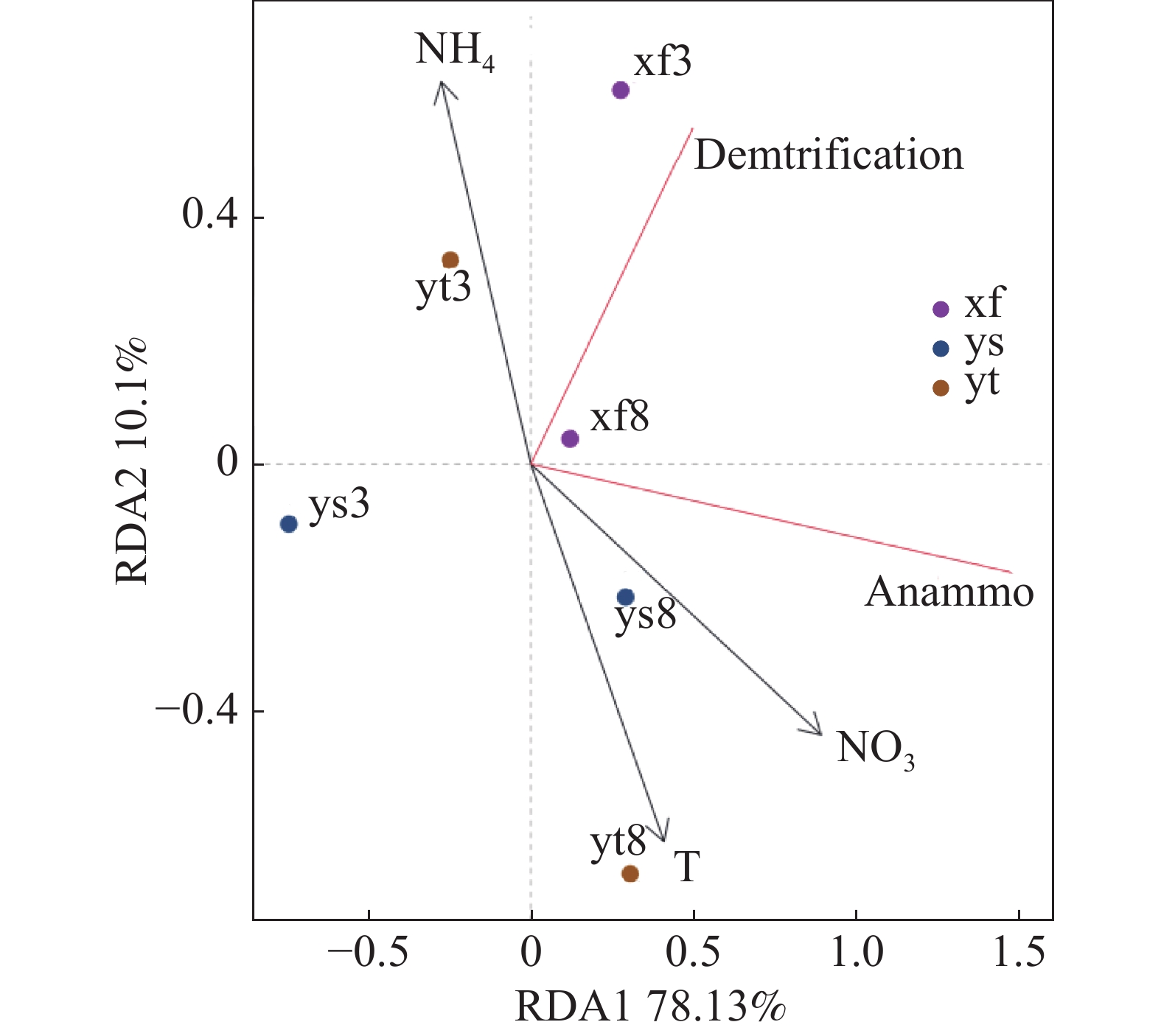
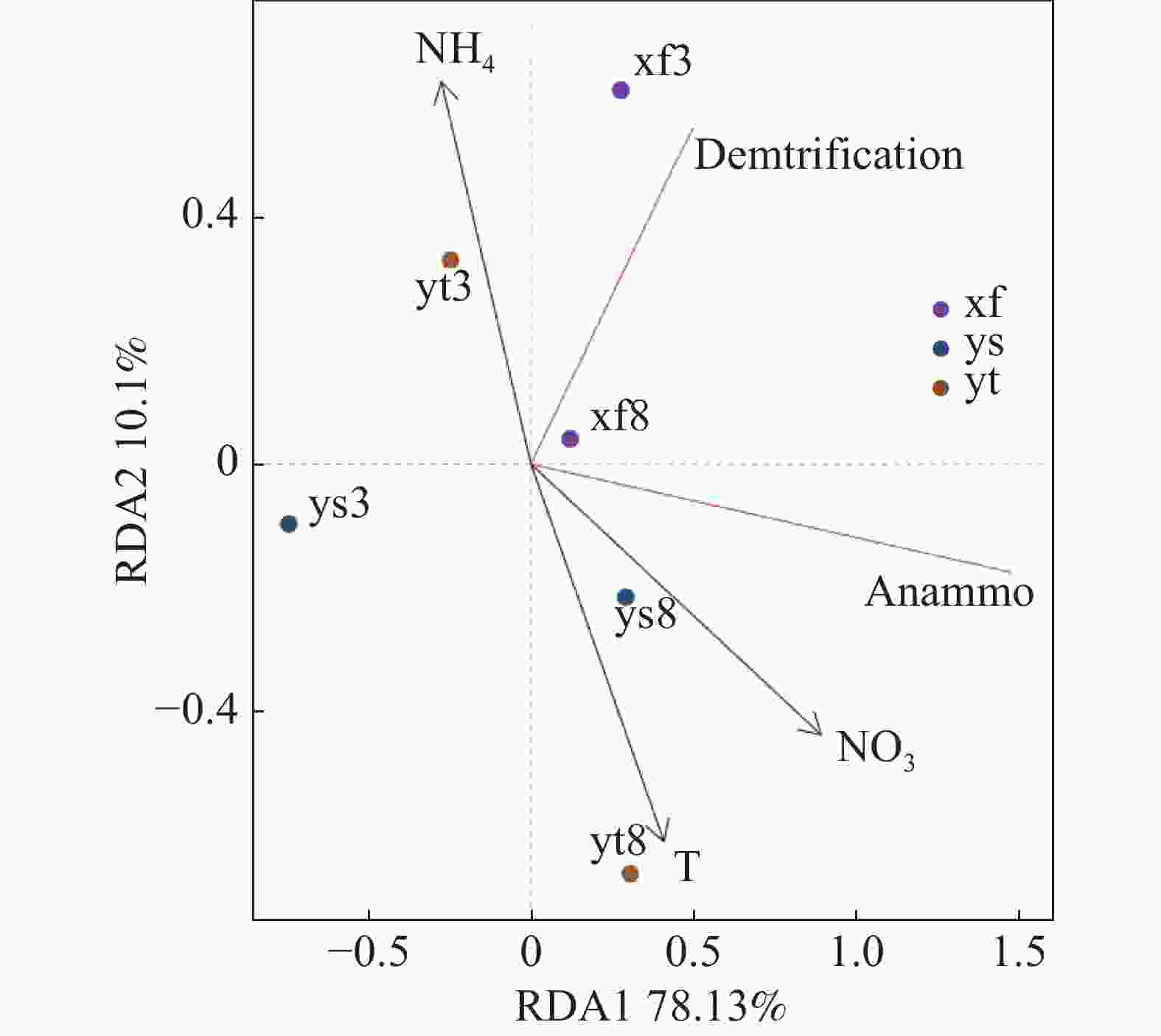
沉积物反硝化及厌氧氨氧化速率受到多项因子的综合影响,本研究结果(表1)表明,反硝化和厌氧氨氧化速率呈现高度正相关(雨季修复区除外);氨氮和硝氮对3种不同生境沉积物的反硝化和厌氧氨氧化速率均有显著影响。选取部分与脱氮速率相关度较高的理化因子与反硝化和厌氧氨氧化速率进行RDA分析,结果如图3所示,RDA1轴解释度为78.13%,RDA2轴解释度为10.10%。结果表明,温度和沉积物硝氮含量对反硝化和厌氧氨氧化速率产生了重要影响,沉积物氨氮含量的影响则较小。
采样点 反硝化速率 厌氧氨氧化速率 温度 pH 盐度 氨氮 硝氮 TOC 旱季 原生区 反硝化速率 0.754** −0.442 −0.591* −0.288 −0.927** −0.426 0.669* 厌氧氨氧化速率 0.754** 0.183 −0.126 0.105 −0.523 −0.835** 0.921** 修复区 反硝化速率 0.950** 0.822** 0.326 0.433 −0.664* 0.632* 0.158 厌氧氨氧化速率 0.950** 0.822** 0.117 0.383 −0.630* 0.685* 0.053 鱼塘区 反硝化速率 0.900** 0.791** 0.502 0.433 −0.100 −0.791** −0.158 厌氧氨氧化速率 0.900** 0.949** 0.427 0.433 0.133 −0.949** −0.474 雨季 原生区 反硝化速率 0.633* 0.210 −0.288 −0.567 −0.683* −0.211 −0.211 厌氧氨氧化速率 0.633* −0.252 0.085 −0.683* −0.267 0.211 0.211 修复区 反硝化速率 0.383 −0.049 0.111 0.363 0.000 −0.400 0.000 厌氧氨氧化速率 0.383 0.344 −0.466 0.218 0.042 −0.159 0.159 鱼塘区 反硝化速率 0.800** −0.652* −0.485 −0.317 0.711* 0.685* 0.580 厌氧氨氧化速率 0.800** −0.596* −0.661* −0.433 0.962** 0.896** 0.369 注:** 表示P < 0.01,相关性极显著;* 表示P< 0.05,相关性显著。 -
研究区域沉积物pH低于海水的pH,整体沉积物偏酸性是红树林的特色,也可能与附近养殖鱼塘废水排放污染有关,3个区域中原生区受影响最小,故pH最高。而鱼塘区由于质地呈砂纸,淤泥含量少,有机质含量也较少(如TOC),产生的还原性气体较修复区少,故酸性较弱。区域盐度差异是由于海陆距离差异导致,内陆径流多为淡水,在红树林入海过程存在盐度渐变过程。红树林沉积物出现温度、pH、盐度等理化因子的季节性差异与Li等[17]的研究相同。旱季修复区较高的氨氮可能是因为生物活动较旱季更活跃而导致,氨是鱼类和加壳类生物主要的代谢产物之一,导致沉积物氨氮含量升高[18]。其中,雨季鱼塘区硝氮的异常高含量可能是由于采样区域现有养殖鱼塘进行排水换水导致。
有研究表明,细颗粒沉积物对有机质的富集能力更强[19],笔者在采样时发现,鱼塘区域的沉积物大部分为粗糙颗粒,这可能是导致该区域TOC含量最低的原因。土壤反硝化过程主要是由放线菌门( Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)等微生物群调控,而厌氧氨氧化微生物主要归为浮霉菌门(Planctomycetes)[19],种类繁多的微生物参与调控脱氮并且发挥重要作用[20],而温度、水分、pH、溶氧、资源可用性、植被类型等均会对微生物种群多样性和丰度产生不同的效应[21],因此脱氮是许多不同的微生物与环境共同协作的结果。本研究发现修复区是反硝化和厌氧氨氧化速率最高的生境,可能是由于原生区过高的盐度抑制了该生境氮循环相关微生物,如厌氧氨氧化菌的活动导致该生境反硝化和厌氧氨氧化速率最低[17,22],王勇等[23]发现厌氧氨氧化的最适环境温度为(35±1)℃,而本研究厌氧氨氧化在原生区的极显著季节差异也可能是因为雨季的沉积物温度极显著地高于旱季,因为雨季沉积物温度更加接近最适值。且该处沉积物硝氮雨季高于旱季,反硝化潜力大[24],有更高的反硝化速率[25],提供了更多的厌氧氨氧化反应底物。温度和硝氮同时作用大幅提高了该生境的厌氧氨氧化速率。也可能是此处微生物群落结构受其余未测定环境因素和人类活动的影响所致[26],故不同生境氮循环速率的差异性不能局限于单一理化因子的影响。
两项速率出现的耦合效应与大多数研究相似,该关系的出现可能归结于反硝化在厌氧条件下提供了厌氧氨氧化的底物NO2−。有研究发现随温度升高,反硝化速率提高[27],本研究在旱季的修复区和鱼塘区,反硝化速率和温度呈现极显著的正相关关系,同时该区域的厌氧氨氧化速率同样受到温度的密切影响,与大多数结果相似。但可能由于采样生境整体温度较高,整体未能成为限制N循环速率的关键因素。反硝化作用的最佳pH为7~8,研究表明,高于或低于这个范围反硝化速率将会下降[28]。本实验除原生区外其余生境的pH均低于该范围,因此在旱季原生区和雨季鱼塘区反硝化速率出现了明显的下降。雨季原生区沉积物的盐度最高,该生境反硝化速率下降与盐度有关。有研究表明,盐度升高会导致反硝化速率的降低[20],本研究结果可能是该处盐度极显著高于其他点而抑制微生物活动所致(P < 0.01)。
硝氮和氨氮会显著地对反硝化速率造成影响[29-30]。一般来说,沉积物反硝化速率与离子交换态(IEF)硝氮和氨氮会存在较为明显的正相关性[31] ,而分析结果表明仅有雨季鱼塘区存在该正相关。本实验结果表明红树林沉积物中硝氮赋存形态较为特殊,在雨季原生区和修复区可能有较多碳酸结合态(CF)及氧化物态的(IMOF)硝氮和氨氮,导致所测沉积物硝氮和氨氮含量与速率并未呈现大多数研究的正相关关系,也可能是采样地点水质营养素较丰富,硝态氮未成为反硝化与厌氧氨氧化速率的限制因素,反而超过正相关阈值导致。张波等[32]研究发现太湖反硝化速率与硝氮存在负相关关系,认为反硝化速率越大,厌氧程度越高而导致硝氮含量较低,沉积物的高反硝化速率会降低环境硝氮负荷。吴耀国[33]研究结果表明,适当增加有机物可以提高反硝化速率,而本研究中雨季修复区较高的反硝化速率与沉积物TOC含量较高有一定相关性。
-
不同生境红树林区域理化因子存在复杂的时空变化特征,其中修复区各项理化因子相较于另外2个生境更低且季节性差异最为明显,原生区理化因子受季节影响较小且除沉积物氨氮以外的理化因子数值均为原生区最高。沉积物反硝化速率具有空间差异,厌氧氨氧化速率具有时空差异。反硝化及厌氧氨氧化速率受到不同采样生境、理化因子等的重要影响,反硝化和厌氧氨氧化速率均在修复区最高,原生区最低,总体季节差异不显著,反硝化和厌氧氨氧化速率之间有十分明显的耦合特性。所测理化因子中温度、pH、盐度、电导率、氨氮、硝氮、TOC均与红树林脱氮过程存在较为复杂的关系,其中温度和硝氮与反硝化和厌氧氨氧化过程关系较紧密,是该实验中红树林脱氮过程的关键影响因素。
Temporal and spatial variation and environmental response of denitrification and anaerobic ammonium oxidation rates in mangrove sediments
doi: 10.15886/j.cnki.rdswxb.2023.01.012
- Received Date: 2022-03-05
- Accepted Date: 2022-11-29
- Rev Recd Date: 2022-06-29
- Available Online: 2023-01-01
- Publish Date: 2023-01-25
-
Key words:
- denitrification /
- anammox /
- nitrogen cycle /
- turn back into mangrove forest /
- sediment
Abstract: The temporal and spatial distribution of denitrification and anaerobic ammonium oxidation (anammox) rates in mangrove sediments in different mangrove habitats (native mangrove area, restored mangrove area, and abandoned fish pond area) was analyzed by using isotope tracer technique (15N) to determine environmental factors affecting denitrification and anammox rates of the mangrove sediments. The results indicated that there were seasonal differences in physical and chemical factors of the mangrove sediments in different habitats, and that the denitrification rates of the mangrove sediments had spatial variation. The denitrification rate of the mangrove sediment was significantly higher in the restored mangrove area (14.39 nmol·g−1·h−1) than in the native mangrove area (8.08 nmol·g−1·h−1) in dry season (P < 0.05), but not significantly different from that in the abandoned fish pond area (11.48 nmol·g−1·h−1). There was no significant difference in denitrification rate among the habitats in rainy season since the denitrification rate of the mangrove sediment was 11.67 nmol·g−1·h−1 in the restored mangrove area, 11.29 nmol·g−1·h−1 in the native mangrove area and 9.62 nmol·g−1·h−1 in the abandoned fish pond area. There was no significant seasonal variation in denitrification rate among the habitats. The anammox rates of the mangrove sediments showed a temporal and spatial variation in the habitats. The anammox rates in dry season tended to showed a similar change to the denitrification rates in the sediments of different habitats in dry season, and the anammox rate in the restored mangrove area was the highest in dry season (0.52 nmol·g−1·h−1), which was significantly higher than that in the native mangrove area (0.10 nmol·g−1·h−1) (P < 0.05). No significant difference was observed in the anammox rate in all the habitats in rainy season. The anammox rate of the mangrove sediment in the native mangrove area had obvious seasonal variation, and it is higher in rainy season than in dry season (P < 0.01). Correlation analysis of various environmental factors with the denitrification rate and the anammox rate in the mangrove sediments showed difference in the correlations of sediment temperature, salinity, ammonia nitrogen and nitrate nitrogen with denitrification and anammox rates in different seasons. The sediment temperature, ammonia nitrogen and nitrate nitrogen in different habitats were significantly correlated with denitrification rate and anammox rate. Obvious synergy between denitrification rate and anammox rate was found in the mangrove areas.
| Citation: | LIN Yubin, QIN Yongqiang, MA Siyuan, ZENG Ruohan, CHEN Yumei, DIAO Xiaoping. Temporal and spatial variation and environmental response of denitrification and anaerobic ammonium oxidation rates in mangrove sediments[J]. Journal of Tropical Biology, 2023, 14(1): 129-135. doi: 10.15886/j.cnki.rdswxb.2023.01.012 |







 DownLoad:
DownLoad: