-
启动子(Promoter)为DNA分子上与RNA聚合酶结合形成转录起始复合物并起始mRNA合成所必需的保守序列。启动子有强、弱之分,其对转录水平的控制程度差异较大,按转录模式可将启动子分为组成型、组织特异型、诱导型等多种形式。强启动子对于基因工程的研究具有促进作用,为转化体系的建立、互作机制的研究等提供有效的工具。例如小麦条锈菌效应蛋白Pst14872靶标的鉴定及功能分析[1]中报道了利用大肠杆菌Tac启动子探究专性寄生真菌小麦条锈菌中Pst14872效应蛋白与靶标TaClpS1的互作机制;农杆菌及PEG介导向日葵核盘菌遗传转化体系的研究[2]中报道了利用大肠杆菌的Lac启动子驱动mgfp5基因的表达以探究向日葵核盘菌转化体系的建立;启动子克隆概述[3]中报道了丝状真菌启动子可以高效表达内源基因可能得益于其具有强大的启动子工具。因此,利用从真菌内分离的强启动子驱动基因的转录表达,有望为丝状真菌转化体系的建立、侵染机制的研究等提供新的可能。
橡胶树白粉菌是一类专性寄生真菌,目前尚不能离体培养[4-5],又因其寄主橡胶树的基因组过于庞大,因此橡胶树白粉菌遗传转化体系仍是目前研究中的一个难点问题。本实验室从橡胶树白粉菌基因组中鉴定得到了WY172[6]与WY195[7]启动子,但仅在外源寄主双子叶植物内验证过这两个启动子功能,为进一步探究WY172与WY195是否有广泛应用于橡胶树白粉菌转化体系建立的可能性,笔者所在的实验室通过原生质体转化法在与寄主相同的丝状真菌—暹罗炭疽菌内验证了这两个启动子功能[8]。笔者拟构建以启动子WY172、WY195驱动绿色荧光蛋白(GFP)表达的载体,对GFP基因在暹罗炭疽菌内的表达情况进行探究,同时对转化子在不同环境条件下启动子的活性进行验证,旨在为WY172、WY195启动子的应用提供更多的可能,同时也为橡胶树白粉菌转化体系的建立提供优良的启动子工具。
-
供试菌株为笔者所在实验室分离纯化获得并经鉴定的橡胶树暹罗炭疽菌(Colletotrichum siamense)HN08[9]。pJNARG质粒来自西北农林科技大学许金荣课题组,依据pFL2质粒改造而来[10]。
-
TB3培养基:酵母提取物1 g,酸水解酪蛋白1 g,蔗糖5 g,加ddH2O定容至1 L,121℃高温灭菌20 min,每200 mL加琼脂1.5 g制成固体培养基。CM培养基:酵母提取物6 g,酸水解酪蛋白1 g,蔗糖10 g,加ddH2O定容至1 L,121℃高温灭菌20 min,每200 mL加琼脂3 g制成固体培养基。马铃薯葡萄糖琼脂培养基 (PDA):马铃薯 200 g,葡萄糖 20 g,琼脂粉 15 g,加ddH2O定容至1 L, 121℃高温灭菌 20 min。 马铃薯葡萄糖液体培养基 (PDB):马铃薯 200 g,葡萄糖 20 g,加ddH2O定容至1 L,121℃高温灭菌 20 min。
-
蜗牛酶(Snailase)购自北京索莱宝(Solarbio)科技有限公司,溶壁酶(lysing enzyme)购自美国Sigma Aldrich公司。1×STC缓冲液:蔗糖20 g,50 mmol·L−1 Tris-HCl 0.785 g,50 mmol·L−1 CaCl2 0.555 g,加ddH2O定容至100 mL,121℃高温灭菌20 min。PTC缓冲液:称取3 g PEG 4000,溶解于1×STC缓冲液,定容至5mL,利用细菌过滤器(孔径0.45 μm)过滤除菌。酶解液配制:细胞壁溶壁酶0.2 g,完全溶解于0.7 mol·L−1的NaCl溶液,利用细菌过滤器(孔径0.45 μm)过滤除菌。
-
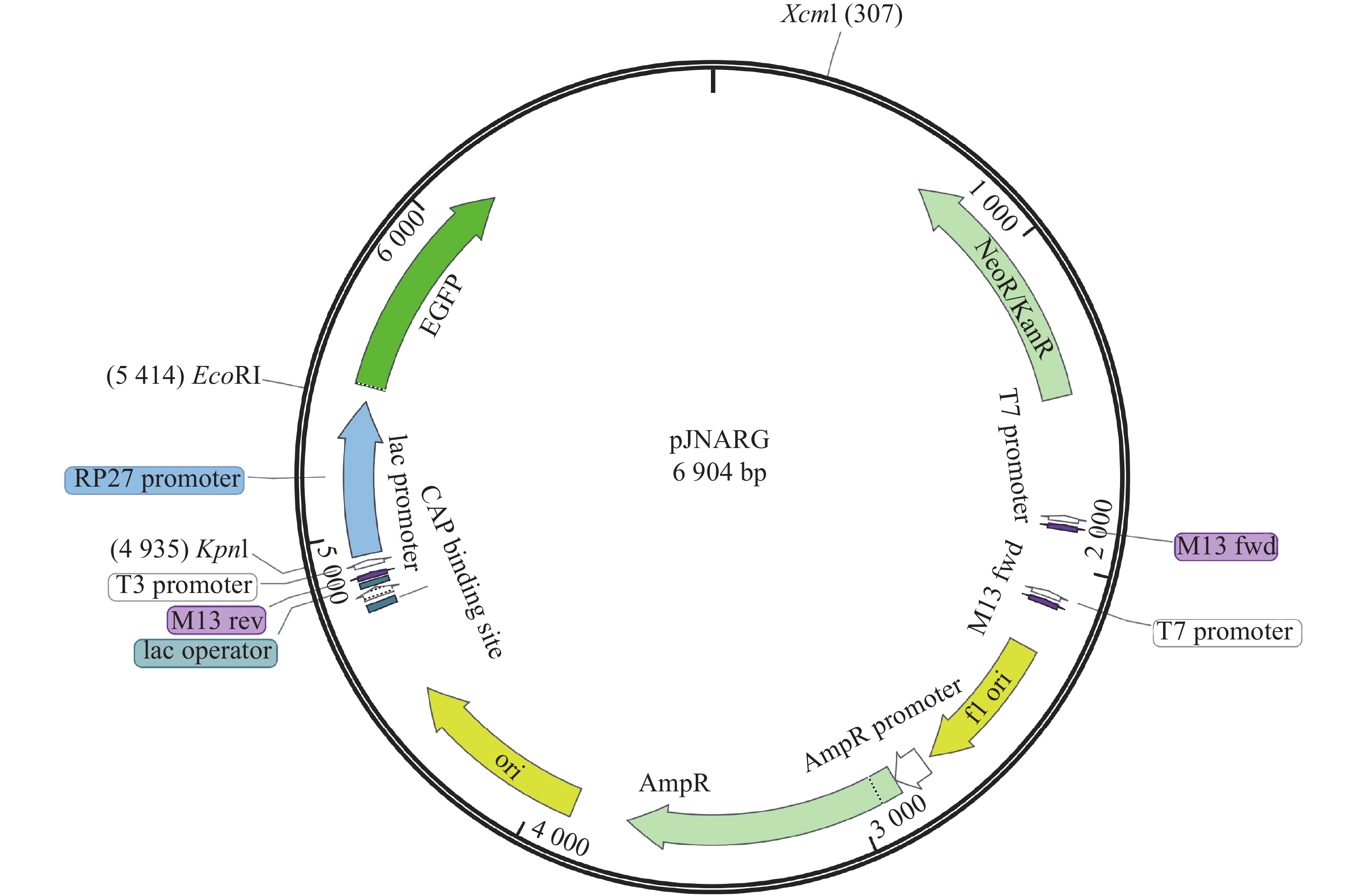
利用限制性内切酶KpnⅠ和EcoRⅠ对pJNARG载体进行双酶切,切除载体上的RP27启动子基因片段(图1),并使用DNA回收试剂盒(Magen,R6840-01)回收载体片段。提取橡胶树白粉菌基因组DNA,以WY172 F/R和WY195 F/R引物,从橡胶树白粉菌基因组中扩增出WY172(GenBank:MK049254.1)与WY195(GenBank:MK049253.1)启动子,连接pJNARG骨架片段,并转化DH5α感受态细胞,涂布于Amp+抗性的LB固体培养基上,在37℃的环境中培养过夜,挑取单菌落进行PCR验证并筛选出阳性克隆转化子用于后续实验研究。本研究所用的引物见表1。
LB液体培养基中,37℃摇床振荡过夜后并提取质粒进行PCR验证,验证正确的质粒送至华大生物公司测序。测序正确的菌株保存在甘油中并放置于−80℃保存。
编号 引物名称 引物序列(5′-3′) 限制性内切酶 1 pJNARG-WY172-F GGGAACAAAAGCTGGGTACCC
ATTTCATCCATAAGAAATTAAAKpnⅠ 2 pJNARG-WY172-R CCACGATTAAATCGAGCCATGAATT
CGATAAATATGCGATTTTTATGCAAEcoRⅠ 3 pJNARG-WY195-F GGGAACAAAAGCTGGGTACC
AACCAATAATTTTCACGAGGGKpnⅠ 4
5
6
7
8pJNARG-WY172-R
GFP-F
GFP-R
RT-GFP-F
RT-GFP-RCCACGATTAAATCGAGCCATGAATT
CTCTGCATGCTAGTGATTT
ATGGTGAGCAAGGGCGAGGA
TCACTTGTACAGCTCGTCCA
TCGTGACCACCCTGACCTA
GTCCTCGCGTGGTAGAAGEcoRⅠ -
将野生型的暹罗炭疽菌接种至CM固体培养基上,5 d后切取菌落边缘的菌块,在250 mL三角瓶中加入150 mL CM液体培养基,接入切除的菌块,28℃ 160 r·min−1培养48 h。收集菌丝,使用灭菌过滤纸过滤,用0.7 mol·L−1 NaCl溶液反复冲洗,用滤纸吸干水分,将菌丝转移至50 mL离心管中(避免手直接触碰菌丝)。称取菌丝质量,按照质量比为1 : 1的比例向菌丝中加入溶壁酶,置于摇床(28℃, 100 r·min−1)上,酶解时长约3.5 h。使用4层灭菌过滤纸过滤酶解液,将酶解后的菌丝溶液进行冰浴后用0.7 mol·L−1NaCl溶液洗涤,然后收集原生质体于50 mL离心管中,4℃ 4 600 r·min−1条件下离心15 min后弃上清。再用STC溶液将原生质体重悬,4℃ 4 600 r·min−1条件下离心15 min,重复1次。最后利用STC溶液将原生质体浓度调至1 ×108 个·mL−1,分装为每管200 μL,立即进行转化使用。
-
取60~100 μL 1.4中构建的质粒,与200 μL制备成功的原生质体混合,冰浴20~30 min,每200 μL原生质体中加入2 mL PTC溶液,在室温下静置30 min,最后加入TB3复苏液体培养基,每200 μL的原生质体加入3 mL的TB3培养基,轻轻颠倒混匀,室温下振荡培养2 h;随后将原生质体加入10 mL熔化并冷却到约50℃的TB3固体培养基上,并加入Amp+与G418抗性药剂,轻轻混匀后倒入培养皿中,静置至下层板凝固;最后向培养基倒入10 mL含Amp+和G418抗性的TB3培养基。28℃下培养2~3 d,待培养基上长出菌落后,将菌丝挑取到新的CM固体培养基上培养并进行后期验证。
-
分别取上述培养基中转化菌株与野生型的菌株的菌饼进行液体培养,26℃ 160 r·min−1条件下培养2~3 d,并提取转化子与野生型的DNA作为模板,利用GFP F/R引物进行PCR验证。PCR反应程序:94℃预变性5 min,94℃变性5 min ,56℃退火35 s,72℃延伸25 s,45个循环,72℃延伸10 min,4℃保存。PCR扩增产物经过1% 琼脂糖凝胶电泳检测。并将转化子以及野生型的菌丝、孢子制备成临时玻片,利用荧光显微镜(奥林巴斯BX53显微镜,配备DP80CCD)观察。
-
将暹罗炭疽菌转化子在CM液体培养基中28℃培养2~3 d。利用真菌RNA提取试剂盒(Omega,R6840-01)提取转化子的RNA,同时也提取野生型暹罗炭疽菌的RNA,利用反转录试剂盒(Vazyme,R333-01)进行反转录得到cDNA。以RP27启动子驱动GFP基因作为阳性对照,分别测定WY172与WY195驱动GFP基因的表达量。
-
挑取转化成功的暹罗炭疽菌丝放置于PDA培养基上培养4~6 d,再利用打孔器打取5 mm直径的暹罗炭疽菌的菌碟,在PDB培养基中28℃培养3 d,紧接着利用无菌过滤纸过滤,12 000 r·min−1离心,加入无菌水制备成分生孢子悬浮液,并利用血球计数板计数,制备成106 个·mL−1悬浮液备用。
将上述制备好的孢子悬浮液喷洒在经过无菌水冲洗过的离体橡胶树叶片上。根据暹罗炭疽菌在橡胶树叶片上的发育进程及侵染结构变化,分别选择在0 h (非接种状态)、12 h (附着胞形成侵染钉)、24 h (分生孢子另一端的芽管产生附着胞)、48 h (附着胞分化产生次级附着胞)、72 h (菌丝网状分布)这5个时间段,将叶片和菌丝利用锡箔纸密封[11],液氮冷冻,−580℃保存。
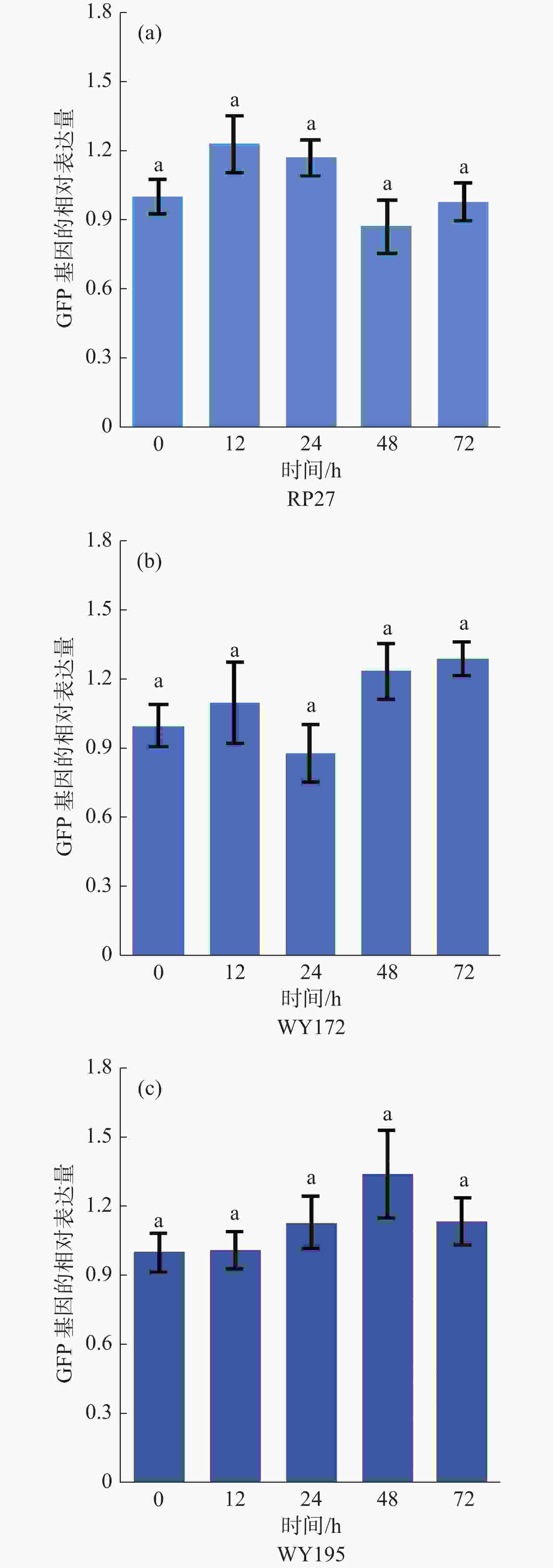
利用真菌RNA试剂盒分别提取这5个时间段的暹罗炭疽菌RNA,利用反转录试剂盒将RNA反转录为cDNA,以RP27、WY172、WY195分别在0 h驱动GPF基因的表达量作为参考值,探究不同启动子驱动下GFP基因表达含量在暹罗炭疽菌侵染不同时间的变化。
-
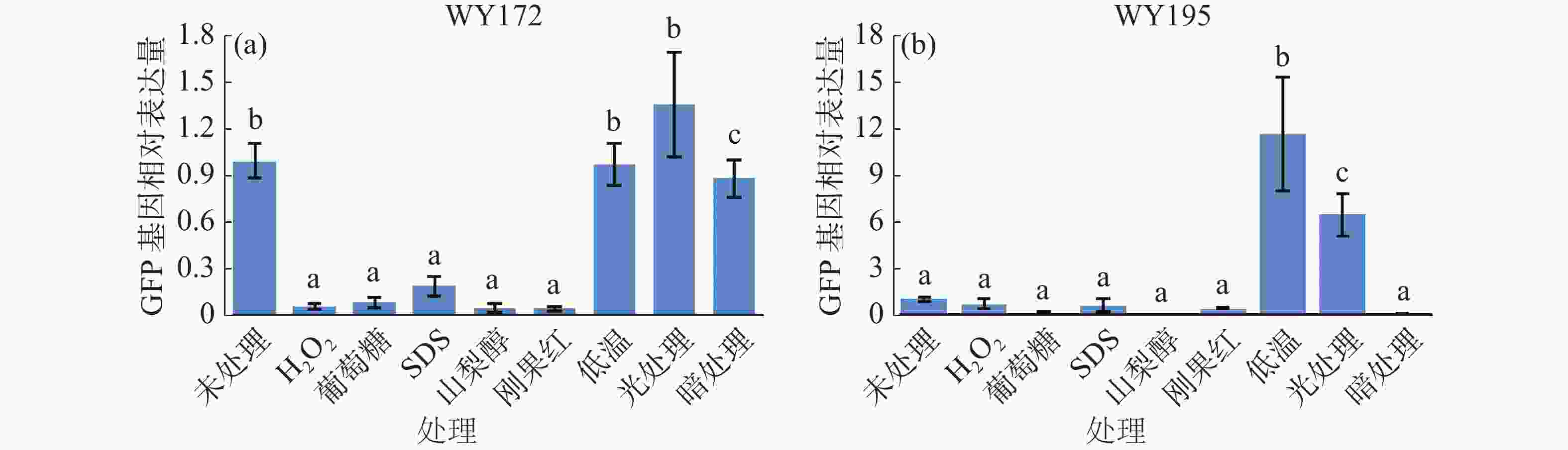
将暹罗炭疽菌转化子接种于普通CM固体培养基上,28℃培养7 d。将上述转化子分别接种于添加H2O2(20 mmol·L−1)、葡萄糖(1 mol·L−1)、0.01%的SDS、山梨醇(1 mol·L−1)、刚果红(200 μg·mL−1)的CM固体培养基以及普通CM固体培养基在28℃培养5 d,再取上述转化子接种于普通CM固体培养基,分别放置于长光照、黑暗和23℃低温条件下培养5 d。切取上述不同条件下CM平板中培养的转化菌株进行液体培养,28℃ 160 r·min−1培养2~3 d。利用真菌RNA提取试剂盒(Omega,R6840-01)提取菌丝RNA,用反转录试剂盒(Vazyme,R333-01)将RNA反转录为cDNA,测定不同生长条件下GFP基因的相对表达量。
-
对阳性菌株提取的质粒进行PCR验证,结果显示出与目的条带大小基本一致的条带(WY172大小为250 bp左右,WY195大小为250 bp左右),进一步送至华大生物公司测序以及NCBI序列对比,结果显示相似性为100%,表明表达载体构建成功。
-
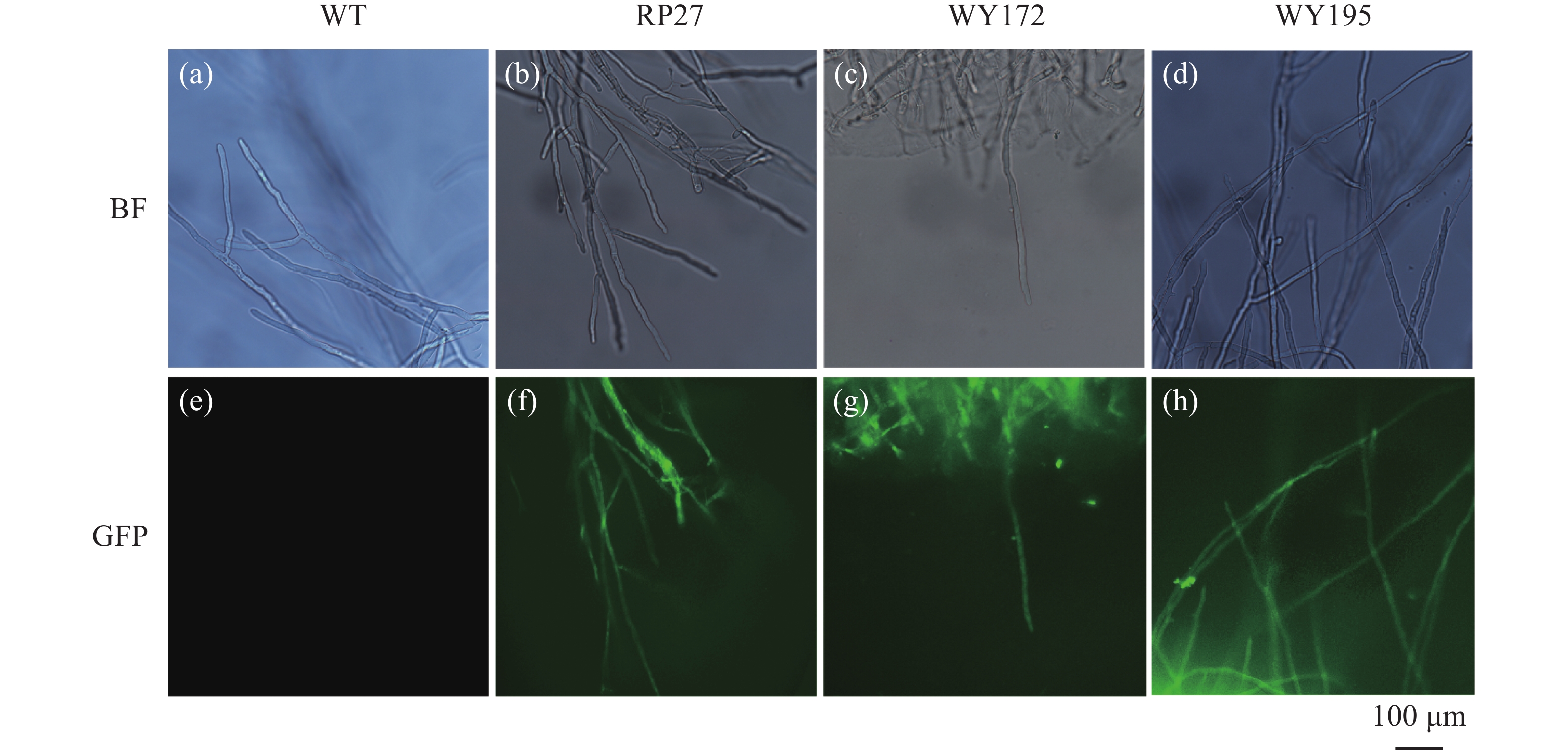
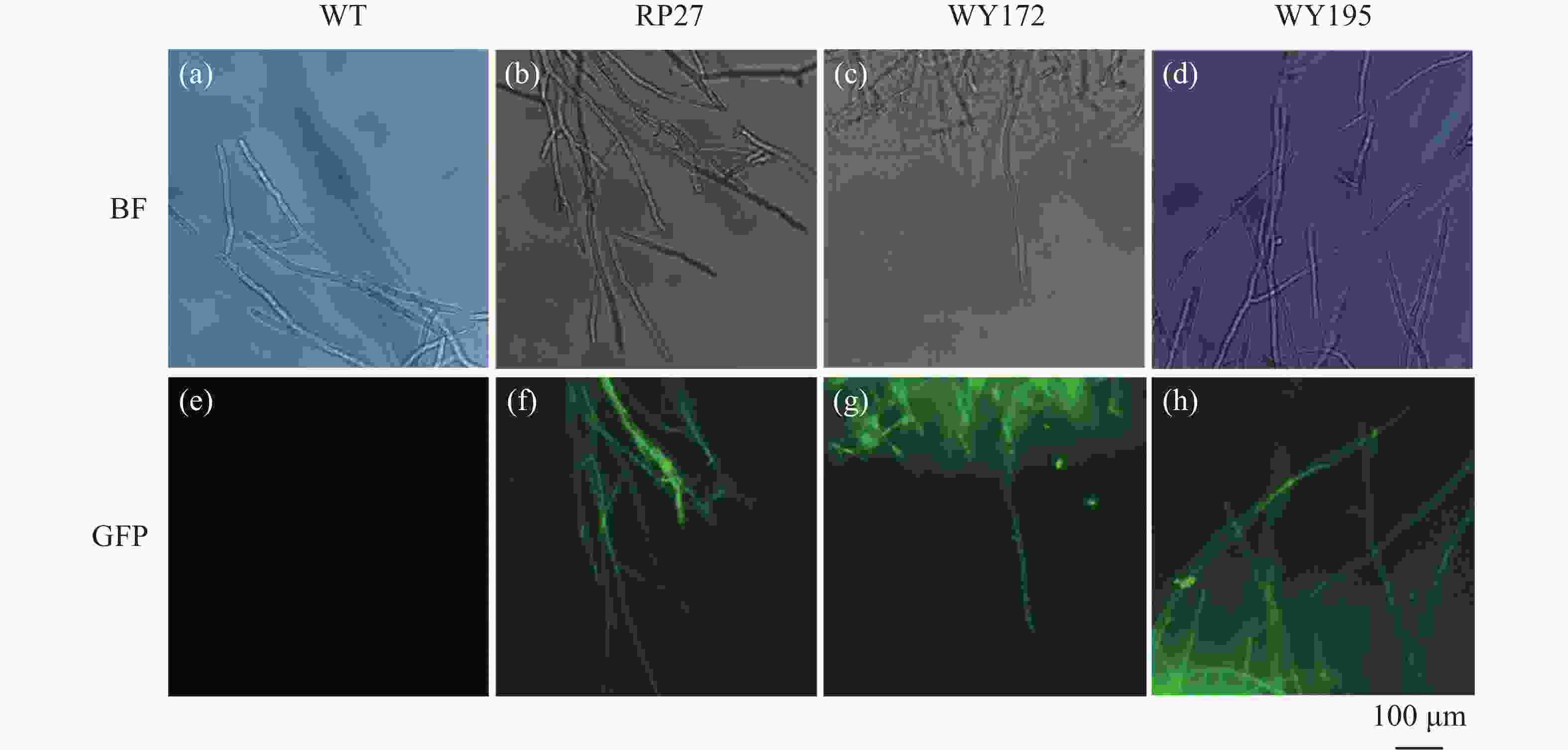
通过荧光显微镜观察,发现启动子WY172与WY195驱动GFP基因表达出了类似于RP27驱动GFP基因的荧光强度,而野生菌株未出现荧光表达(图2),表明构建的3种载体已成功转入,并且初步证明启动子WY172与WY195均可在暹罗炭疽菌内驱动GFP基因的表达。
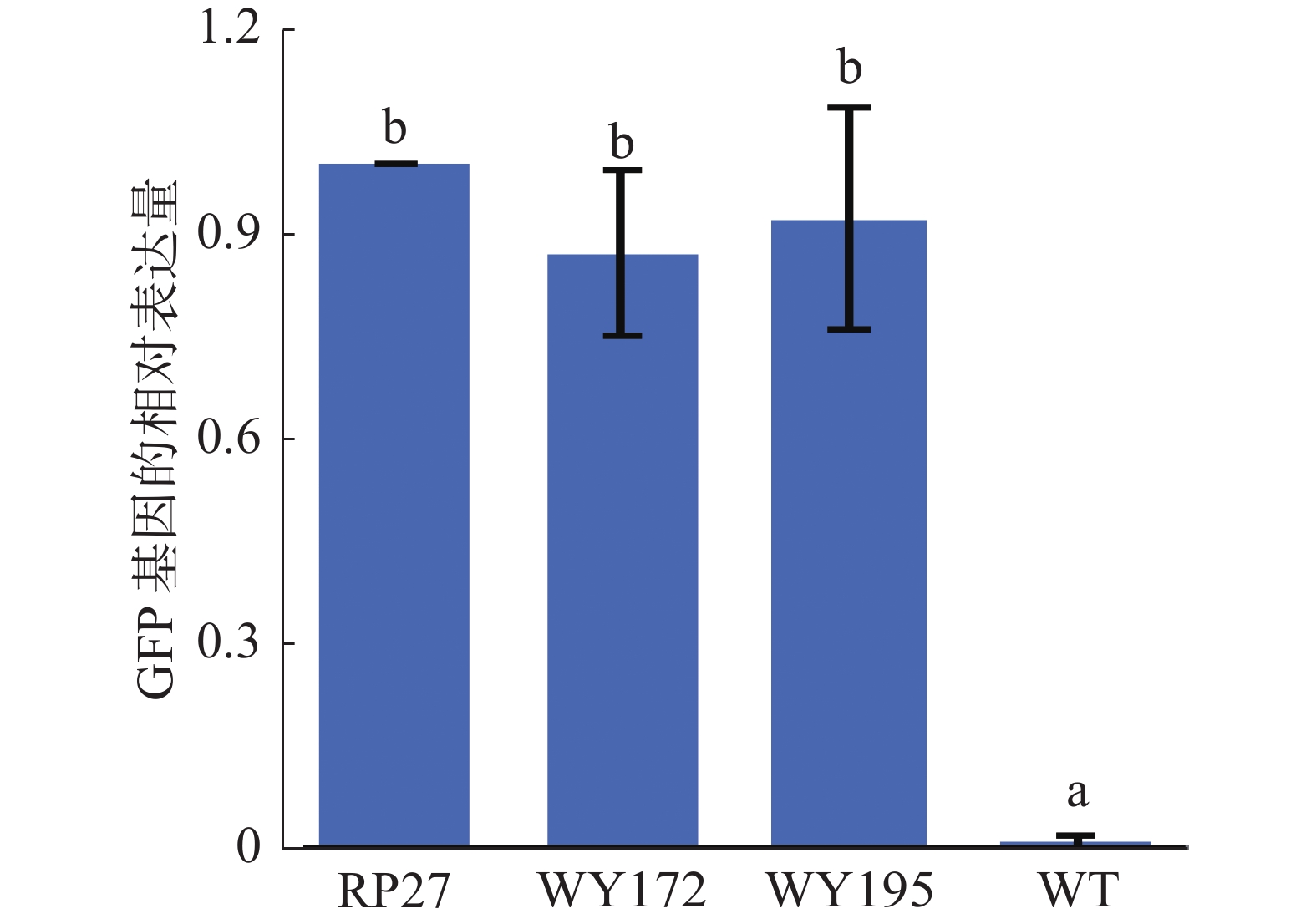
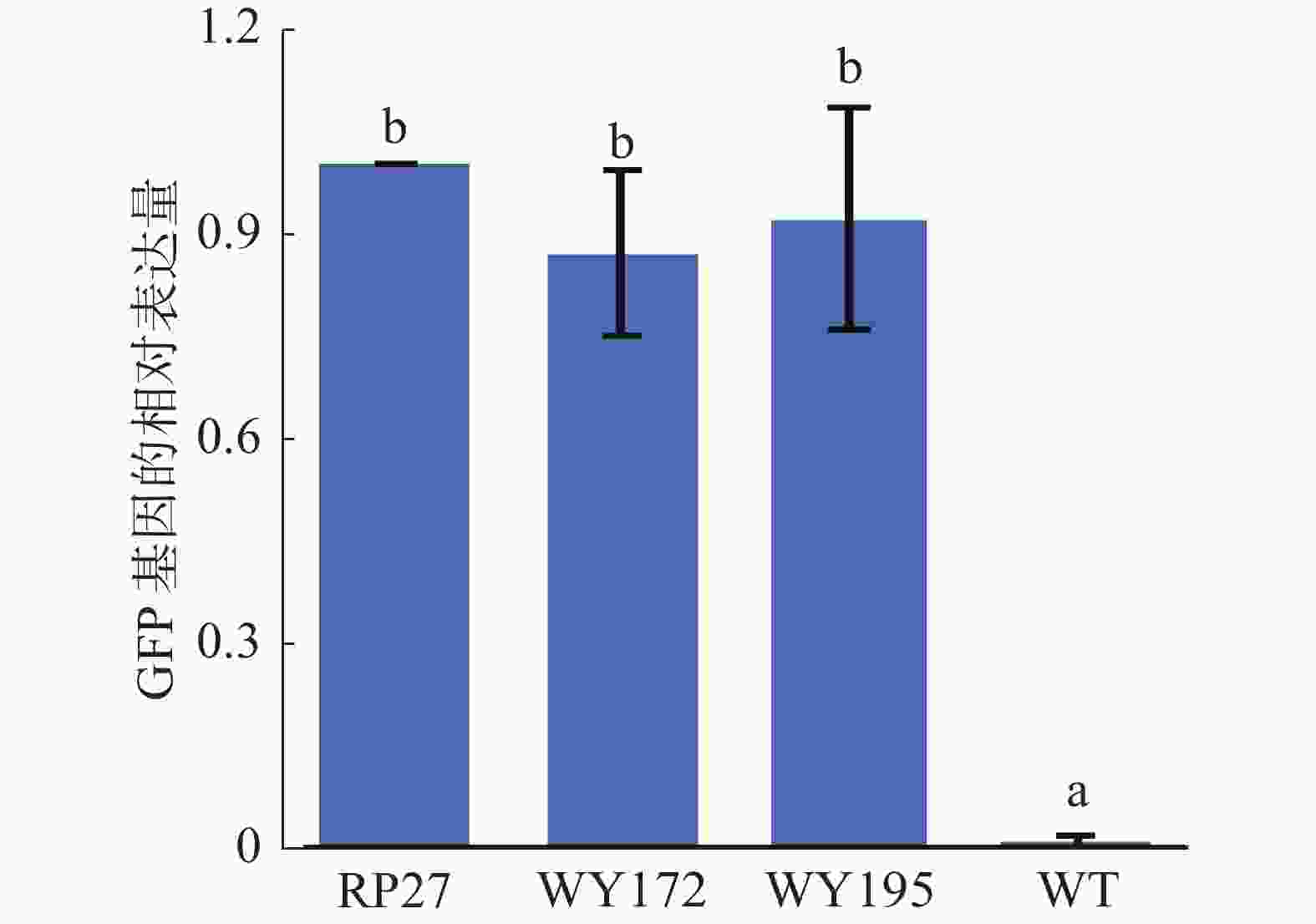
利用实时荧光定量PCR(RT-qPCR)测定3种启动子(WY172、WY195和RP27)驱动GFP基因的表达量是否存在差异,结果发现WY172和WY195驱动GFP表达的能力分别约为RP27的87%和91%,表现出与RP27类似的驱动GFP表达的能力,而野生型未检测到GFP基因的表达(图3),这再次证明WY172与WY195启动子均可在暹罗炭疽菌内驱动GFP基因的表达,说明WY172与WY195在暹罗炭疽菌内具有启动子活性。
-
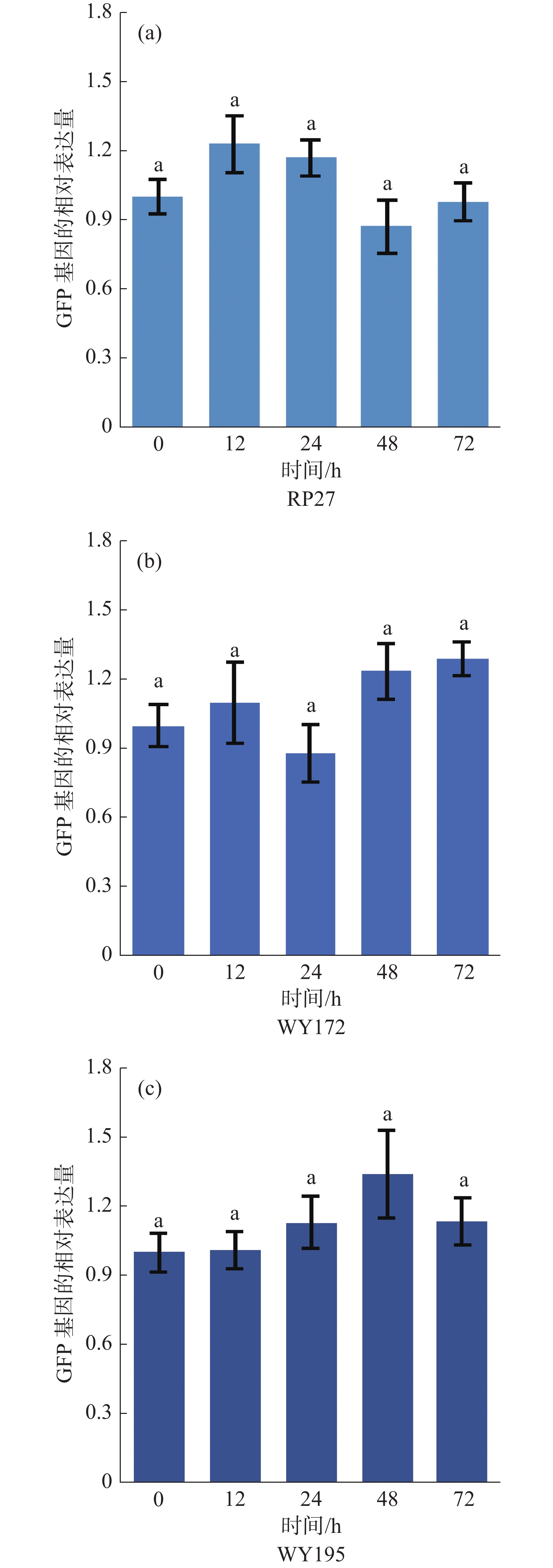
以3种转化子(WY172、WY195和RP27)分别在0 h的GFP基因的表达量作为对照, RT-qPCR结果显示启动子驱动GFP基因在12 、24 、48 、72 h这4个时间段表现出的效率相差较小(图4),如在RP27启动子驱动下,GFP基因的表达量在12、24、48、72 h分别为0 h的103%、127%、74%、131%,而在WY172启动子驱动下,GFP基因的表达量在12、24、48、72 h分别为0 h的110%、88%、127%、129%,在WY195启动子驱动下,GFP基因的表达量在12、24、48、72 h分别为0 h的101%、113%、134%、117%。这证明启动子在暹罗炭疽菌侵染寄主的不同阶段均可以驱动GFP基因的表达。
-
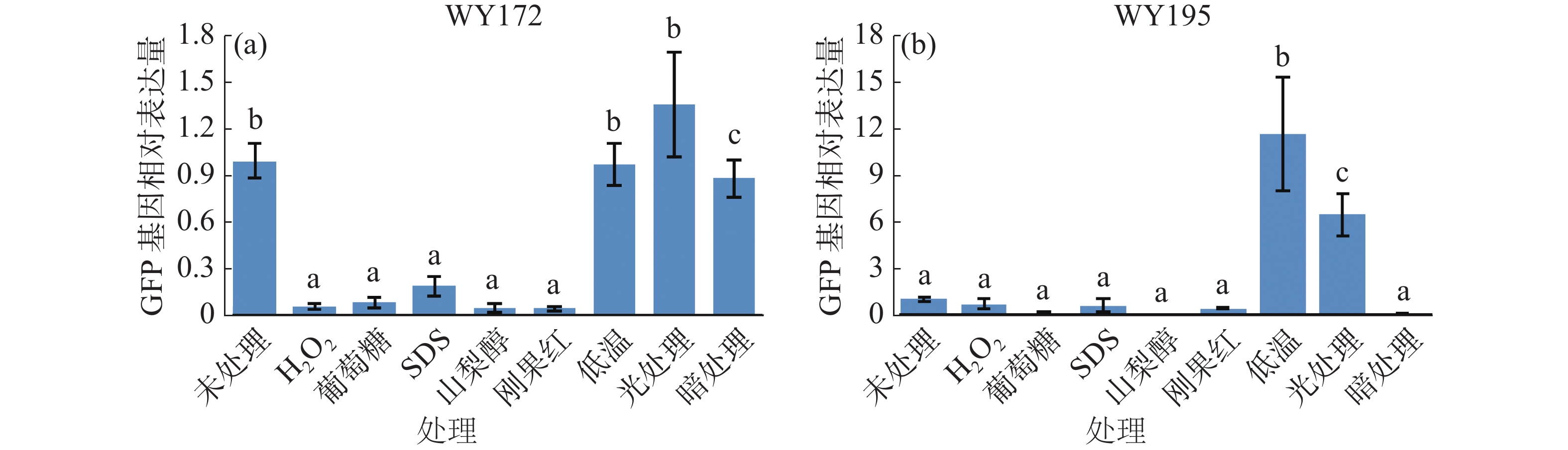
提取不同生长条件处理下的暹罗炭疽菌RNA,利用RT-qPCR测定发现WY172在24 h光处理条件下GFP表达量升高,WY195在低温培养与24 h光处理条件下GFP表达量升高(图5)。
-
启动子作为转录调控的中心一直是研究热点,优良启动子的发现是研究基因表达调控的基础,加深对启动子的研究对基因工程具有很大的帮助。丝状真菌具有丰富的启动子资源[12],目前应用较多的丝状真菌诱导型启动子含有里氏木霉的cbhl启动子[13]、曲霉属的glaA启动子[14]和构巢曲霉的alcA启动子[15]。本研究以实验室前期结果为基础,进一步加深对WY172与WY195启动子应用范围的探索,旨在扩大橡胶树白粉菌启动子应用,为橡胶树白粉菌转化体系建立和互作机制的研究提供可靠的启动子工具。
目前已经报道的启动子大多仅能在某种生物中发挥启动子作用,较少可以在多种不同的生物内均可高效驱动基因的表达,例如目前使用较为广泛的35S启动子仅适用于双子叶植物[16],单子叶植物经常使用水稻ACT1启动子[17]和玉米Ubil启动子[18]。在笔者所在的实验室的前期研究中,通过GUS蛋白染色实验和GUS酶活性检测发现,来源于橡胶树白粉菌的WY172与WY195启动子在双子叶植物和单子叶植物内均具有较强的启动子活性。这与来源于花椰菜花叶病毒的35S启动子[16]相类似,虽然来源于病毒却能在植物中稳定高效表达。但此前研究中对WY172、WY195在丝状真菌中是否具有启动子活性尚未进行研究。由于橡胶树白粉菌目前尚无有效转化体系且具有无法离体培养的特点,本研究选择丝状真菌中的暹罗炭疽菌作为研究对象,对WY172、WY195的启动子功能进行探究,研究结果表明WY172与WY195均具有可以驱动GFP表达的启动子功能。这证明WY172与WY195启动子不仅可以应用于植物,更可以在丝状真菌中发挥启动子功能。笔者推测,WY172、WY195启动子可能具有广泛的启动子功能,在多种生物体内均可以发挥启动子功能,这可能与其自身具有广泛的表达调控元件有关。笔者实验室也将在接下来的实验中对WY172、WY195启动子序列中的表达调控元件进行进一步的鉴定及功能分析,为基因工程提供更为有效的启动子工具。
本实验室前期的研究结果[7-8]表明,在植物体内WY172为IAA诱导型启动子,WY195为高温、干旱、盐诱导启动子,经分析发现,这可能与WY172、WY195启动子序列具有丰富的植物表达元件有关,其中,WY172不仅具有赤霉素响应、生长素响应等激素作用元件,此外还有低温响应、光响应元件等非生物因素的作用元件[7];WY195启动子也具有高等植物常见的创伤应答元件、厌氧诱导必须元件、干旱诱导元件、光应答元件等[8]。此外,除这些已报道的植物诱导条件外,还发现WY172与WY195启动子存在一些未经报道的植物启动子诱导元件。由于WY172、WY195启动子在植物中的诱导条件会导致真菌的生长发育受到限制,因此植物体内的启动子诱导条件并不适用于真菌体内,为了进一步探究WY172与WY195启动子在真菌内的表达调控方式,本研究将转化子置于不同的生长环境条件下,测定启动子驱动GFP基因表达量的变化,发现在光处理的条件下WY172驱动GFP基因的高效表达,在23℃低温培养和长光照处理下WY195启动子高效驱动GFP基因的表达。这些研究结果表明,WY172与WY195启动子在真菌内也属于诱导型启动子,但这些诱导条件与植物体内的条件完全不同。这可能与真菌的生长环境有关,同时也可能与WY172与WY195启动子丰富的诱导元件有关。由于目前专门针对丝状真菌启动子的研究数据库及分析工具较少,主要依靠其他真核生物的数据库进行预测,并通过实验对预测结果加以验证[12]。笔者实验室将在接下来的实验中对WY172与WY195启动子在真菌体内的诱导元件进行鉴定与分析,对以上2个启动子是否具有更多诱导条件的可能性进行进一步鉴定。
目前使用的真菌启动子多为组成型启动子,虽然组成型启动子不受外界影响,在菌株的不同生长阶段均可高效表达[19],但是组成型启动子的使用也存在局限性,例如当驱动异源基因表达时,会导致宿主菌株内产生大量异源蛋白,从而影响菌株正常生长甚至导致死亡。诱导型启动子在未受到特定的诱导信号刺激时,驱动目的基因的表达量往往很低,只有施加可以响应的诱导信号时,目的基因的转录水平才可以迅速提高,因此,使用诱导型启动子可以满足对目的基因的实时、定量表达的研究需求。但实验时还应根据合适的实验条件选择合适的诱导型启动子,并非每个诱导型启动子的诱导条件都能给所选的模型生物带来最佳条件。例如,诱导型启动子cbh1的天然诱导剂为纤维素,而真菌通过纤维素酶将纤维素降解,最后进入真菌体内对启动子cbh1进行直接调控,因此宿主菌株体内必须有编码纤维素酶的基因[20]。而WY172启动子与WY195启动子诱导条件为物理条件,不需要添加化学试剂来进行诱导,不仅避免化学试剂对寄主菌株正常生长产生影响,而且具有更广泛的使用范围。此外,WY172启动子与WY195启动子在植物和真菌内均属于诱导型启动子,在植物和真菌内均可运用。这不仅为功能基因的研究提供了更多的思路,也为启动子的应用提供了更多的可能。
Identification of WY172 and WY195 promoter activity in Colletotrichum siamense
DOI: 10.15886/j.cnki.rdswxb.20220074
- Received Date: 2022-09-20
- Accepted Date: 2022-12-11
- Rev Recd Date: 2022-12-08
- Available Online: 2023-09-25
- Publish Date: 2023-09-25
-
Key words:
- promoter /
- Colletotrichum siamense /
- protoplast transformation
Abstract: Our laboratory preliminarily identified WY172 and WY195 promoter sequences from the rubber tree powdery mildew fungus (Erysiphe quercicola), which could effectively drive GUS expression in both monocotyledonous rice and dicotyledonous tobacco. In order to investigate whether WY172 and WY195 have promoter activity in E. quercicola, the pJNARG vector was used as a backbone, linking WY172-GFP and WY195-GFP to construct recombinant expression vectors (WY172-GFP and WY195-GFP vectors). The recombinant vectors were introduced into Colletotrichum siamense infecting rubber trees by protoplast transformation method. Fluorescence microscopy showed that both WY172 and WY195 could stably drive the expression of GFP gene. And in different stages of C. siamense, WY172 and WY195 could play promoter roles to stably drive the expression of GFP. In addition, we changed the environmental conditions for the growth of anthracis and measured the GFP expression under different conditions. The results showed that the long light condition enhanced the activity of WY172 to drive GFP expression, and that the activity of WY195 was improved by the long light treatment and the low temperature treatment at 23°C. This indicates that WY172 and WY195 have stable promoter activities in C. siamense, and that their activities can be induced by changing light or temperature conditions.
| Citation: | DONG Linpeng, YIN Jinyao, ZHAO Wenyuan, LIN Chunhua, LIU Wenbo, MIAO Weiguo, LI Xiao. Identification of WY172 and WY195 promoter activity in Colletotrichum siamense[J]. Journal of Tropical Biology, 2023, 14(5): 506-513. doi: 10.15886/j.cnki.rdswxb.20220074 |






 DownLoad:
DownLoad: