-
滨豇豆[Vigna marina (Burm.) Merr.]和海刀豆[Canavalia rosea (Sw.) DC.]都是滨海盐生植物和非常有潜力的豆科优质牧草,可作为天然绿肥和生态改良植物。滨豇豆是豆科豇豆属多年生匍匐或攀援草本,具有较强的耐盐和抗旱特性,其根与根瘤菌共生,能够固氮,增加土壤肥力的同时改良盐碱环境[1];其种子淀粉含量丰富,可作为粮食、蔬菜,其叶片中含有的洋槐甙,有较好的利尿和抗炎作用[1],但滨豇豆种皮较薄,自然状态下发芽效果不佳。海刀豆是豆科刀豆属攀援藤本植物,蔓生于海边沙滩,是优良的滨海盐碱地改良材料[2],但由于皮质密、较厚造成其萌发困难。让种子快速、有效地萌发是实现作物大面积推广应用及产量提高的前提,由于不同植物种子的形态结构和生理特性不一样,打破种子休眠的措施也不一样,常用的处理方法有温水浸泡、低温刺激、不伤害胚胎的情况下通过种皮穿孔或机械磨薄或化学处理等[3]。目前还未见有关滨豇豆和海刀豆快速萌发处理的相关报道,为了大面积推广种植海刀豆和滨豇豆,笔者分别对海刀豆和滨豇豆进行了机械切割、热水(80 ℃)浸泡[4]、硫酸浸泡处理和液氮处理,旨在选出既能打破种子休眠又不影响种子正常萌发的方法,为海刀豆和滨豇豆的大面积推广奠定基础。
-
来源于中国热带农业科学院热带作物品种资源研究所牧草研究室种子库。
-
随机选出籽粒饱满、大小均匀、无虫眼、光泽度好的滨豇豆和海刀豆种子,每个处理各20 粒,3个重复,设立3组对照。
-
(1)机械切割处理:分别选取120粒籽粒饱满、光泽度良好的滨豇豆和海刀豆,分为6组(3个处理,3个对照)。用镊子将种子夹住,用灭菌后的手术刀片,沿着种子背脊轻轻划破种皮,处理过程中避免伤害种脐和胚,处理完成后进行萌发验。(2)热水(80 ℃)浸泡处理:分别选取240(每个处理20粒,3个处理,1个对照;每个处理3个重复,)粒籽饱满、大小均匀的滨豇豆和海刀豆。将水浴加热仪提前预热至80 ℃,分别浸泡滨豇豆和海刀豆5 、10 、15 min,待温度冷却至室温,进行萌发验。
-
(1)硫酸浸泡处理:取24个烧杯(包括各3个对照),分别放入20粒饱满干净的滨豇豆和海刀豆种子,用98%的浓硫酸分别处理10 、20 、30 min,期间用玻璃棒不断搅拌,使种子充分接触硫酸溶液,达到处理时间后,立即取出,用蒸馏水反复冲洗,直至硫酸完全去除,完成后进行萌发验。(2)液氮浸泡处理:分别将240粒大小一致、饱满的滨豇豆和海刀豆置于液氮中,分别浸泡5 、10 、15 min,期间不断添加液氮防止挥发,达到处理时间后捞出,待种子温度恢复至室温,进行萌发实验。
-
将对照组与处理组中的滨豇豆和海刀豆分别置于垫有两层滤纸、直径13 cm的培养皿中,放于温度为30 ℃/15 ℃(昼温/夜温),光照16 h的培养箱中进行萌发验,验期间随时补给种子萌发需要的水分。每个处理3个重复,每个重复20粒,并设对照组(没有进行任何处理)。第2天初次计数,第12天统计正常萌发幼苗数,计算其发芽率、发芽势与发芽指数[5-8]。
式中:Gt为第t天发芽数,Dt为发芽的天数。
-
实验中的所有数据均采用Excel软件进行基本整理及处理,用SPSS、GraphPad软件进行单因素显著性分析。
-
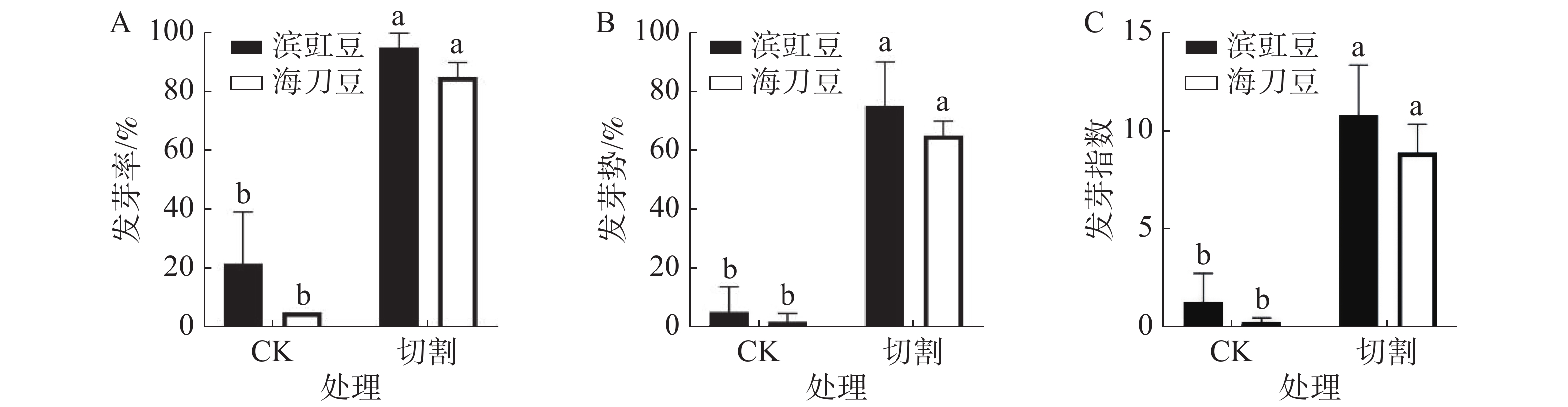
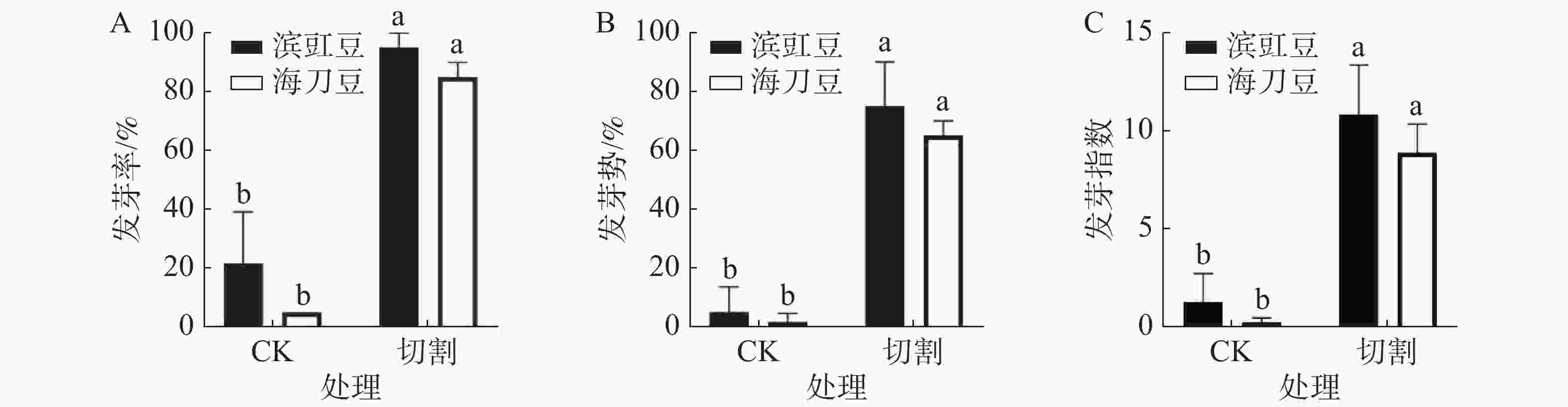
图1为切割处理对滨豇豆与海刀豆12 d后发芽情况的影响,结果表明,经过切割处理的发芽数明显多于未做切割处理的发芽数。未做切割的滨豇豆发芽率为22%,切割后的滨豇豆发芽率为95%。未做切割的海刀豆发芽率为5%,切割后的海刀豆发芽率为85%。显著性分析结果表明,切割对打破滨豇豆和海刀豆种子休眠有显著作用(图1-A)。说明机械切割一定程度上可以打破滨豇豆和海刀豆种子休眠,促进其种子发芽。
-
发芽势反应种子发芽的快慢和整齐度[9]。结果表明,切割处理对提高滨豇豆和海刀豆种子发芽势有显著作用(图1-B)。说明机械切割处理可以打破滨豇豆及海刀豆种子休眠,也可以促进其种子发芽的整齐度。
-
发芽指数是种子在整个发芽期综合活力的表现[9]。与对照相比,经过切割处理的滨豇豆和海刀豆发芽指数都有显著差异(图1-C),说明切割处理对提高滨豇豆和海刀豆种子发芽指数有着显著作用。
-
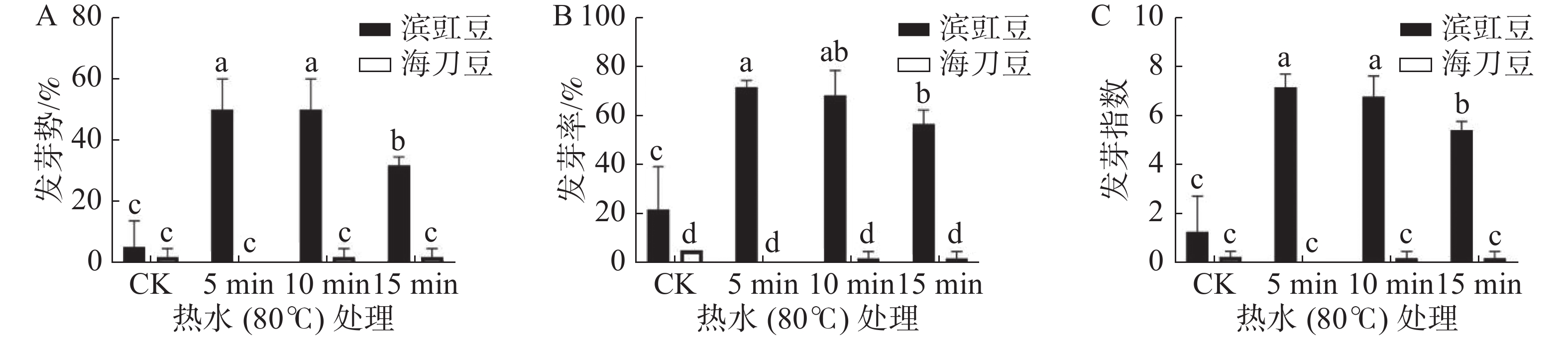
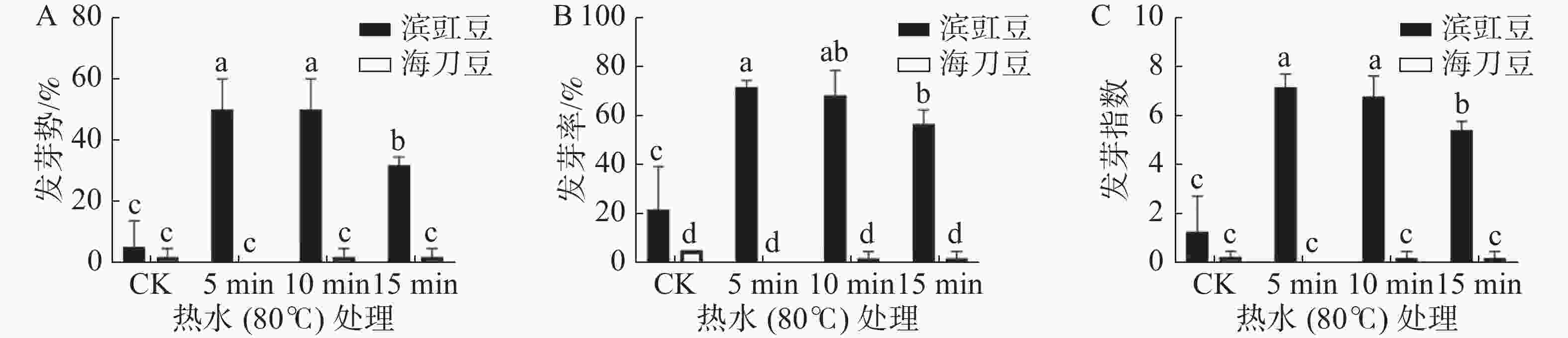
图2为热水(80 ℃)浸泡处理对滨豇豆与海刀豆12 d后发芽情况的影响,结果表明,经热水(80 ℃)处理的滨豇豆发芽数明显多于未做处理的发芽数,而海刀豆则基本没有变化。未处理的滨豇豆发芽率为22%,热水(80 ℃)处理5 、10 、15 min后的滨豇豆发芽率分别为71%、68%、56%。未做处理的海刀豆发芽率为5%,处理后的海刀豆发芽率分别为0%、2%、2%(图2-A)。结果表明,热水(80 ℃)处理对打破滨豇豆种子休眠,促进其种子发芽有显著作用,而对海刀豆种子的发芽率则无显著效果。就热水(80 ℃)浸泡处理滨豇豆时间而言,随着处理时间的加长,对其种子发芽率影响的显著性逐渐降低,说明热水浸泡时间5 min对滨豇豆种子发芽率最佳,10 min次之,15 min效果欠佳。
-
发芽势反应种子发芽的快慢和整齐度[9]。发芽势显著性分析结果(图2-B)表明,与对照相比,热水(80 ℃)浸泡处理对滨豇豆发芽势影响有显著差异,处理时长5 min和10 min存在显著差异,处理时长15 min时差异降低。经热水(80 ℃)处理的海刀豆种子发芽势与对照相比没有显著差异,说明热水(80 ℃)处理不能影响海刀豆种子的发芽势。
-
发芽指数是种子在整个发芽期综合活力的表现[9]。发芽指数显著性分析结果(图2-C)表明,经热水(80 ℃)处理的滨豇豆种子发芽指数与对照相比存在显著差异,说明热水(80 ℃)处理可以提高滨豇豆种子的发芽指数,对滨豇豆种子发芽有促进作用。其中,处理时长5 min和10 min差异显著,15 min次之。与对照相比,热水(80 ℃)处理对海刀豆种子发芽指数的影响没有显著差异,表示热水(80 ℃)处理对海刀豆种子的发芽指数没有显著影响。
-
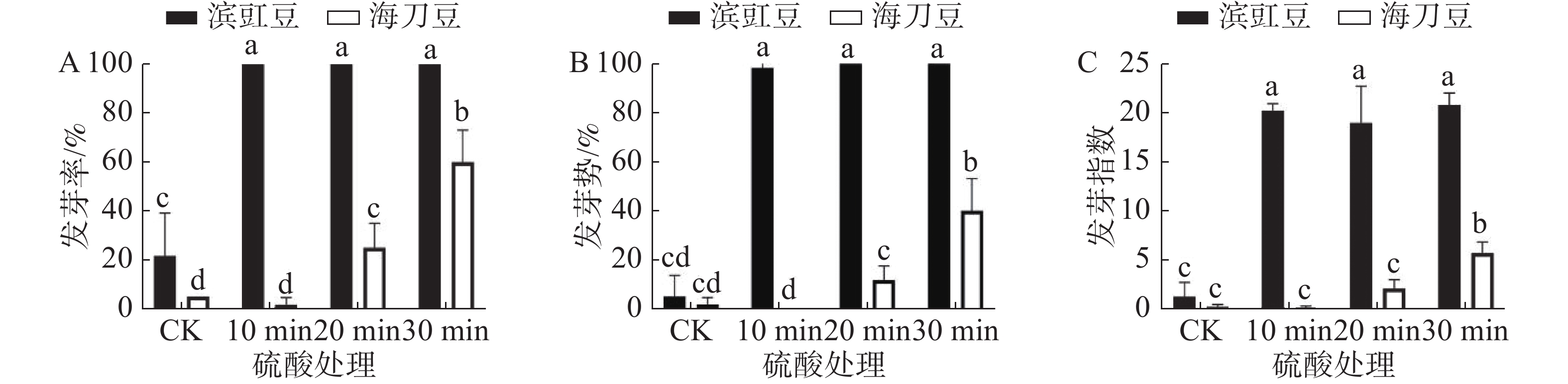
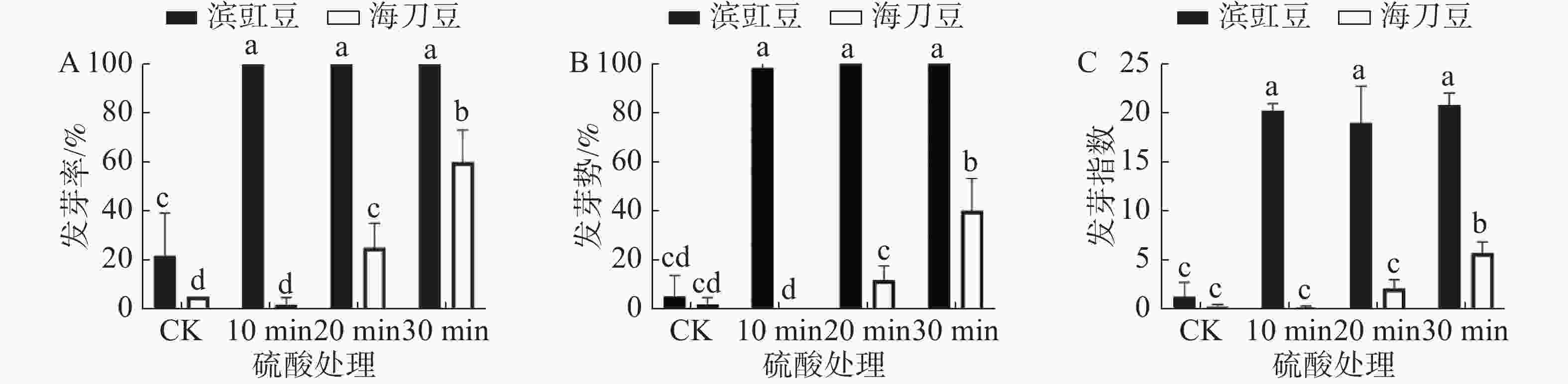
图3为硫酸处理对滨豇豆与海刀豆12 d后发芽情况的影响,可以看出经硫酸处理的滨豇豆发芽数明显多于未做处理的发芽数。而海刀豆10 min处理则基本没有变化,20 min及30 min处理则明显发芽数增加。未处理的滨豇豆发芽率为22%,经硫酸处理的滨豇豆发芽率皆为100%。未做处理的海刀豆发芽率为5%,处理后的海刀豆发芽率分别为2%,25%和60%(图3-A)。通过硫酸处理对种子的发芽率影响显著性分析显示,与对照相比,硫酸处理对滨豇豆种子发芽率的影响表现的极为显著,对海刀豆种子的发芽率影响也存在显著差异(图3-A)。本实验结果表明,硫酸处理能打破滨豇豆和海刀豆种子休眠,促进其发芽。硫酸处理30 min对海刀豆种子发芽率的提高效果最为明显。
-
发芽势反应种子发芽的快慢和整齐度[9]。发芽势显著性分析结果(图3-B)表明,与对照相比,硫酸处理对滨豇豆种子的发芽势影响存在显著差异,说明硫酸处理可以提高滨豇豆种子的发芽势。硫酸处理对海刀豆发芽势的影响,处理时长10 min和20 min时没有明显差异,30 min时存在显著差异,说明硫酸处理30 min可以提高海刀豆种子的发芽势,其他实验时长则无明显效果。
-
发芽指数是种子在整个发芽期综合活力的表现[9]。根据发芽指数显著性分析结果(图3-C)表明,与对照相比,硫酸处理对滨豇豆种子发芽指数的影响存在显著差异,说明硫酸处理可以提高海刀豆种子的发芽指数,促进其发芽。同样硫酸处理对海刀豆种子发芽指数的影响也存在显著差异,与对照相比,处理时长10 min和20 min时没有明显差异,30 min时差异显著,结果与发芽率与发芽势数据吻合,说明硫酸处理30 min可以提高海刀豆种子的发芽指数,促进其发芽,其他实验时长则无明显效果。
-
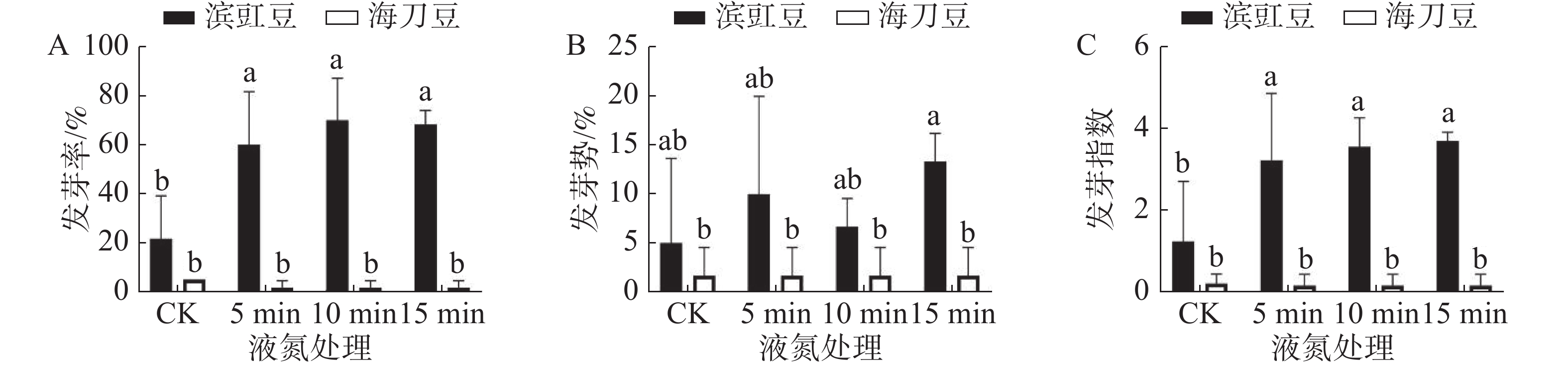
图4为液氮浸泡处理对滨豇豆与海刀豆12 d后发芽情况的影响,可以看出经液氮浸泡处理的滨豇豆发芽数明显多于未做处理的发芽数,海刀豆则基本没有变化。未处理的滨豇豆发芽率为22%,液氮处理5、10 、15 min后的滨豇豆发芽率分别为60%、70%、68%(图4-A)。未做处理的海刀豆发芽率为5%,处理后的海刀豆发芽率皆为2%(图4-A)。结果说明,液氮浸泡处理能有效的打破滨豇豆种子休眠,促进其种子发芽。
-
发芽势反应种子发芽的快慢和整齐度[9]。液氮浸泡处理对滨豇豆种子发芽势的影响显著性分析表明,与对照相比,液氮浸泡处理对提高滨豇豆种子的发芽势没有明显影响。同样,液氮浸泡处理对海刀豆种子发芽势的影响没有显著差异,说明液氮处理对海刀豆种子的发芽势影响不大(图4-B)。
-
发芽指数是种子在整个发芽期综合活力的表现[9]。液氮浸泡处理对滨豇豆与海刀豆发芽指数影响的显著性分析结果(图4-C)表明,经液氮处理的滨豇豆种子发芽指数与对照存在显著差异,说明液氮处理可以提高滨豇豆种子的发芽指数,对滨豇豆种子发芽有促进作用。相反,与对照相比,液氮浸泡处理对海刀豆种子的发芽指数没有显著差异,说明液氮处理对提高海刀豆种子的发芽指数没有影响。
-
研究表明,机械损伤种皮是处理硬实种子最直接有效的方法[10-22],而热水浸泡破除种子休眠被认为是一种经济、简单、高效的方法。热水浸种可软化种皮,改善种子的透气性,从而解除由种皮造成的休眠,促进种子萌发,但不同种子破除硬实的适宜温度不同,浸种时间与种子大小、种皮厚薄及水温有一定的关系[23]。本研究结果表明,切割对打破滨豇豆和海刀豆种子休眠,促进其发芽都具有显著的效果;热水(80 ℃)处理对打破滨豇豆种子休眠,促进其种子发芽都有显著效果。其中,热水(80 ℃)浸泡5 min为最佳处理时长。而对于海刀豆种子,热水(80 ℃)浸泡处理对其种子的发芽率、发芽势及发芽指数均无明显提高。
化学处理方法中浓硫酸是打破种子硬实最常用的一种试剂。由于浓硫酸的强酸性能够腐蚀种皮,使种壳变薄并消除珠孔等部位的堵塞物,增大种皮透性[24-27]。浓硫酸处理在破除种子硬实上效果显著,例如用它处理山野豌豆、敖汉苜蓿 (Medicage sativa cv. Aohan)、菜豆、两型豆(Amphicarpaea edgeworthii Benth.)等种子,能使发芽率分别提高到99.33%、99%、98%和99.3% ,但不同种子对不同硫酸浓度和处理时间的反应不同[27]。本研究通过对滨豇豆和海刀豆进行硫酸浸泡处理,发现硫酸浸泡处理对打破滨豇豆种子休眠,促进其种子发芽有极显著效果。对于海刀豆,随着硫酸处理时间的加长,其种子的发芽率有明显的提高,其中处理时长30 min最为显著,是否处理时间与发芽率呈现正相关,还需要进一步研究,以确定硫酸处理促进海刀豆发芽率的最佳时间。
低温处理能增进种子内部的新陈代谢,从而促进种子的萌发。本研究结果表明,液氮处理对打破滨豇豆种子休眠有显著作用,其中液氮处理15 min对滨豇豆种子的发芽率、发芽势及发芽指数影响最明显,说明低温处理可以打破滨豇豆种子休眠,促进其发芽,处理时长15min最佳。而对海刀豆种子的发芽率、发芽势及发芽指数的影响则无显著差异,说明低温处理不能打破海刀豆的种子休眠。
机械切割、热水(80 ℃)浸泡、硫酸浸泡及液氮处理对打破滨豇豆种子休眠,促进其种子发芽都有显著效果,其中热水(80 ℃)浸泡处理因易操作、成本低可作为首选。种皮的厚度对种子萌发影响较大,海刀豆因种皮较厚,所以热水(80 ℃)浸泡和液氮处理效果不佳,硫酸处理和机械切割处理对提高海刀豆的发芽率有着显著作用。然而,硫酸属于危险类化学品,农户不易获得且成本高,并不是最理想的方法。机械切割效果较好,但存在费时费力的问题,用机器进行切割会大大提高效率,目前市场缺乏此类机器。因此,在时间和设备条件允许的情况下,可以将多种方法进行组合应用,对打破种子的休眠、提高种子发芽率与发芽整齐度效果更佳。解除滨豇豆和海刀豆种子休眠,提高其种子繁殖系数,从而获得大量优质植株,对提高其经济和生态价值有着重要作用。
Comparison of different seed scarification methods for breaking dormancy of seeds of Vigna marina and Canavalia rosea
doi: 10.15886/j.cnki.rdswxb.2022.03.011
- Received Date: 2021-08-08
- Accepted Date: 2022-04-28
- Rev Recd Date: 2022-03-18
- Available Online: 2022-05-05
- Publish Date: 2022-05-23
-
Key words:
- Vigna marina (Burm.) Merr. /
- Canavalia rosea (Sw.) DC. /
- seed dormancy /
- mechanical cutting /
- low temperature treatment /
- seed germination
Abstract: Beachpea (Vigna marina (Burm.) Merr.) and bay bean (Canavalia rosea (Sw.) DC.) are high quality forage legumes and ecological improvement plants in coastal saline-alkali land. It is of great significance to improve their propagation. Seed dormancy is a suspension in viable seeds. The morphological structure and physiological characteristics of the seeds of different plants are various, so seed scarification methods for breaking seed dormancy are also different. Seeds of beachpea and bay bean were treated by mechanical scarification (cutting), chemical scarification (with liquid nitrogen and sulfuric acid) and hot water scarification (with hot water at 80 °C), respectively to break their dormancy. The results showed that mechanical cutting, dipping in hot water (80 °C), and soaking in sulfuric acid and in liquid nitrogen had significant effects on breaking the dormancy of and promoting germination of the beachpea seeds. Compared with the other three treatments, soaking in hot water (80 °C) had the lowest cost and is easy to operate, and could be used as the main seed scarification method for pretreatment to break the dormancy of the beachpea seeds. For bay bean, seed coat is thick and hard to break the dormancy of the seeds. Soaking in sulfuric acid and mechanical cutting could effectively scarify seed coat and significantly improve germination rate of the bay bean seeds. Compared with the chemical scarification with sulfuric acid, mechanical cutting was lower in cost and easy to operate, and hence could be used as the main seed scarification method for breaking the dormancy of the bay bean seeds.
| Citation: | LI Xia, YANG Wei, YANG Hubiao, LI Xinyong, HUAN Hengfu, DOGN Rongshu, WANG Zhiyong, LIU Yiming. Comparison of different seed scarification methods for breaking dormancy of seeds of Vigna marina and Canavalia rosea[J]. Journal of Tropical Biology, 2022, 13(3): 281-286. doi: 10.15886/j.cnki.rdswxb.2022.03.011 |







 DownLoad:
DownLoad: