-
白木香(Aquilaria sinensis)为瑞香科(Thymelaeceae)沉香属(Aquilaria Lam)植物,是我国特有的产沉香植物和药用沉香的法定基原植物[1-4],主要分布于我国的广东、海南、广西 和云南等地[3]。近年来,随着野生白木香生境的片段化和人为掠夺式开采导致白木香野生资源处于濒危状态[5]。尽管现在白木香的人工栽培规模逐年增加,但白木香漫长的结香周期和复杂的结香过程,导致沉香质量和产量仍远远不能满足沉香市场的需求[6]。白木香人工栽培植株的生长和结香的周期长达5~8 a,甚至更长,科学的栽培技术对于促进白木香人工林的生长、结香具有重要意义。营养元素代谢作为白木香植株生长、发育、沉香形成的物质基础是高效栽培技术集成不可缺少的理论基础与科学依据。近年来,国内外对于白木香营养元素代谢的研究多集中于白木香生长特定时期(如幼苗期等)的营养管理对其生理生长的影响等方面[7-13],对在成龄树结香过程中受到强烈人为或者自然因素干预、胁迫阶段的营养代谢方面的研究较少,为此成龄树结香阶段白木香植株营养代谢规律理论有待丰富。白木香结香过程是植株在自然或者人为因素影响下进行防御性次生产物代谢、积累、转化的过程[14],该过程中是否伴随着营养元素代谢规律的改变,以及结香与营养是否存在协同过程有待研究。研究结果表明,沉香的形成过程伴随着淀粉的转化[15],但该过程中营养元素的代谢是否与光合产物的积累、代谢、转化存在关联亦需要进一步明确。笔者拟通过分析在白木香结香初期阶段伴随着沉香的形成白木香植株的营养元素、叶片叶绿素含量等指标的变化,开展白木香结香初期营养元素与结香协同变化规律的研究。成龄树结香阶段营养元素代谢规律的研究对于丰富白木香结香理论内容,指导通过营养代谢途径调控沉香的生产具有现实意义。
HTML
-
试验材料为中国热带农业科学院文昌试验基地4年生的热科2号白木香植株。试验地位于海南省文昌市迈号镇(E 110°45′36.19″,N19°32′17.11″),土壤类型为冲积土,质地为沙壤土,土壤养分状况整体偏中下(表1)。
土壤养分 含量/(mg·kg−1) 分级等级 全 氮 297.73±17.32 6 碱解氮 51.33±1.76 5 全 磷 592.50±198.55 4 有效磷 36.05±6.96 2 全 钾 1375.62±78.5 6 速效钾 31.24±1.14 5 交换钙 279.25±10.44 5 交换镁 39.21±2.21 4 有效铜 0.72±0.14 3 有效铁 17.87±3.45 2 有效锌 1.49±0.29 2 有效锰 11.64±1.94 3 注:根据全国第二次土壤普查养分分级标准,全氮、全磷、全钾1,2,3,4,5,6分别代表很高,高,中上,中下,低,很低水平;碱解氮、有效磷、速效钾1,2,3,4,5,6分别代表极高,很高,高,中,低,很低水平;钙、镁、铜、锌、铁、锰1,2,3,4,5分别代表很高,高,中,低,很低水平。
Note: According to the nutrient classification standard of the second national soil survey, total nitrogen, total phosphorus and total potassium 1, 2, 3, 4, 5, 6 represent very high, high, upper middle, lower middle, low, and very low levels, respectively. Available nitrogen, available phosphorus, available potassium 1, 2, 3, 4, 5, 6 represent extremely high, very high, high, medium, low, and very low levels, respectively. Calcium, magnesium, copper, zinc, iron, manganese, 1, 2, 3, 4, 5 represent very high, high, medium, low, and very low levels, respectively.Table 1. Soil nutrient regime at the experiment site
-
选取长势具有代表性的植株20株,采用人工打洞法在植株树干部位间隔5 cm左右的距离打洞(直径为0.5 cm)并贯穿树干。打洞处理2个月后,在开始出现结香迹象的植株上分别在叶片、结香部位树皮及木质部上进行取样,3次重复;以同地同时期种植且未进行打洞结香处理的热科2号植株为对照,对照的取样方法与处理植株相同。采用“S”型混合取样法,采集试验地块土层深度0~30 cm土壤样品进行营养状况分析。
-
土壤指标测定方法:土壤全氮采用半微量开式法测定;土壤碱解氮采用碱解扩散法测定;土壤全磷采用高氯酸氧化,钼锑抗比色法测定;土壤有效磷采用氟化铵浸提,钼锑抗比色法测定;土壤全钾采用NaoH熔融,火焰光度计法测定;土壤速效钾采用NH4OAc浸提,火焰光度计法测定;土壤中微量元素采用原子吸收分光光度法(AAS法)测定[16]。每指标均重复3次,取其平均值。
叶片叶绿素含量测定方法:采用乙醇浸提法[17]测定叶片叶绿素含量。具体方法:称取0.5 g新鲜叶片剪碎于20 mL 95%乙醇中,在室温下浸提至叶片绿色褪去,将提取液过滤到50 mL容量瓶定容,以95%乙醇作为空白对照,分别在663、645 nm波长下测定吸光度,并分别计算叶片叶绿素a、叶绿素b含量,两者之和为叶片叶绿素含量。重复3次,取其平均值为测定值。
植物样品测定方法:植物的全氮测定采用H2SO4-H2O2消煮,奈氏比色法测定;植物的全磷测定采用H2SO4-H2O2消煮,钼锑抗比色法测定;植物的全钾测定采用马弗炉灰化,火焰光度计法;植物的中、微量元素测定采用马弗炉灰化,原子吸收分光光度法测定[16]。每指标均重复3次。
-
采用Microsoft Excel完成试验数据的整理、计算和作图。采用SAS9.0进行数据处理与统计分析,相同指标进行T测验比较,以不同大写字母表示极显著差异(P<0.01),不同小写字母表示显著差异(P<0.05)。
1.1. 材料
1.2. 试验处理与取样
1.3. 样品分析方法
1.4. 数据分析与作图
-
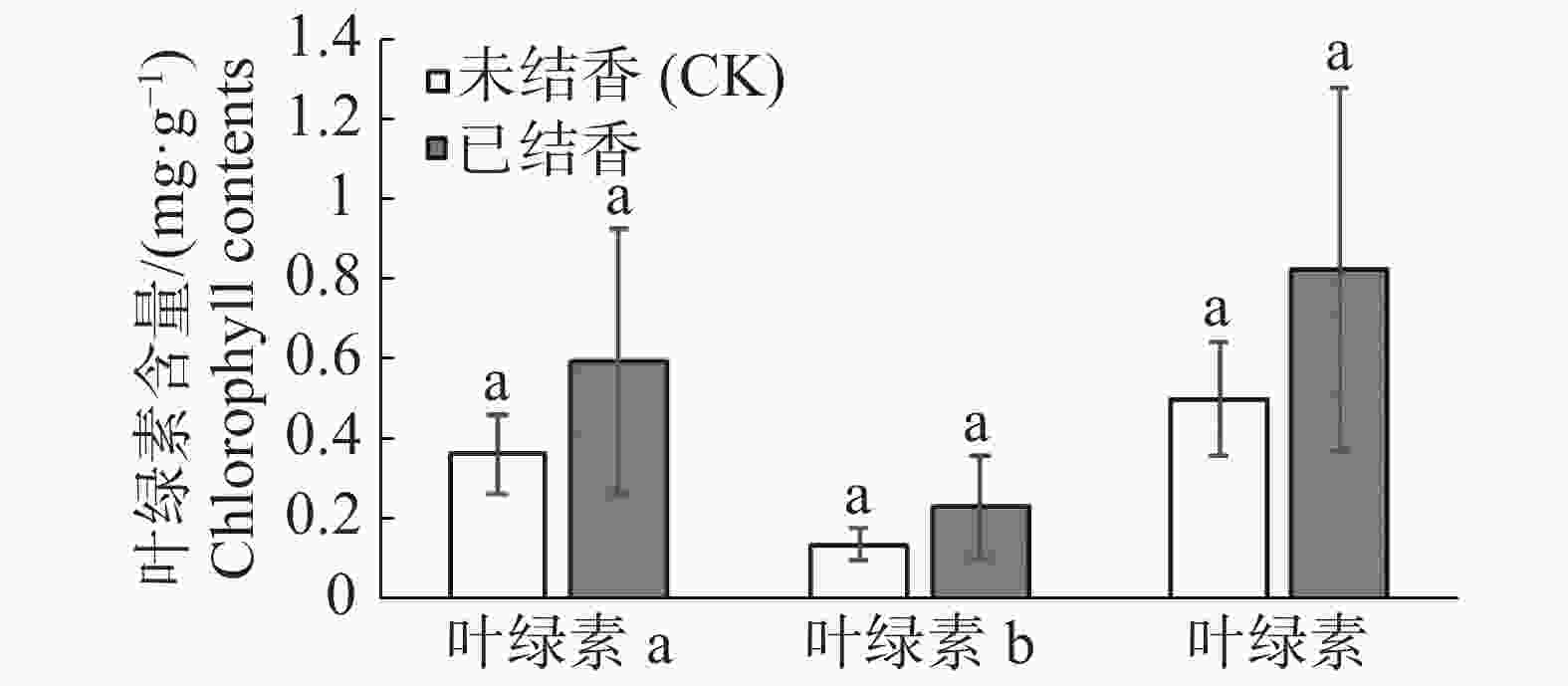
白木香人工打洞结香初期的叶片叶绿素含量分析结果(图1)表明,结香后白木香叶片叶绿素a、叶绿素b和叶绿素总含量均呈上升趋势,但与未结香对照植株相比,均未达到差异显著水平。叶片叶绿素含量的提高可能是白木香植株对人工打洞结香形式的人为损伤胁迫产生的响应,叶片叶绿素含量的提高可为增加光合产物的输出促进树体伤害的修复奠定物质基础。
-
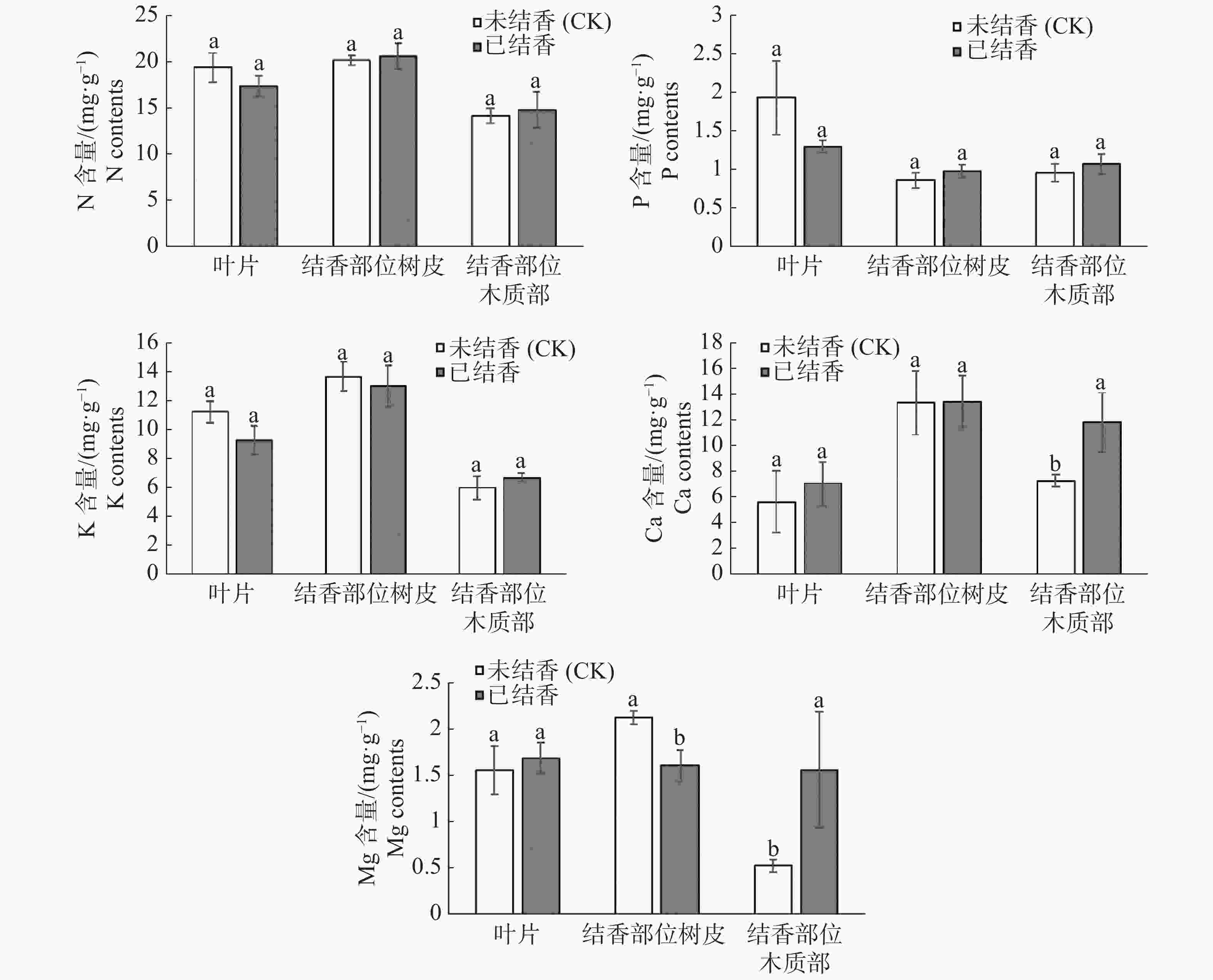
结香初期,白木香的叶片、结香部位树皮和木质部的大、中量元素的分析结果(图2)表明,结香植株叶片的氮、磷、钾营养元素含量呈下降趋势;钙、镁呈现上升趋势,但均未达到差异显著水平。树皮的氮、磷、钙含量呈上升趋势,钾、镁元素呈下降趋势,但差异均未达到差异显著水平。结香后木质部部位营养元素氮、磷、钾、钙、镁含量呈上升趋势,其中钙、镁元素含量变化达到差异显著水平。说明结香初期,白木香的叶片、结香部位树皮和木质部的大、中量元素亦均未达到差异显著水平。
-
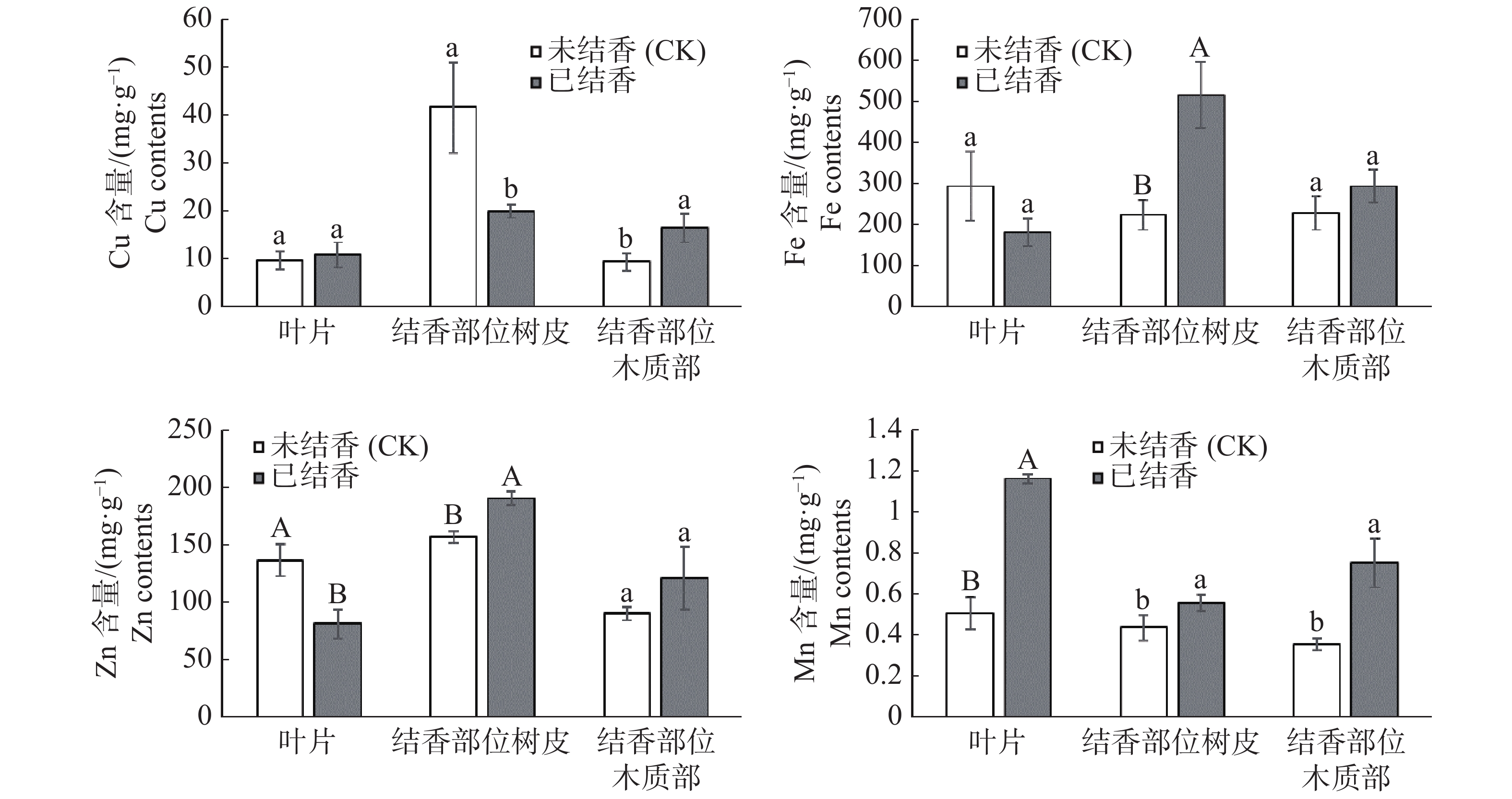
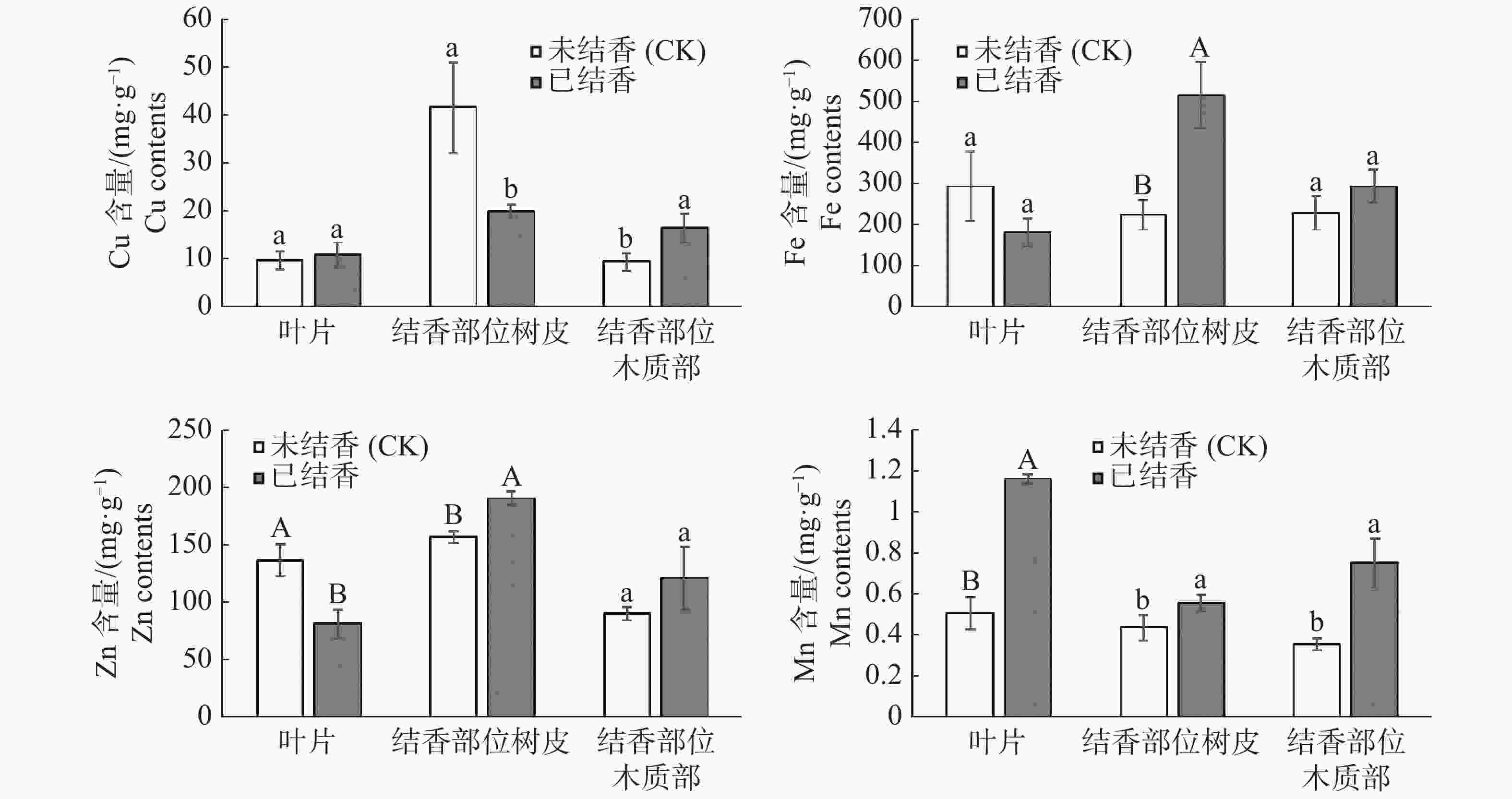
从图3可见,结香初期,白木香植株叶片微量元素含量变化差别较大,铜、锰元素含量上升,且锰元素呈极显著上升水平;叶片中铁、锌元素呈下降趋势,其中锌元素含量极显著下降。结香后,结香部位树皮中铁、锌、锰元素上升达到差异显著水平;同时结香部位树皮中铜元素含量显著下降。结香部位木质部微量元素呈上升趋势,其中铜、锰元素含量差异达到显著水平,而铁、锌元素含量上升但未达到差异显著水平。
-
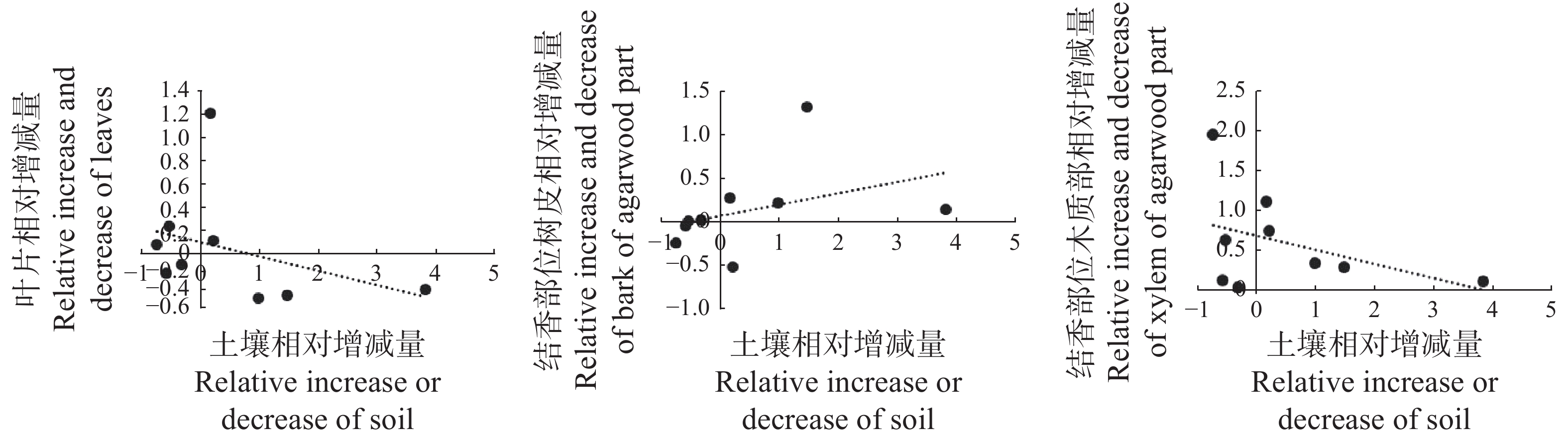
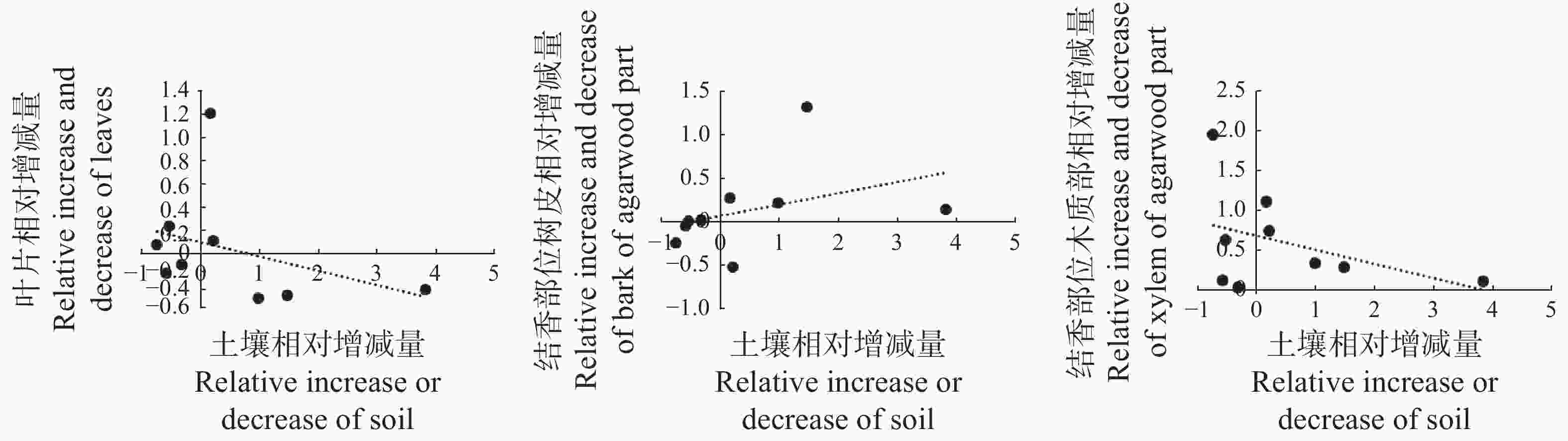
对结香初期白木香植株叶片、结香部位树皮和木质部养分相对增减量与取样土壤养分相对增减量进行相关性分析,结果(图4)表明,土壤养分相对增减量与植株的叶片、木质部的养分相对增减量成负相关,其相关系数分别为0.363 1、0.417 6;土壤养分相对增减量与植株树皮成正相关,相关系数为0.379 4。统计分析结果显示各相关性均未达到差异显著水平。由此可见,结香后白木香植株营养元素的变化并非是由土壤营养状况的改变而引起的。
-
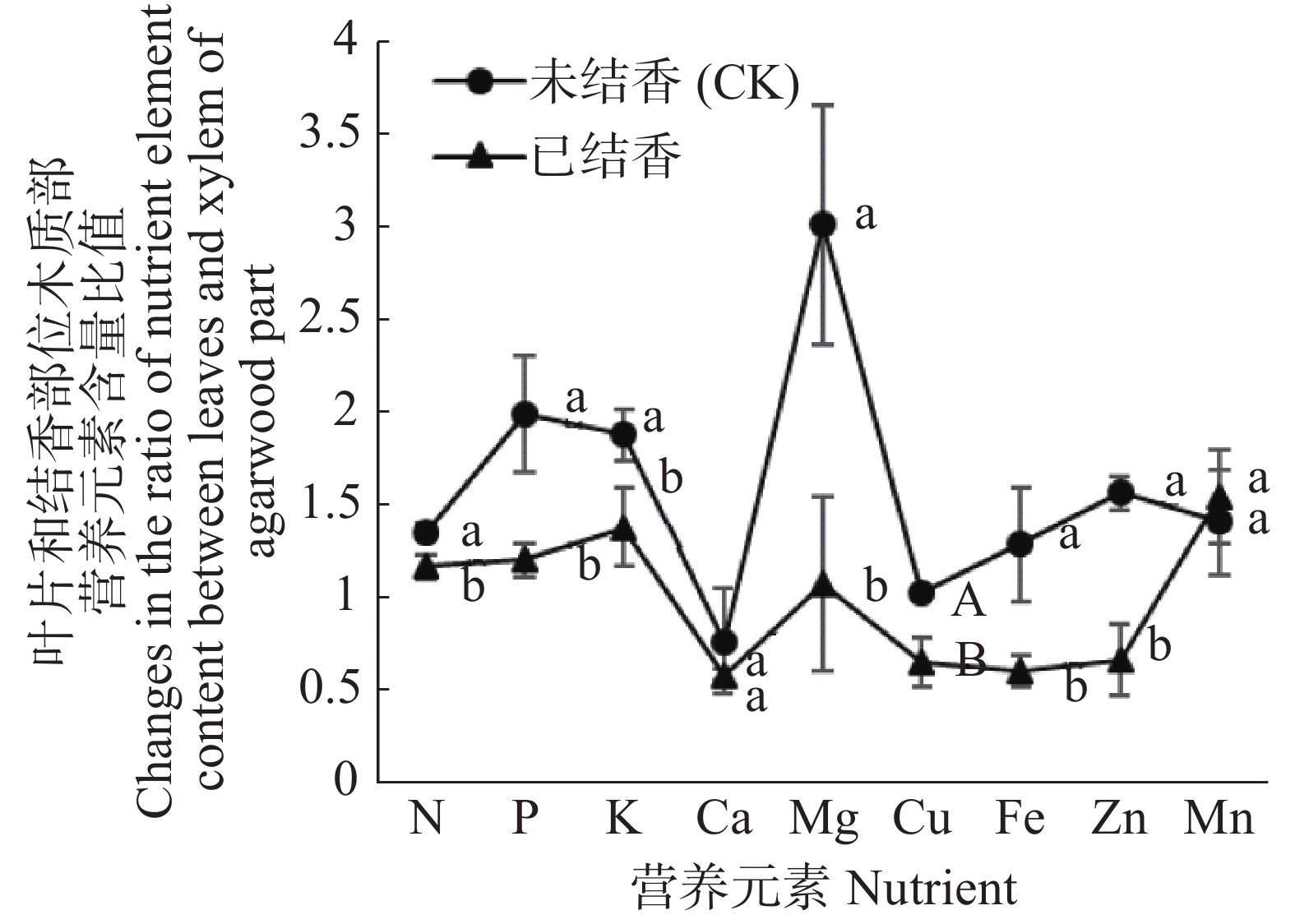
通过分析植物不同部位营养元素比值的变化可判断营养元素的迁移规律[18]。结香初期白木香的叶片、木质部营养元素迁移规律的分析结果(图5)表明,与未结香植株相比,结香后植株的叶片、木质部的氮、磷、钾、镁、铜、铁、锌营养元素比值均呈显著下降趋势。同时,植株叶片、木质部钙元素比值成下降趋势,而锰元素比值呈现上升趋势,但均未达到显著水平。结果表明,结香过程中伴随着树体伤害的修复和沉香的形成,白木香植株体内的矿质元素具有由叶片向结香的树干木质部位迁移的趋势,亦在一定程度上表明白木香结香与矿质营养关系密切。
2.1. 白木香结香初期叶片叶绿素含量变化
2.2. 结香初期白木香植株的大、中量元素含量的变化
2.3. 结香初期白木香不同部位微量元素含量变化
2.4. 土壤养分与结香初期养分增减量的相关分析
2.5. 结香初期白木香的叶片和树干营养元素迁移规律的分析
-
人为非生物胁迫可造成植株光合系统的改变。对柑桔的环割和环剥的研究结果表明,环割和环剥处理导致叶绿素相对含量(SPAD)均下降[19]。研究人员推测可能是由于环剥破坏了韧皮部,影响了同化物向下运输[20],导致叶片积累大量光合产物[21],随着大量光合产物在叶片累积,从而抑制了光合作用。吴文华等[22]对土沉香进行不同损伤处理后发现,在植株主干砍树干粗的1/3~1/2楔形缺口同时配合部分截枝断根处理后,处理植株叶片光合速率呈增加趋势,但只有配合截断所有树枝处理的光合特性和荧光参数增加达到差异显著水平。可见,严重损伤处理给沉香植株造成较大的胁迫,导致叶片的光合能力显著增强[22]。本试验人工打洞结香处理是将树干打穿,严重破坏木质部,模拟白木香植株受到严重损伤而结香,结香后叶绿素含量虽然上升,但并未达到显著水平,这可能是人工打洞处理造成的伤害没有前人试验处理严重所致。
-
结香过程是白木香对人为伤害胁迫进行应答、修复的过程。植物对非生物胁迫的应答可分为感知并产生信号、信号传导、产生信号应答3个阶段,最终诱导逆境相关基因表达[23]。在植物感知胁迫后,可通过钙离子(Ca2+)信号转导途径实现信号的传导[24]。胁迫状态下,植物细胞质内的游离钙离子浓度会增加,并通过钙离子与钙调蛋白启动一系列生理活动,应对植物对逆境的感知、传递、响应甚至适应。本研究中,在结香处理后,受伤部位全钙含量显著增加,是否与钙离子信号转导有关有待进一步研究。现有研究结果表明,白木香结香过程中沉香的积累主要发生于木间韧皮部和木射线中,且伴随着木间韧皮部、木射线内储藏物质淀粉的转化[25-27],同时,白木香木间韧皮部筛管筛孔上附着多糖类的胼胝质,在创伤与逆境胁迫中具有重要的调控作用[27],可见沉香形成过程中与光合产物等能量物质的储藏、转化有密切的关系。周晓超等[28]的研究结果表明,钾、钙元素含量与可溶性糖含量呈正相关。本研究结果表明,白木香结香部位钾、钙元素含量呈现上升趋势,其中钙元素显著增加。
沉香特征性成分以倍半萜类和2−(2−苯乙基)色酮类为主[29],然而关于沉香中这两大类成分积累与结香期植株营养间的相关性尚不明确。针对镁、锰在调控小白菊内酯(Parthenolide)代谢的研究结果[30]表明,镁、锰可通过影响萜烯合酶的活性影响小白菊内酯的生物合成;镁、锰元素的合理供应对提高次生代谢产物的含量至关重要。本研究结果表明,白木香结香过程中,结香部位营养元素呈上升趋势,其中钙、镁、铜、锰的增加达到差异显著水平,其中大量元素氮、磷、钾营养元素呈上升趋势但未达到差异显著水平;叶片中氮、磷、钾呈下降趋势但差异亦未达到差异显著水平。这意味着白木香植株在结香过程中伴随着次生产物的代谢、积累过程,可能发生营养元素代谢的变化和对营养元素需求的增加,需要合理的营养供应,其中微量元素的作用可能更加显著。
-
白木香生长环境与结香关系的分析结果[31]表明,环境因子与结香关系密切,其中土壤因子与沉香特征性成分呈不同程度的负相关,交换性钙和交换性镁与结香质量有着较高的负相关性。笔者通过分析白木香结香后植株不同部位与种植地块养分相对增减量的相关性,发现植株不同部位养分的相对增减量与土壤养分的相对增减量相关性均未达到显著相关,表明白木香结香期营养元素的变化主要取决于植株代谢过程的改变,而非由种植地营养状况的改变而引起,这说明树体受到伤害胁迫后,结香部位作为树体修复、次生产物代谢最活跃的部位,光合产物及其相关营养元素优先向生理活动最为活跃部位分配。这与文献[32]的研究结果一致。与未结香植株相比,白木香结香后叶片与木质部营养元素的比值(叶片含量/木质部含量)显著下降,表明结香阶段营养元素向结香部位迁移趋势明显且营养元素迁移的趋势与种植地块营养状况的相关性不明显。








 DownLoad:
DownLoad: