-
火龙果 (Hylocereus undatus)是一种仙人掌科植物,原产地在南美洲和中美洲等部分地区,属于典型的热带植物,在我国引入后,得到了广泛的驯化和改良,品种更加丰富,目前在我国广东、广西、海南以及福建等地区均有推广种植和栽培,成为了一种倍受人们喜爱的热带水果[1-2]。近些年来, 伴随着我国的火龙果种植栽培面积不断扩大,一些相应的病害也随之产生,并且火龙果采后病害呈现出逐渐加重的趋势。火龙果在采摘后的储藏运输过程中,由于自然衰老,果实会褐变萎蔫,在褐变萎蔫中还会受到多种微生物侵染造成腐烂变质,其中真菌病害十分普遍[3-4]。据报道,海南地区火龙果采后主要病害有炭疽病(Colletotrichum gloeosporioides)、根霉病(Rhizopus stolonifer)、焦腐病(Botryodiplodia theobrom),偶见镰刀菌果腐病(Fusarium sp)等[5]。这些病害对当地的果蔬产业造成了一定的经济损失。
化学杀菌剂在针对果蔬病害的防治中占据着主要地位,使用化学杀菌剂是防治果蔬采后病害的重要方式,但其易残留、会造成环境污染、易产生抗药性等缺点一直被人们诟病[6]。近年来,生物防治作为绿色安全的新兴防治技术成为国内外果蔬采后病害防治的研究热点。生物防治技术主要分为3类:微生物菌体及其代谢产物、天然提取物和基因工程技术[7-8]。拮抗菌防治病害有着不可替代的优势和潜力,是针对果蔬采后病害防治极其重要的生防材料。拮抗菌主要种类有酵母菌、细菌、霉菌等,且部分菌株已实现了商业化应用[9-10]。许多天然植物提取物中含有具有抗菌、抗氧化功能的活性物质,其中包括从食用香辛料和中草药等提取的有效成分,这些活性物质普遍具有较强的抑菌活性,且被认为有利于开发成天然新型果蔬防腐保鲜剂[11]。
综合拮抗菌和天然植物提取物的优势,加之两者都能够对病原菌起到一定的防控抑制作用,因此本研究以从火龙果上分离得到的病原菌为研究对象,筛选对火龙果采后果腐病具有较好防效的天然植物提取物,结合本实验室已有的拮抗菌(JK-A1枯草芽孢杆菌Bacillus subtilis和JK-L1广岛链霉菌Streptomyces hiroshimensis),探究2种生物抑菌保鲜方式的有效结合途径。对于拓宽火龙果采后病害的防控途经,提高生防安全性,具有十分重要的理论意义和研究价值。
HTML
-
供试果实购自海南省海口市南北水果市场,做为病原菌分离纯化(放置于室温阴凉处待其自然发病后取样)和用于致病性测定;供试土壤取自海南省海口市火龙果园,取果树根系离土表5~15 cm 的土壤样品,用密封袋封存,做好标记带回实验室用于拮抗菌的分离;供试香辛料(生姜和大蒜)和香蕉皮、石榴皮、柑橘皮、火龙果皮、黄皮皮购自海南省海口市鹏泰兴超市;供试拮抗菌为实验室前期分离鉴定得到的2株拮抗菌,分别为JK-A1枯草芽孢杆菌(Bacillus subtilis)、JK-L1广岛链霉菌(Streptomyces hiroshimensis);真菌基因组 DNA 抽提试剂盒购自生工生物工程(上海)股份有限公司。
马铃薯葡萄糖琼脂培养基 (PDA):马铃薯 200 g、葡萄糖20 g、琼脂15 g、蒸馏水 1 000 mL,pH自然;牛肉膏蛋白胨培养基(NA):蛋白胨 10 g、牛肉膏 3 g、NaCl 5 g、琼脂20 g、蒸馏水1 000 mL,pH 7.2~7.4;液体NA 培养基不加琼脂;高氏一号培养基:可溶性淀20 g,KNO3 1 g,K2HPO4 0.5 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,琼脂 20 g,pH 7.4~7.6;液体高氏一号培养基不加琼脂。
仪器与设备:BCM-1000生物净化工作台,FYL-YS-280L 型恒温培养箱,NRY-211恒温培养摇床,AL-204电子天平,ZEALWAYGR60DA高压灭菌器,Nikon ECLIPSE Ci-s/Ci-L电子显微镜,TG16KR台式高速冷冻离心机,RV-211M型旋转蒸发仪,JY300C型电泳仪,GE4832T型PCR基因扩增仪。
-
病原菌分离纯化采用常规组织分离法[12]。选取自然发病的火龙果果实,用75%酒精消毒后,用无菌水冲洗3次,然后在无菌环境下切取病健交界处组织块(5 mm × 5 mm),将病健交界处组织块置于PDA培养基平板上,于 28 ℃恒温培养箱培养 3~5 d。待长出菌丝后,转接到新的 PDA 培养基上继续恒温培养, 待长出单菌落后进行单孢培养,直至得到纯化的病原菌。
-
选取健康、大小、成熟度一致的火龙果,用75%酒精进行表面消毒备用。用无菌打孔器将PDA培养基上培养了3~5 d的新鲜病原菌打成6 mm菌饼。将菌饼贴于消毒备用的火龙果表面,每个果实接种3个,以接种PDA培养基为对照,置于 28 ℃恒温箱培养,观察发病情况。
-
将纯化菌株接种于PDA培养基,28 ℃恒温箱培养,待产孢后观察菌落形态,利用光学显微镜记录孢子形态和结构,参照《真菌鉴定手册》[13] 进行初步鉴定。
-
采用 Ezup 柱式真菌基因组 DNA 抽提试剂盒提取病原菌 DNA,使用真菌鉴定通用引物ITS1 和 ITS4 进行PCR扩增,PCR产物用1%琼脂糖凝胶电泳进行检测,序列测定委托生工生物工程(上海) 股份有限公司完成。将测序结果在 GenBank 核酸数据库中进行 Blast 比对,并结合数据库中的同源序列,利用 MEGA6.0 软件中的 Neighbor-joining 构建系统进化树。
-
通过平板对峙实验对拮抗菌进行抑菌活性测定,测量抑菌带宽度,宽度越大表示抑菌活性越强。
-
植物提取物制备方法参照张新龙[14]的方法,并适当修改。取适量新鲜热带水果果皮或主要香辛料(生姜和大蒜),50 ℃烘箱干燥5 h,粉碎机粉碎,过40目筛,称取25 g干燥植物材料粉末于三角瓶中,按料液比1∶20(g·mL−1)往瓶中加入浓度为95%的乙醇溶液,50 ℃条件下超声波提取30 min。处理液用4层纱布过滤,以5 000 r·min−1转速离心20 min。取上清液,50 ℃旋转蒸发去除乙醇成浸膏状态,干燥后加入适量蒸馏水超声振荡溶解,定容至50 mL,得提取物悬浮母液,于4 ℃冰箱保存备用。
-
采用打孔法[15]测定不同植物(香蕉皮、石榴皮、柑橘皮、火龙果皮、黄皮皮、生姜和大蒜)提取液的抑菌效果。采用对倍稀释法测定植物提取物的最低抑菌浓度(MIC)。菌落被完全抑制时的提取液浓度即为最低抑菌浓度。用十字交叉法测量抑菌圈直径,抑菌圈越大表示抑菌作用越强,并选择该提取液进行下一步的抑菌实验。
-
按照单因素实验数据,以拮抗物质对菌丝生长抑制率指标为考查指标,分别研究拮抗菌种类、拮抗菌浓度、黄皮皮提取液浓度和生姜提取液浓度 对2株镰刀菌的抑菌活性的影响。4个因素分别设计3个水平(表1),利用SPSS软件生成正交表(表2),并进行实验获得菌丝生长抑制率结果。
水平
LevelA. 拮抗菌种类
Antagonistic bacteriaB. 拮抗菌浓度/(CFU·mL−1)
Concentration of antagonistic
bacteriaC. 黄皮皮提取液浓度/(g·L−1)
Concentration of wampee
peel extractD. 生姜提取液浓度/(g·L−1)
Concentration of
ginger extract1 A1 1×106 500 500 2 L1 1×107 250 250 3 A1+L1 1×108 125 125 Table 1. Orthogonal design factors of inhibition of pathogens with combinations of antagonistic bacteria fermentation broth and plant extracts
试验号
Code因素 A. 拮抗菌种类
Antagonistic bacteriaB. 拮抗菌浓度/(CFU·mL−1)
ConcentrationC. 黄皮皮提取液浓度/(g·L−1)
Concentration of wampee
peel extractD. 生姜提取液浓度/(g·L−1)
Concentration of
ginger extract1 1 1 1 1 2 1 2 2 2 3 1 3 3 3 4 2 1 2 3 5 2 2 3 1 6 2 3 1 2 7 3 1 3 2 8 3 2 1 3 9 3 3 2 1 Table 2. Orthogonal combinations of antagonistic fermentative bacteria and plant extracts
吸取6 mL植物提取液与拮抗菌发酵液等比例混合于三角瓶中,并与54 mL PDA培养基混匀,倒入培养皿中,每皿20 mL。无菌条件下每个平板中央放置1块6 mm新鲜病原菌菌饼,重复3次,以加入等量无菌水为对照。置于28 ℃恒温培养箱中培养,培养5 d后用十字交叉法测量菌落直径,按如下公式评判抑菌效果。
1.1. 材料与仪器
1.2. 实验方法
1.2.1. 病原菌分离纯化
1.2.2. 病原菌的柯赫氏法则验证
1.2.3. 病原菌形态鉴定
1.2.4. 病原菌分子生物学鉴定
1.2.5. 拮抗菌的抑菌活性测定
1.2.6. 植物提取物的制备
1.2.7. 植物提取物的抑菌效果
1.2.8. 植物提取液与拮抗菌发酵液复合效果筛选
-
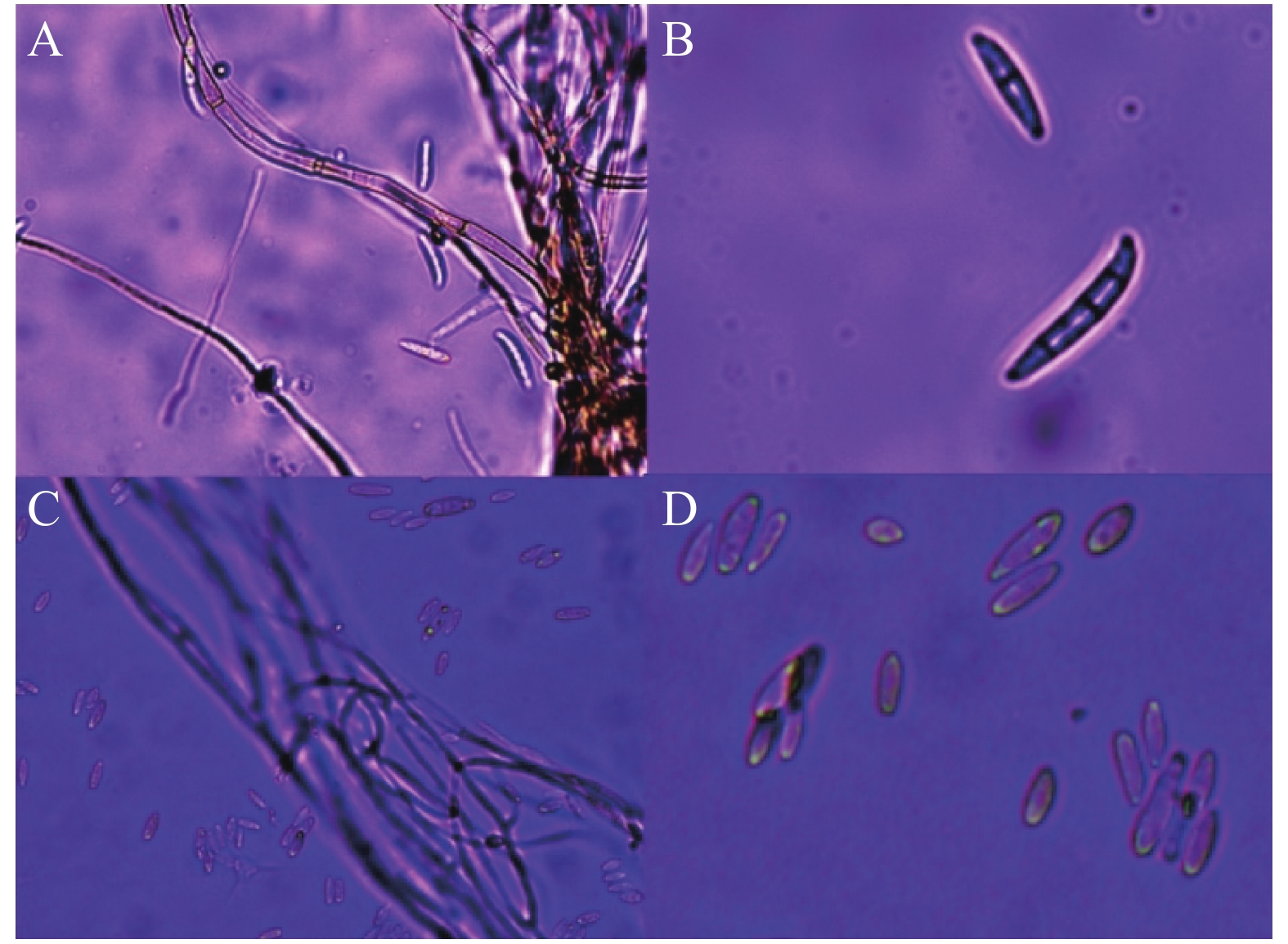
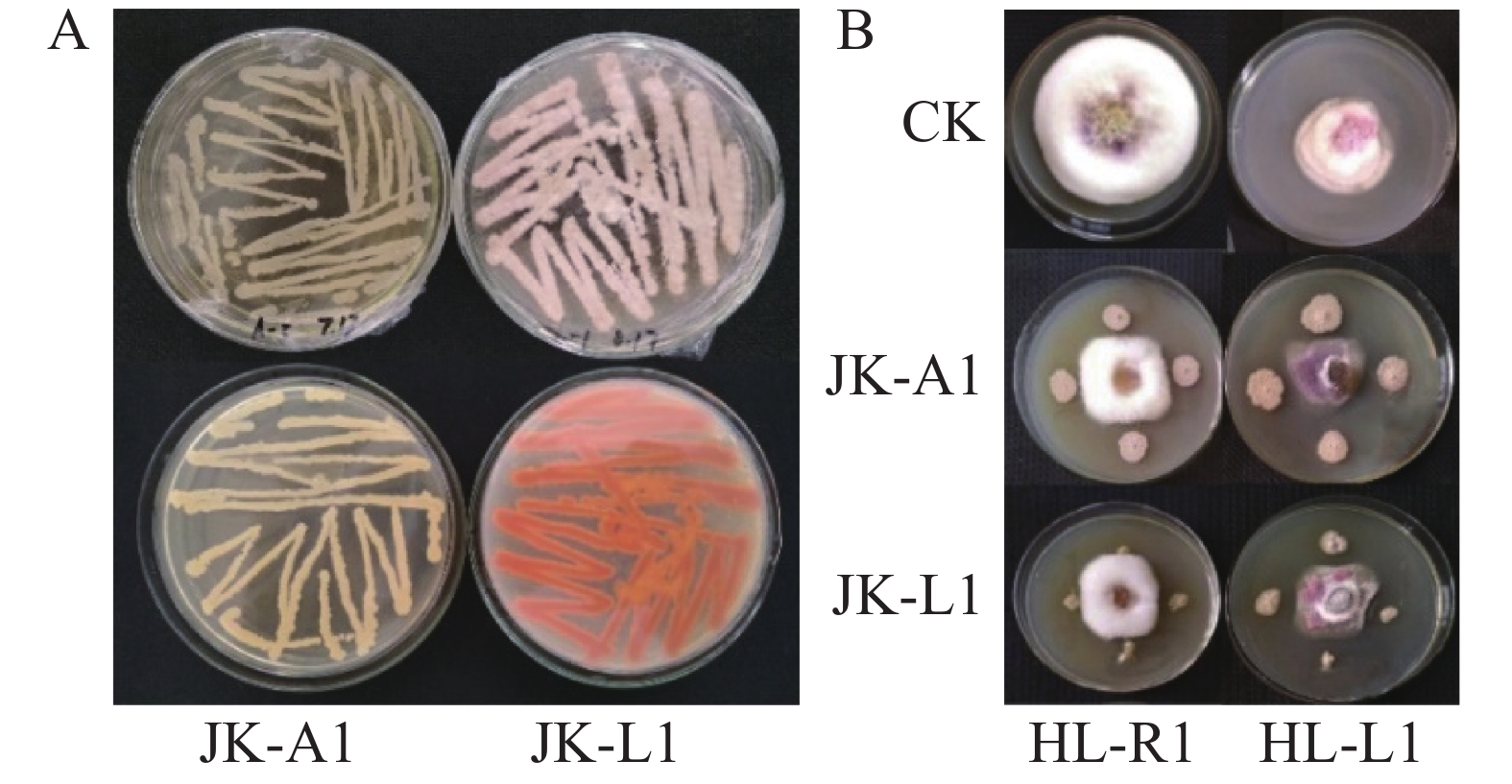
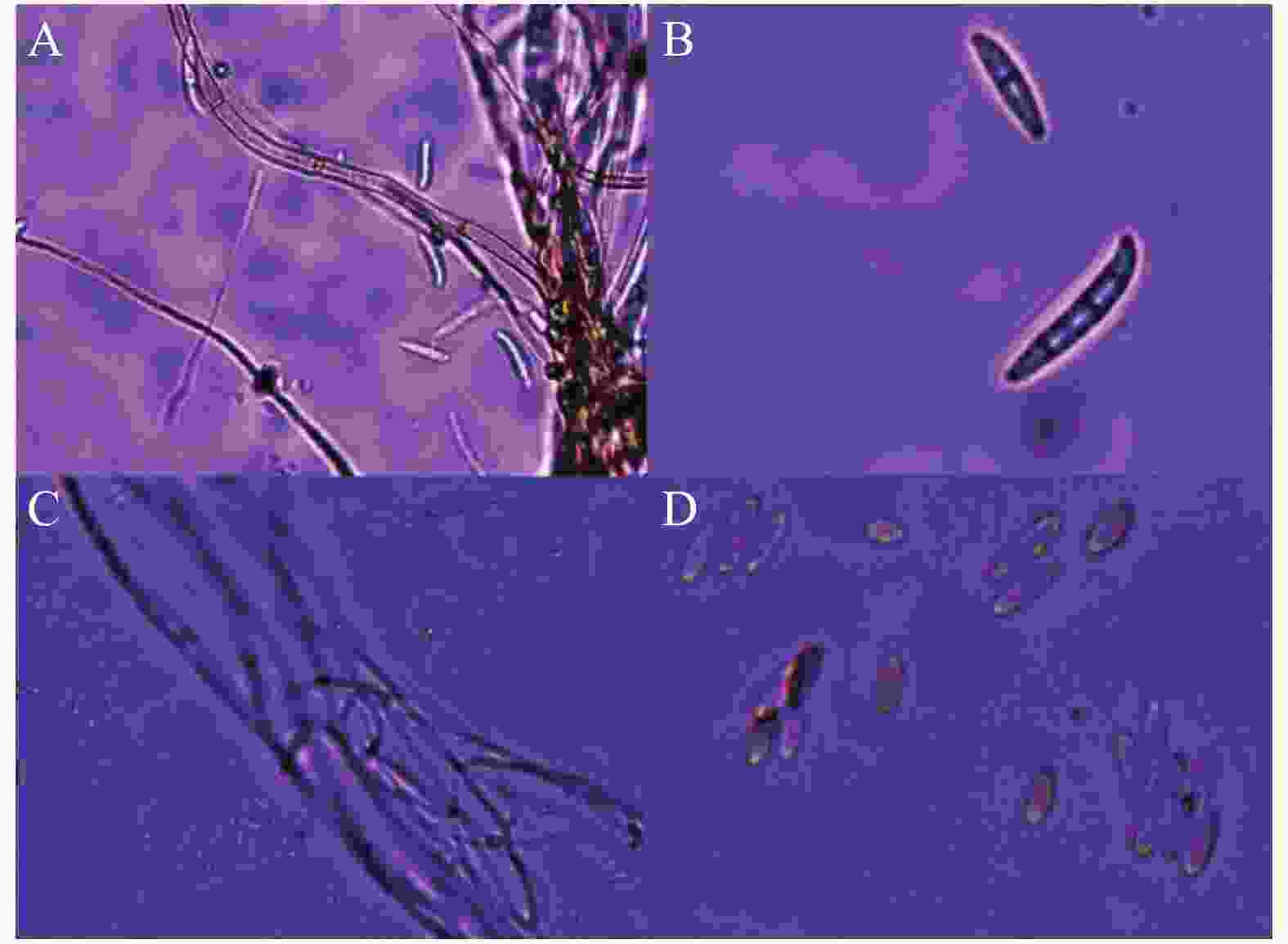
从自然发病的火龙果果实上分离得到2种主要病原微生物,分别命名为菌株HL-R1和HL-I1,经过致病性检验实验后,可造成火龙果发病(图1-A)。病原菌菌株 HL-R1 在 PDA 培养基上的菌落呈圆形,生长旺盛,气生絮状菌丝初期呈白色,后期有橙黄色孢子堆产生(图1-B);培养基平板背面颜色初期为白色,后变为黄褐色。经显微镜观察可得菌丝及孢子形态(图2-A),大型分生孢子镰刀状,略微向内弯曲,3~5 个隔膜(图2-B)。根据病原菌菌落形态和大型分生孢子特征,参考《真菌鉴定手册》,初步鉴定为镰刀菌属。

Figure 1. Morphology of pathogen strains HL-R1 and HL-I1 on PDA medium The upper two mediums in B are viewed from the front, and the lower two from the back.
病原菌菌株HL-I1在PDA 培养基生长初期可形成白色絮状菌丝, 随后由菌丝中心转变为淡紫色, 并产生紫红色色素(图1-B);经显微镜观察可得菌丝及孢子形态(图2-A)大型分生孢子镰刀形、多细胞、3~5 隔膜;小型分生孢子卵圆形至椭圆形(图2-D)。根据病原菌菌落形态和分生孢子特征,参考《真菌鉴定手册》,初步鉴定为镰刀菌属。
-
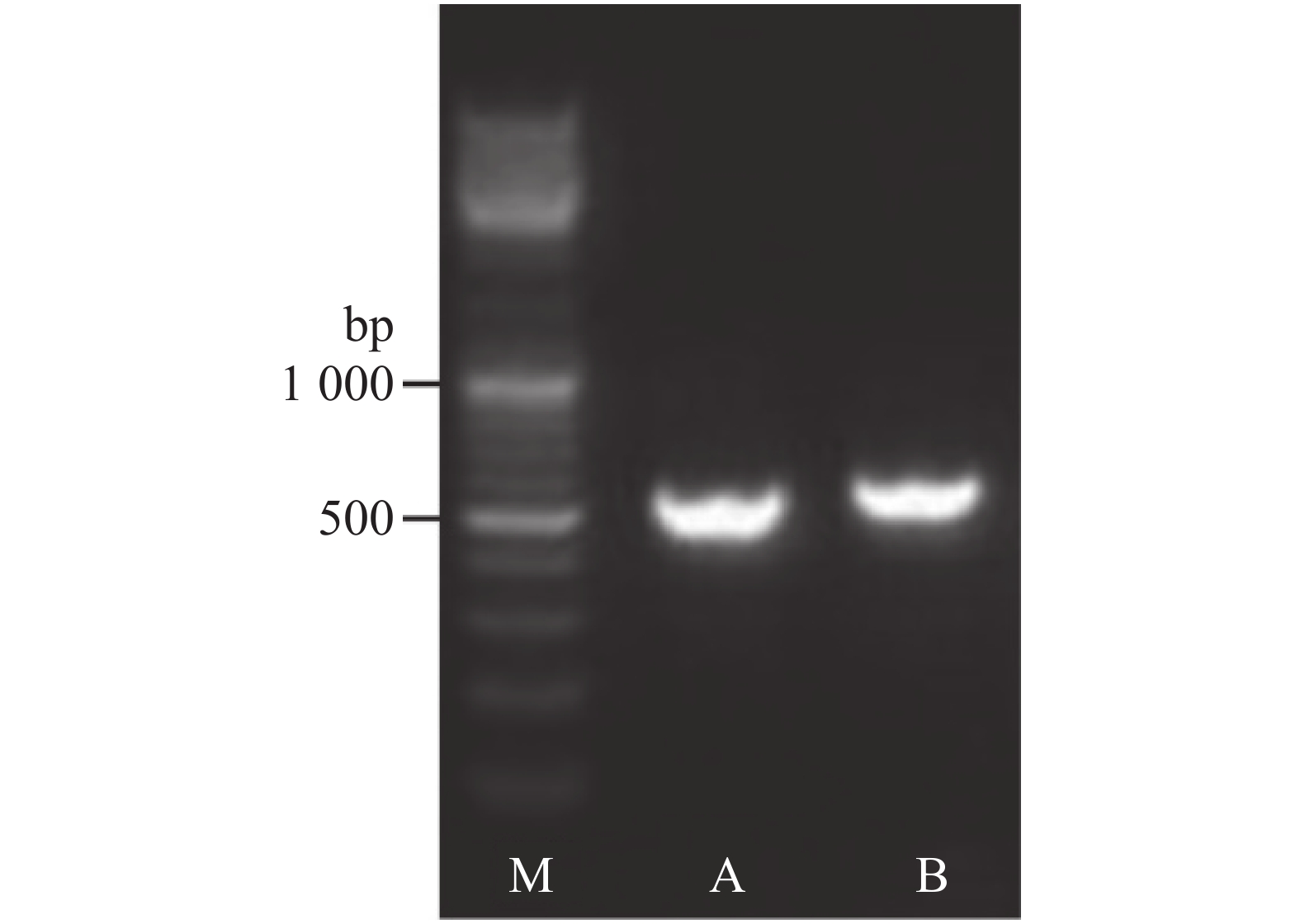
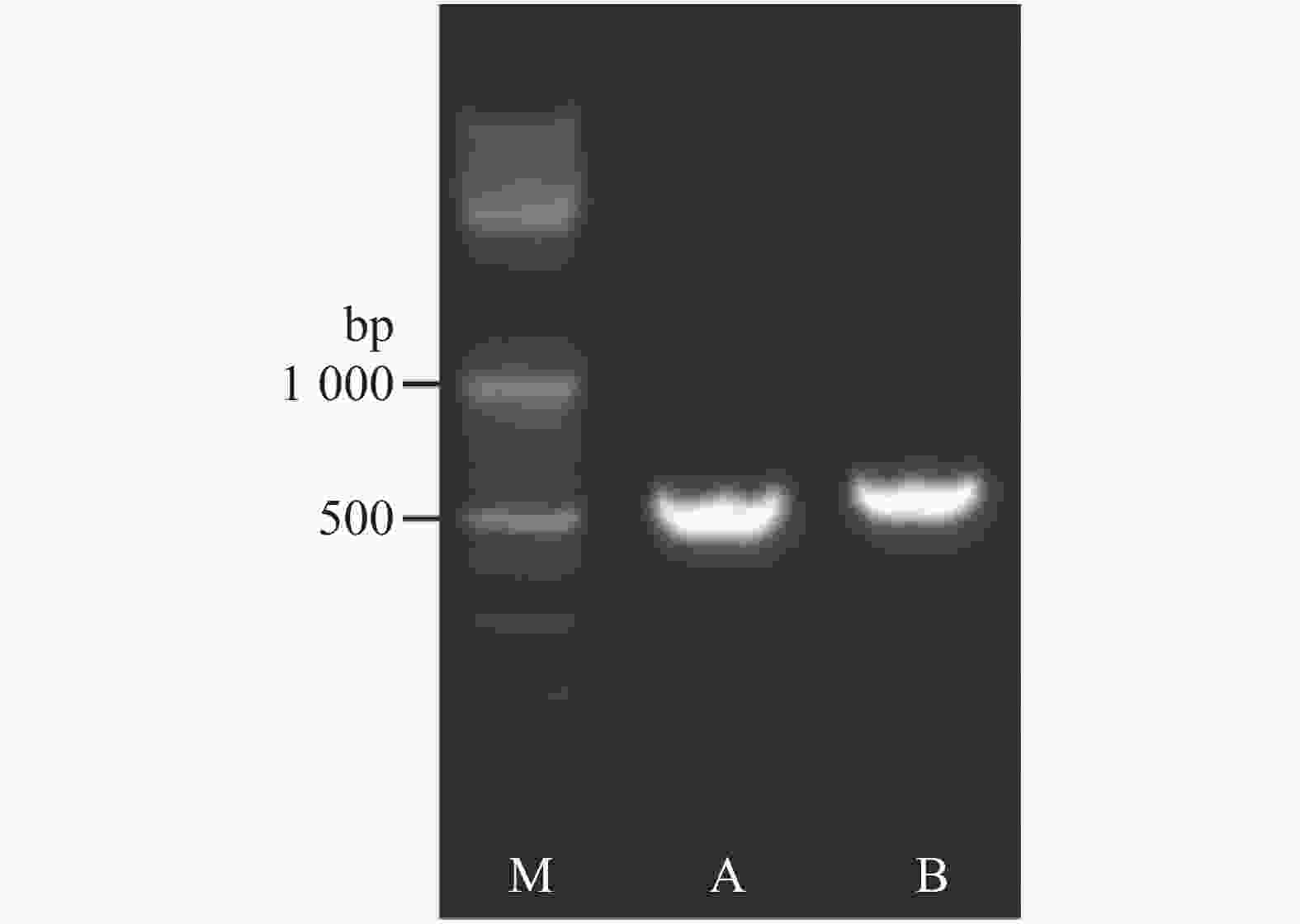
采用 rDNA-ITS 分子鉴定将分离获得的病原菌鉴定到种。以分离获得的病原菌菌株HL-R1、HL-I1的基因组 DNA 为模板,使用真菌通用引物ITS1和ITS4扩增获得它们的rDNA-ITS 序列(图3)。测序结果表明,病原菌菌株HL-R1和HL-I1的序列长度分别为 521 bp和557 bp。将病原菌菌株HL-R1序列在NCBI上进行BLAST比对,结果表明,菌株HL-R1的rDNA-ITS序列与镰刀菌属的木贼镰刀菌(Fusarium equiseti,登录号MH707078)的 ITS序列100% 同源, 而菌株HL-I1的rDNA-ITS 序列则与尖孢镰刀菌(Fusarium oxysporum,登录号MK751702)的同源性为100%,因此将菌株HL-R1鉴定为尖孢镰刀菌。将测序所得的致病真菌 HL-R1 和 HL-I1 的rDNA-ITS序列构建系统进化树, 得出火龙果致病菌的遗传关系 (图4)。
-
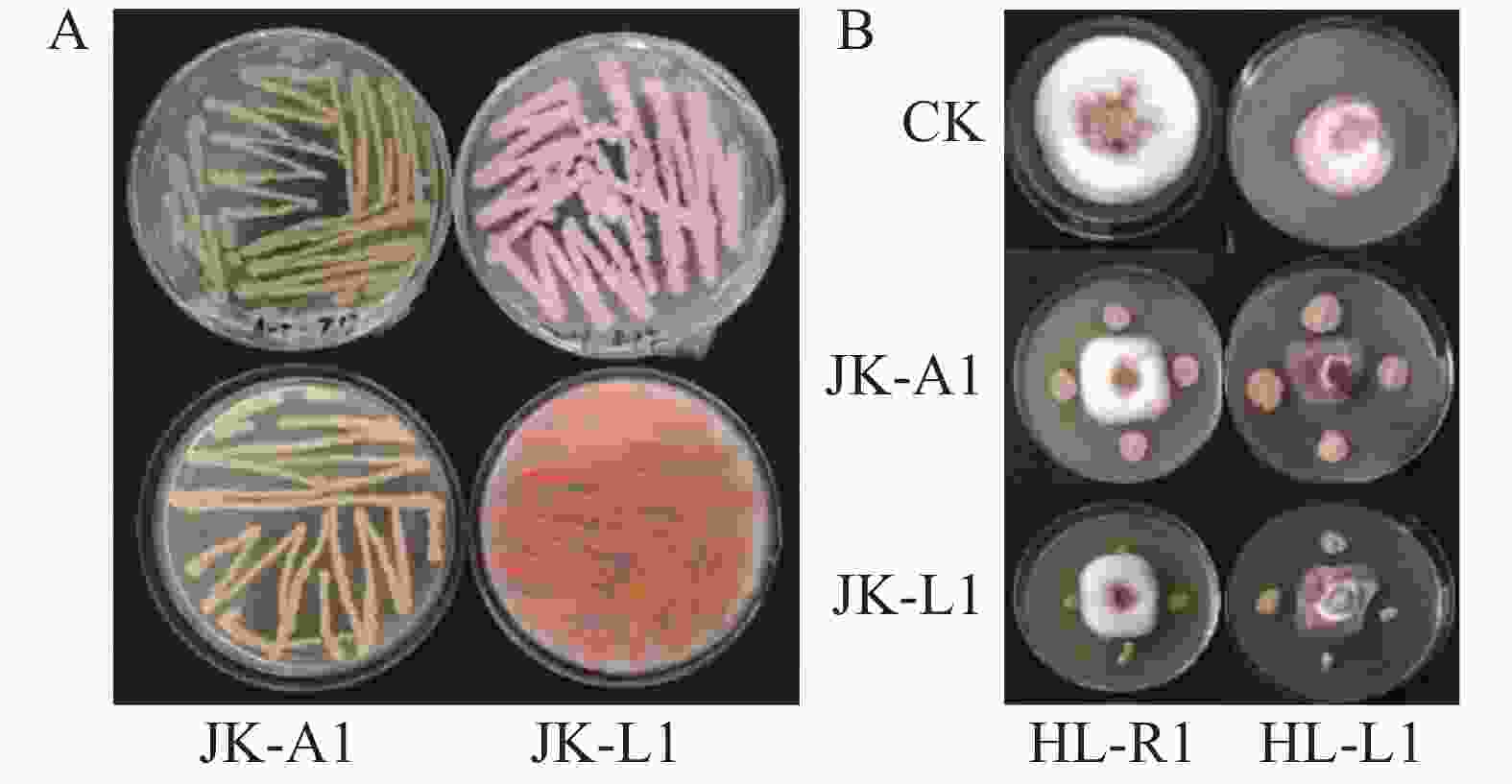
两株菌株JK-A1、JK-L1在NA培养基上的形态如图5-A所示。通过平板对峙实验,发现对HL-R1(木贼镰刀菌)、HL-I1(尖孢镰刀菌)的拮抗效果明显,对木贼镰刀菌抑菌带宽度分别为 (11.33±0.37) mm和(12.67 ±0.45) mm;对尖孢镰刀菌分别为(12.75±0.62) mm和(12.93±0.43) mm (图5-B)。
-
由表3 可知, 选取的几种植物提取物中,香蕉皮、石榴皮和柑橘皮提取液对两株病原菌抑制作用比较低;火龙果皮、黄皮皮、生姜和大蒜提取液均具有较明显的抑制作用,其中黄皮皮提取液的抑制作用较显著,对HL-R1(木贼镰刀菌)抑菌圈直径达到了(24.67±0.28)mm,对HL-I1(尖孢镰刀菌)抑菌圈直径达到了(26.00±0.55)mm。根据最低抑菌浓度(MIC)测定结果(表4),黄皮皮对HL-R1木贼镰刀菌和HL-I1尖孢镰刀菌的MIC均达到了62.5 g·L−1,抑菌能力最为突出,生姜则仅仅对木贼镰刀菌的MIC仅达到62.5 g·L−1。因此,选取黄皮皮和生姜2种提取物进行下一步实验。
植物提取物
Plant extract对HL-R1的抑菌圈直径/mm
Diameter of inhibition zone against HL-R1对HL-I1的抑菌圈直径/mm
Diameter of inhibition zone against HL-I1提取液原液 对照 提取液原液 对照 火龙果皮 14.50±0.31d 0 16.67±0.34d 0 香蕉皮 8.25±0.39f 0 7.50±0.44f 0 石榴皮 8.33±0.54ef 0 7.17±0.36f 0 柑橘皮 9.17±0.62e 0 9.25±0.41e 0 黄皮皮 24.67±0.28a 0 26.00±0.55a 0 生姜 22.35±0.47b 0 23.67±0.30b 0 大蒜 18.17±0.66c 0 19.50±0.45c 0 Table 3. Diameter of pathogen inhibition circle of different plant extracts
提取液浓度(g·L−1)
Extract concentration植物提取物 Plant extract 火龙果皮 Pitaya peel 黄皮皮 Wampee peel 生姜 Ginger 大蒜 Garlic 1000 ++ ++++ +++ +++ 500 + +++ +++ ++ 250 + ++ ++ + 125 − ++ + + 62.5 − + + − 31.25 − − − − 15.625 − − − − 注: “−”为抑菌圈直径小于6 mm, 表示无抑菌效果,“+”为抑菌圈直径大于6 mm,小于12 mm,“++” 为抑菌圈直径大于12 mm,“+”越多代表抑菌效果越强。
Note: “−” means that the diameter of the bacteriostatic circle is less than 6 mm, indicating that there is no bacteriostatic effect, “+” means that the diameter of the bacteriostatic circle is more than 6 mm and less than 12 mm, “++” means that the diameter of the bacteriostatic circle is more than 12 mm, and the more “+” means the stronger the bacteriostatic effect.Table 4. Determination of minimum inhibitory concentration (MIC) of four plant extracts against two pathogen strains
-
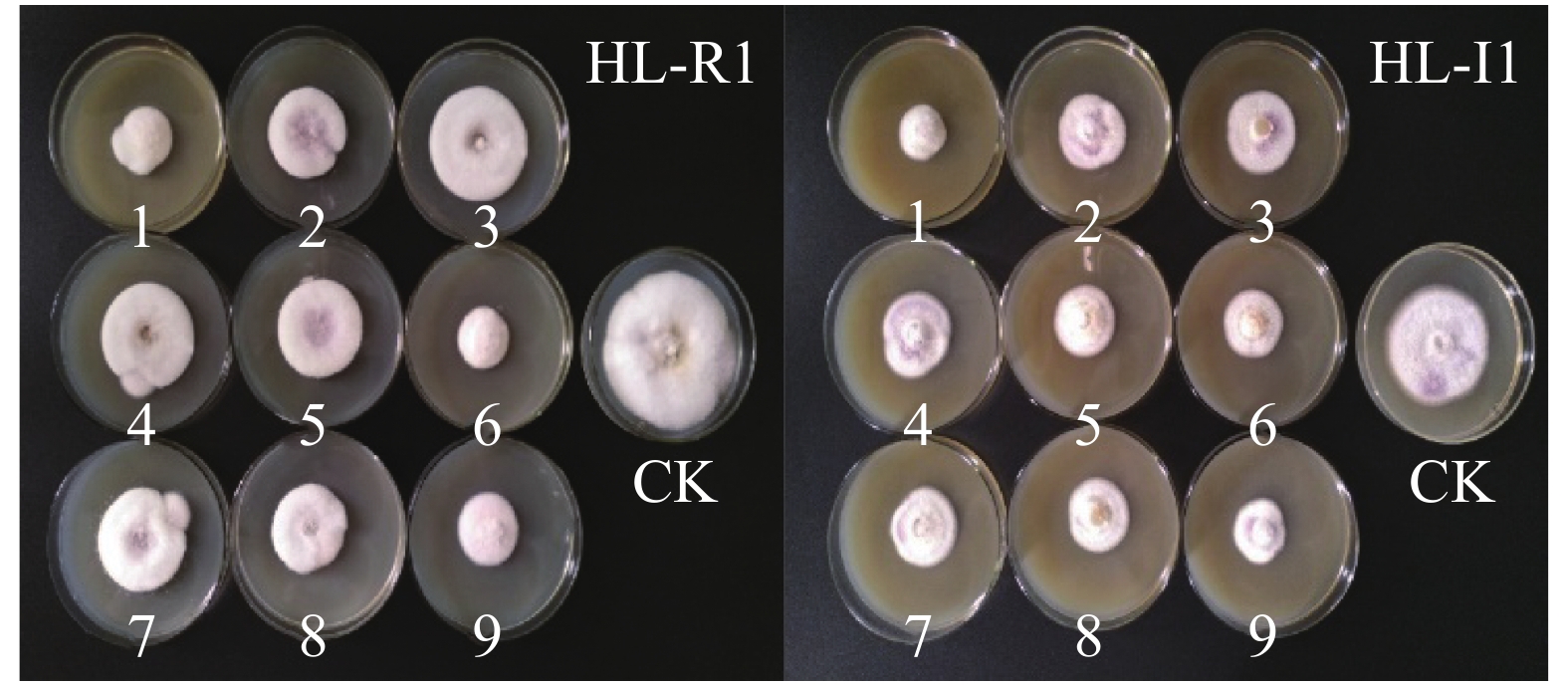
经过前期单因素影响因素的筛选,选取效果最佳的黄皮皮和生姜2种提取液,结合拮抗菌,以复合抑菌组合对菌丝生长抑制率为考察指标,抑菌结果见图6。由图6可知,菌株HL-R1和HL-I1在不同处理间均受到了明显的抑制效果。
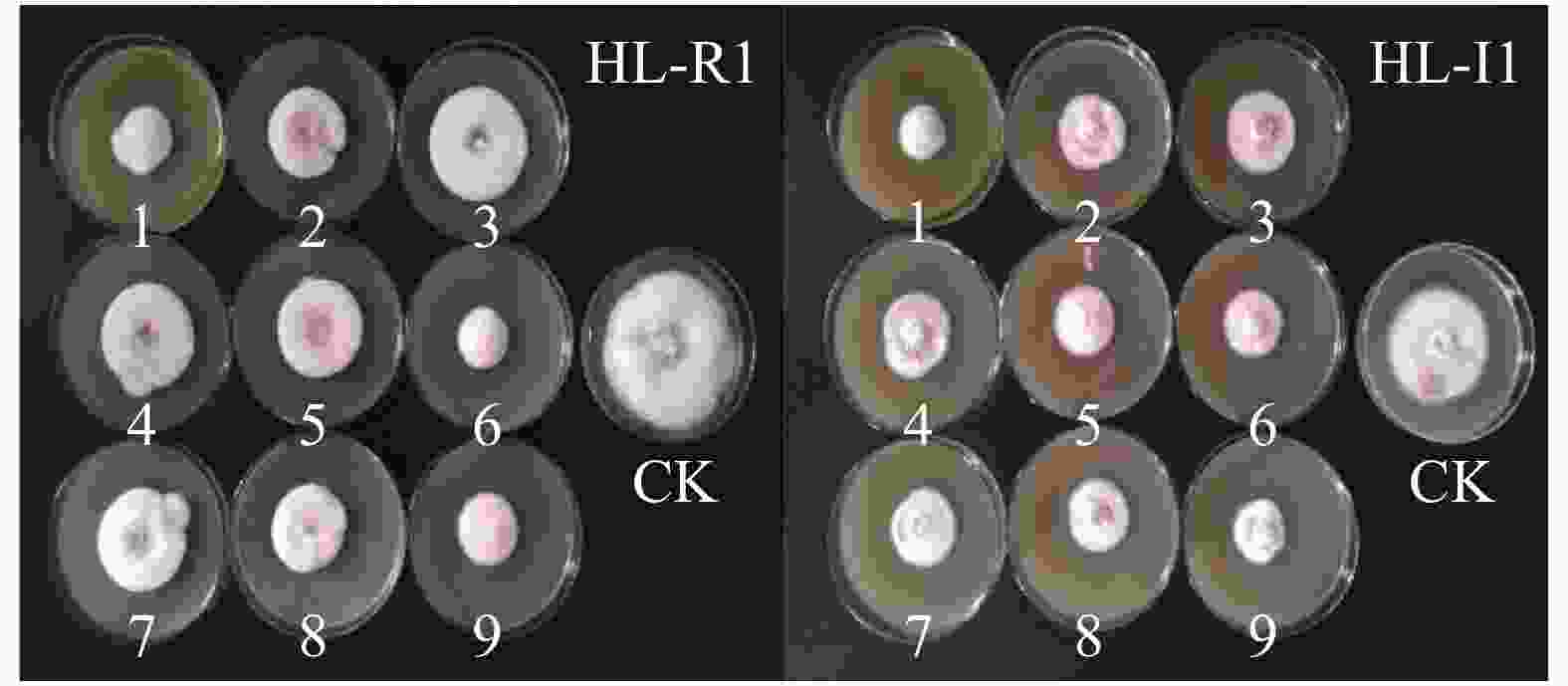
Figure 6. The compound inhibitory effect of the combination of plant extracts and antagonistic antibacterial fermentation broths at the orthogonal design on the two pathogen strains
由表5 可知,在对木贼镰刀菌的正交实验中,各因素对菌丝生长抑制率影响强弱的次序为:黄皮皮提取液浓度(C)>生姜提取液浓度(D)>拮抗菌发酵液浓度(B)>拮抗菌种类(A);在对尖孢镰刀菌的正交实验中,各因素对菌丝生长抑制率影响强弱的次序为:D>A>C>B,即生姜提取液浓度>拮抗菌种类>黄皮皮提取液浓度>拮抗菌发酵液浓度。2株病原菌得出的结果并不一致,可能是由于2株病原菌对不同的抑菌物质敏感性不同。
试验号
Code抑菌率/% Pathogen inhibition rate HL-R1 HL-I1 1 58.19 53.11 2 43.26 44.72 3 26.16 40.65 4 40.00 32.65 5 38.14 41.13 6 59.19 42.84 7 36.74 36.87 8 47.09 41.49 9 55.93 51.02 主次顺序 C>D>B>A D>A>C>B 优组合 A3B3C1D1 A1B3C1D1 Table 5. Experimental results of orthogonal combinations of antagonistic fermentation bacteria and plant extracts against the two pathogen strains
结果分析表明:抑制木贼镰刀菌生长的最佳条件为:拮抗菌种类 JK-A1+JK-L1、拮抗菌发酵液浓度1×108 CFU·mL−1、黄皮皮提取液浓度 500 g·L−1、;抑制尖孢镰刀菌生长的最佳条件为:拮抗菌种类 JK-A1、拮抗菌发酵液浓度1×108 CFU·mL−1、黄皮皮提取液浓度 500 g·L−1。
2.1. 火龙果采后病原菌的鉴定
2.1.1. 病原菌形态鉴定结果
2.1.2. 分子生物学鉴定结果
2.2. 两株拮抗菌的抑菌活性测定
2.3. 植物提取物的筛选及抑菌活性
2.4. 植物提取液与拮抗菌发酵液的复合抑菌效果
-
在本研究中,通过对火龙果致病病原分离、致病性测定以及形态学和分子生物学鉴定等方法,笔者将海南省海口市火龙果采后病害明确为2株镰刀菌:木贼镰刀菌(F. equiseti)和尖孢镰刀菌(F. oxysporum)。其中木贼镰刀菌曾被雷梦英等[16]发现可以引起广东省广州市地区火龙果的果柄腐烂病,其是否会影响火龙果可食用部分并没有明确,而林珊宇等[17]在广西地区也分离得到了木贼镰刀菌,可造成火龙果的软腐病。因此,木贼镰刀菌已经成为危害火龙果采后品质的一种重要镰刀菌,并且在其他国家或地区已报道该菌可以引起菠萝、西瓜、花卉等植物的病害[18-20]。据报道尖孢镰刀菌为上海地区火龙果采后病害的主要致病菌[21],国内外已报道的被尖孢镰刀菌严重为害的作物还有香蕉、番茄、黄瓜、哈密瓜、西瓜等多种果蔬作物[22-23]。
利用生物抑菌保鲜技术防控植物病害是近年来一种非常有前景的手段,得到了人们的广泛认可[24],其中枯草芽孢杆菌作为一种常见的芽孢杆菌属菌株,具有较强的抑菌活性。如曹琦琦等[25]发现1株对水稻纹枯病菌具有较强拮抗活性的枯草芽胞杆菌,谈泰猛等[26]也发现枯草芽孢杆菌可以用来防治辣椒疫病。链霉菌属虽然不如芽孢杆菌属应用广泛,但是也有相关抑菌报道。玫瑰轮丝链霉菌可以用来防治水稻白叶枯病菌[27],亚黄链霉菌可以用来防治烟草青枯菌[28]。另外在笔者筛选的几种天然植物混合提取物中,黄皮皮提取物和生姜提取物的抑菌活性最佳,对2株病原菌的抑菌圈直径均达到了22.35 mm以上。李奕星等[29]研究发现,黄皮不同部位提取物的抗氧化活性强弱关系为果皮>枝条>果肉>枝子,同时赵丰丽[30]研究发现黄皮叶乙醇提取物对黑曲霉、疮痂病、砂皮病、炭疽病、青霉和芒果蒂腐病等6种植物病原菌具有较强的抑菌作用,其抑菌范围较广,而生姜作为一种常见的香辛料,抑菌活性已经被广泛研究和应用[31-32]。
综合以上筛选出的几种植物提取物和拮抗菌,笔者为了探究其复合抑菌效果,考虑了几种单因素的影响,进行了相应的正交实验。结果表明,拮抗菌发酵液与植物提取液的复合配比组合对木贼镰刀菌的菌丝生长抑制率最高达到59.19%,对尖孢镰刀菌的菌丝生长抑制率最高达到53.11%。本实验结果表明,拮抗菌可以和提取物复合使用,从而达到更加稳定的抑菌效果,但其复合作用的机制以及在实际应用中的防治效果的高效性和稳定性还需要进一步探索。








 DownLoad:
DownLoad: