-
维氏气单胞菌(Aeromonas veronii)是一类杆状的革兰氏阴性菌,具有极强的适应性,并广泛存在于水环境中的常见致病菌。维氏气单胞菌于1983年首次从病患机体中分离出来并命名[1],此后该菌株不断在鱼类、水体环境以及食物中被分离鉴定出来,是一类重要的食源型致病菌[2]。维氏气单胞菌对人、鱼以及陆生哺乳动物均具有极强的致病性。鱼类感染维氏气单胞菌后会使体表充血红肿甚至溃烂、内脏出血、腹水等症状[3-4];人类感染维氏气单胞菌后会引起严重的肠胃感染以及败血症,免疫力低下的人群甚至会引发更严重的脑膜炎以及尿路感染[5];有案例表明维氏气单胞菌可感染一些哺乳动物,引发肠胃炎,并导致肝脏受损[6]。近年来,由维氏气单胞菌引发的感染案例越来越多,这对鱼类养殖业以及人类的生命安全构成了严重的威胁。因此,解构维氏气单胞菌感染和致病机理将对维氏气单胞菌的防治具有重要意义。
双组分系统广泛存在于细菌中,通过感知外界信号、信号转导进而调控细菌内基因的表达,帮助细菌快速适应变化的环境。此外,有研究表明双组分系统也与细菌致病性相关,荧光假单胞菌可通过RstA/RstB双组分系统激活外排泵增加耐药性[7],野油菜黄单胞菌通过RavA/RavR双组分系统调控鞭毛合成使其更容易侵染宿主[8]。FlrB/FlrC被鉴定为调控细菌鞭毛合成的双组分系统[9],FlrB作为传感器激酶具有自磷酸化和传递磷酸基团至受体调节器的作用,进而调控下游鞭毛基因的表达,霍乱弧菌鞭毛合成受该双组分系统调节[10]。FlrB作为感受器激酶是双组分系统中不可或缺的因子,对鞭毛系统的合成至关重要,并且鞭毛是细菌成分中影响生物膜形成的主要因子[11-12]。研究表明在溶藻弧菌中敲除flrB基因后细菌的运动性和生物膜形成显著降低[13],在霍乱弧菌中FlrC的磷酸化依赖于同源FlrB,磷酸化的FlrC能提高细菌的运动和定植能力[14]。实验室前期对维氏气单胞菌进行全基因组测序分析,发现FlrB/FlrC双组分系统存在于维氏气单胞菌中。虽然flrB基因被报道与致病性性状相关,但在维氏气单胞菌中的作用机理尚未见报道。因此,本研究旨在构建flrB基因敲除株,揭示维氏气单胞菌中flrB基因的生物学作用,进一步阐明维氏气单胞菌的致病机理,为维氏气单胞菌的治疗和防治提供理论基础。
HTML
-
维氏气单胞C4菌株、大肠杆菌WM3064、pRE112质粒均为本实验室自存。基因组提取试剂盒、质粒提取试剂盒、产物纯化回收试剂盒、2×PCR MIX购自诺维赞生物科技有限公司;限制性内切为酶(KpnI、XbaI)以及T4连接酶购自NEB公司;氨苄青霉素(水溶,母液浓度50 g·L−1,工作浓度50 μg·mL−1,−20 ℃保存)、氯霉素(乙醇溶,母液浓度25 g·L−1,工作浓度25 μg·mL−1,−20 ℃保存)、二氨基庚二酸(水溶,母液浓度50 g·L−1,工作浓度50 μg·mL−1,−20 ℃保存)、LB培养基(1% NaCL、1%蛋白胨、0.5%酵母提取物)购自索莱宝有限公司。PBS缓冲液(100 mmol·L−1 NaCL,8.1 mmol·L−1 Na2HPO4,1.5 mmol·L−1 KH2PO4,2.7 mmol·L−1 KCL,PH 7.4),结晶紫染料、冰醋酸等均为国产分析纯,购自海南正恒科技有限公司。Eppendorf Centrifuge 5418 高速台式离心机(Eppendorf 中国有限公司)、Life ECO-PCR 基因扩增仪(杭州博日科技有限公司)、Bio-Rad MicroPulser 电穿孔仪(美国 Bio-Rad 公司)、HZQ-F100 振荡培养箱(哈尔滨市东联生化仪器有限公司)、ME204E 电子天平(梅特勒-托利多仪器上海有限公司)。本研究所用的flrB上下游同源臂扩增引物、flrB敲除验证引物、pRE112载体验证引物均合成于生工生物工程(上海)股份有限公司,序列见表1。
引物名称 Primer 引物序列 Primer sequence 注释 Annotation flrB-F1 GGGGTACCCATTGAGACGCCGCCGCTGCGTG 扩增flrB基因上游同源臂 flrB-R1 AGCCTGCACTGTCATAAACCTGACCTCAAAC flrB-F2 GGTTTATGACAGTGCAGGCTGGTGCCGAGG 扩增flrB基因下游同源臂 flrB-R2 CGTCTAGAGTTGGCGTAGGCGGTCATCAGC flrB-F0 GTTTGTTCGACCGGGTCGGTGG 敲除flrB基因验证引物 flrB-R0 CGTAGCGGCTGACCTGATTAAG pRE-112-F ACATAGCCCCACTGTTCGT pRE112载体验证引物 pRE-112-R TTTTCGTCTCAGCCAATCC Table 1. Primer sequence for gene knockout
-
以细菌总DNA为模板,分别用flrB-F1/flrB-R1和flrB-F2/flrB-R2 进行PCR扩增目的片段。30 μL PCR体系:2×PCR MIX 15 μL,基因组DNA 1 μL,ddH2O 12 μL,上下游同源臂引物各1 μL。反应程序:95 ℃ 10 min,95 ℃ 30 S,58 ℃ 30 S,72 ℃ 1 min,35个循环,72 ℃ 总延伸10 min 4 ℃停止反应。使用产物纯化试剂盒纯化回收扩增的DNA片段并保存于4 ℃冰箱待用,同时使用1%琼脂糖凝胶电泳检测扩增条带大小是否正确。
-
使用Overlap PCR连接上下游同源臂。Overlap PCR 体系(50 μL):2×PCR MIX 25 μL,引物flrB-F1 1 μL,引物flrB-R2 1 μL,上游扩增同源臂 1 μL,下游扩增同源臂1 μL,ddH2O 21 μL;PCR程序为:95 ℃ 10 min,95 ℃ 30 S,58 ℃ 30 S,72 ℃ 2 min,35个循环,72 ℃ 总延伸10 min 4 ℃停止反应。回收PCR产物至1.5 mL离心管中,加入30 μL 6×DNA上样缓冲液混匀并加入到1%琼脂糖凝胶孔中,120 V恒流电泳25 min。使用凝胶成像仪观测并切胶回收正确条带,使用产物纯化试剂盒回收凝胶中的DNA片段并检测浓度。以KpnI和XbaI酶切pRE112质粒和上下游同源臂连接片段,酶切体系50 μL(5 μL Cutsmart mix,KpnI和XbaI各1 μL,pRE112质粒和上下游同源臂连接片段1500 ng,加水补齐至50 μL),37 ℃酶切4 h。用产物纯化试剂盒纯化回收酶切后产物。用T4连接酶进行连接酶切后的质粒与片段,连接摩尔比质粒(片段为1∶5,连接体系为:1 μL T4连接酶,1 μL T4连接酶buffer,酶切pRE112质粒100 ng,酶切片段50 ng,加水补齐至10 μL),16 ℃连接1 h。使用电击转化法,将连接产物转化进入大肠杆菌WM3064感受态细胞中,转化细胞在37 ℃孵育1 h后涂布于氯霉素、二氨基庚二酸平板上过夜培养;挑取单菌落,使用pRE112引物进行验证,成功重组载体送测序,作进一步验证。
-
接种野生型维氏气单胞菌C4和携带有pRE112-∆flrB的大肠杆菌WM3064,分别于30 ℃和37 ℃过夜培养,以2×106 CFU· mL−1为起始菌量转接并培养至OD值为0.4~0.6;将维氏气单胞菌和大肠杆菌以(1∶1)、(1∶4)、(2∶3)、(3∶2)、(4∶1)的比例混合至1 mL,6 000 r·min−1离心3 min去上清,使用10 μL新鲜培养基重悬菌体并点于DAP平板上,置于30 ℃恒温培养箱中培养24 h以上。向培养后的接合平板上加1 mL新鲜培养基,用涂布棒刮下菌体于培养基中,取20 μL刮下的菌液稀释10倍后涂布于氯霉素和氨苄青霉素双抗平板上,于30 ℃恒温培养箱中过夜培养,挑取单菌落验证接合。挑选成功接合的单菌落接种于添加有氨苄青霉素的LB培养基中,30 ℃恒温培养过夜使其充分发生重组。取过夜培养的菌液依次稀释10、20、30倍,取200 μL各稀释梯度的菌液涂布于8%蔗糖和氨苄青霉素平板上,30 ℃恒温倒置过夜培养。挑选生长出的单菌落用F0/R0引物进行PCR验证敲除菌株。
-
挑取野生型和敲除flrB基因的单菌落接种过夜活化,以2×106 CFU·mL−1起始菌量转接至添加有氨苄青霉素的200 mL新鲜LB培养基中,150 r·min−1,30 ℃恒温培养24 h,每1 h取菌检测OD值。每组样品设置3个生物学重复,统计测量数据并绘制随时间变化的生长曲线,观察其生长情况。
-
采用96孔板微量法检测生物膜形成,挑取野生型和敲除flrB基因的单菌落接种于加氨苄青霉素的新鲜LB培养基中过夜活化,以2×106 CFU·mL−1为起始菌量转接至添加有氨苄青霉素的LB培养基中,吸取200 μL菌液于无菌96孔板中置于30 ℃静置培养36 h。吸出菌液并用PBS缓冲液清洗至澄清,常温晾干96孔板,加入200 μL 1%结晶紫燃料在常温下染色10 min,用无菌水清洗板孔至澄清状态,55 ℃烘干96孔板,加入200 μL 33%冰乙酸于37 ℃下静置30 min充分溶解附着的结晶紫染料,酶标仪检测595 nm处吸光度值。每组样品设5个生物学重复并统计数据计算差异性。
-
所有数据均采用Graphpad 6.02统计软件进行分析,(ANOVA)显著性水平设定为P<0.05[11]。
1.1. 实验材料、仪器
1.2. 扩增flrB基因上下游同源臂片段
1.3. pRE112-∆flrB载体构建
1.4. 双亲接合及敲除菌株筛选
1.5. 生长曲线测定
1.6. 生物膜形成测定
1.7. 数据统计分析
-
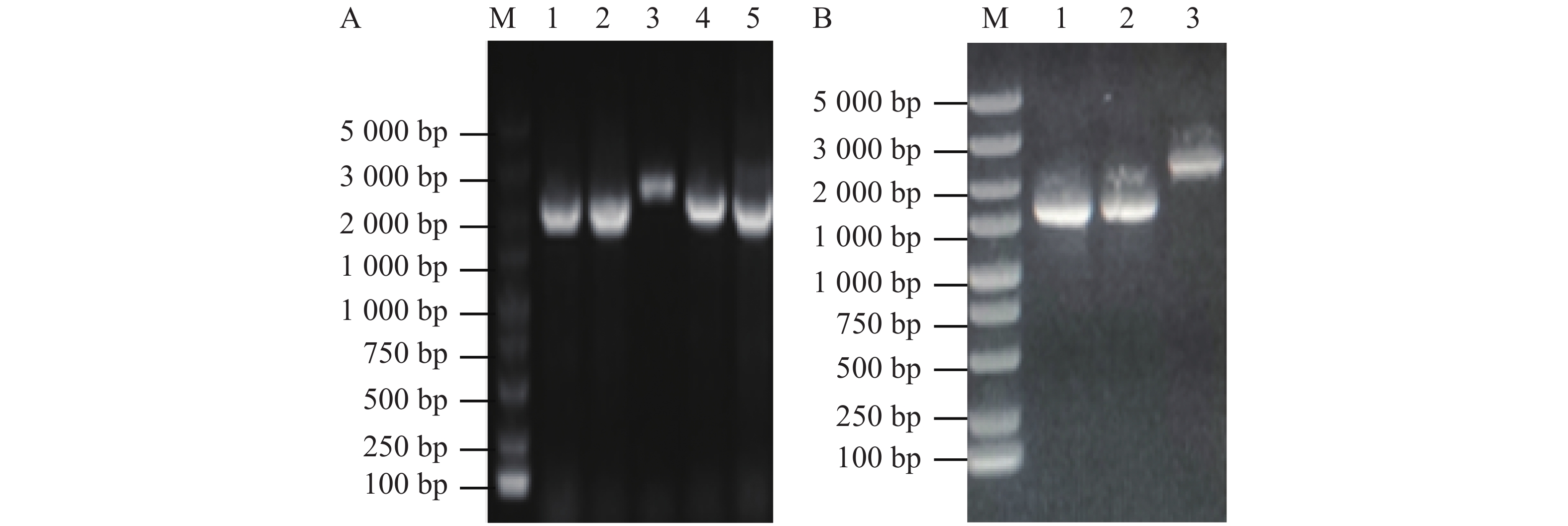
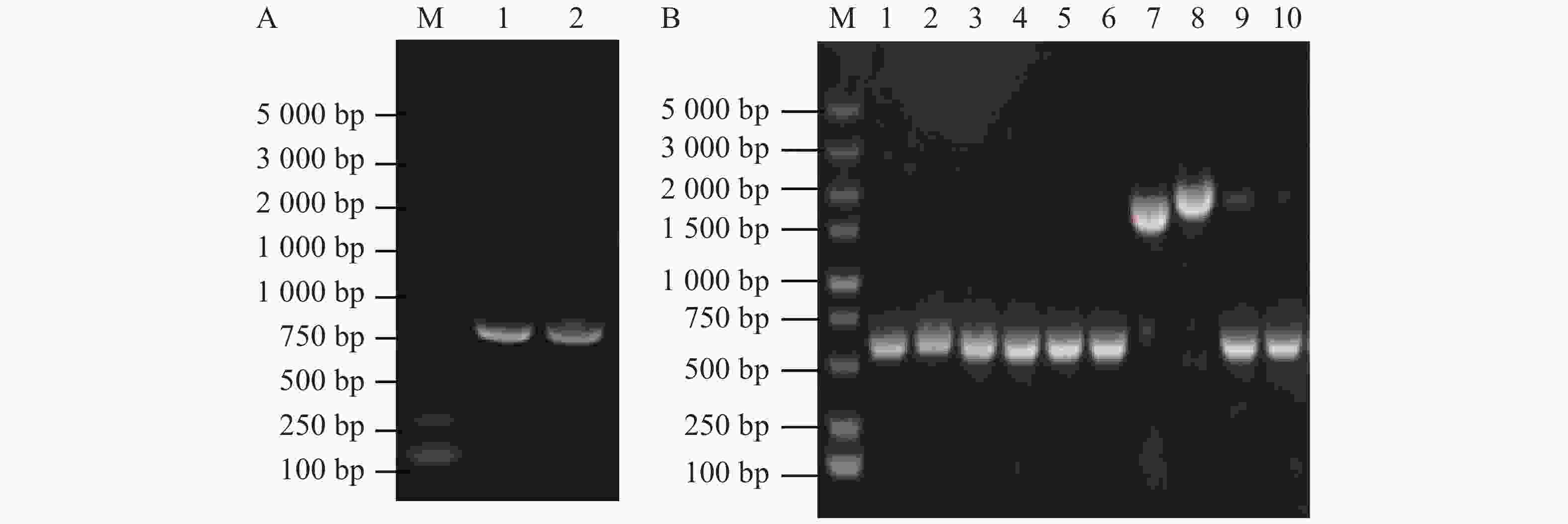
使用维氏气单胞菌C4基因组DNA为模板扩增上下游同源片段,使用1%琼脂糖凝胶电泳检测扩增DNA大小与纯度。由图1-A可知,第1、2泳道分别为flrB基因上游同源臂片段、flrB基因下游同源臂片段,条带单一明亮且大小正确,适合作为模板进行Overlap PCR连接该上下游片段。将提取的pRE112质粒和Overlap PCR连接的flrB基因上下游同源臂片段进行双酶切,纯化回收酶切片段并连接过夜,通过电转至大肠杆菌WM3064中并涂布于氯霉素和二氨基庚二酸平板上进行筛选,使用pRE112载体引物进行验证,以空载pRE112作为阴性对照。从图1-B可知,泳道1~6条带大小与阴性对照一致,说明未成功构建,泳道7、8条带单一且大小位于1 500~2 000 bp之间,大于阴性对照条带,并且该条带符合插入目的片段后应具有的大小,说明7、8为成功连接载体,提取质粒测序进一步验证。测序结果表明,本实验成功构建了pRE112-∆flrB载体。
-
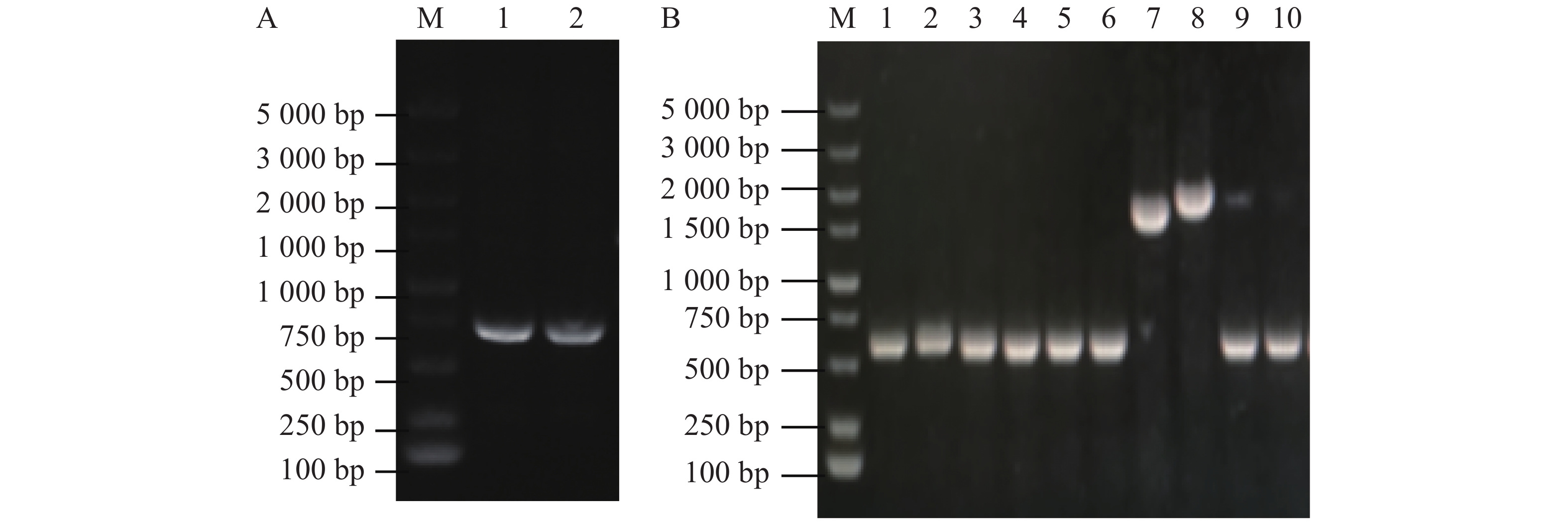
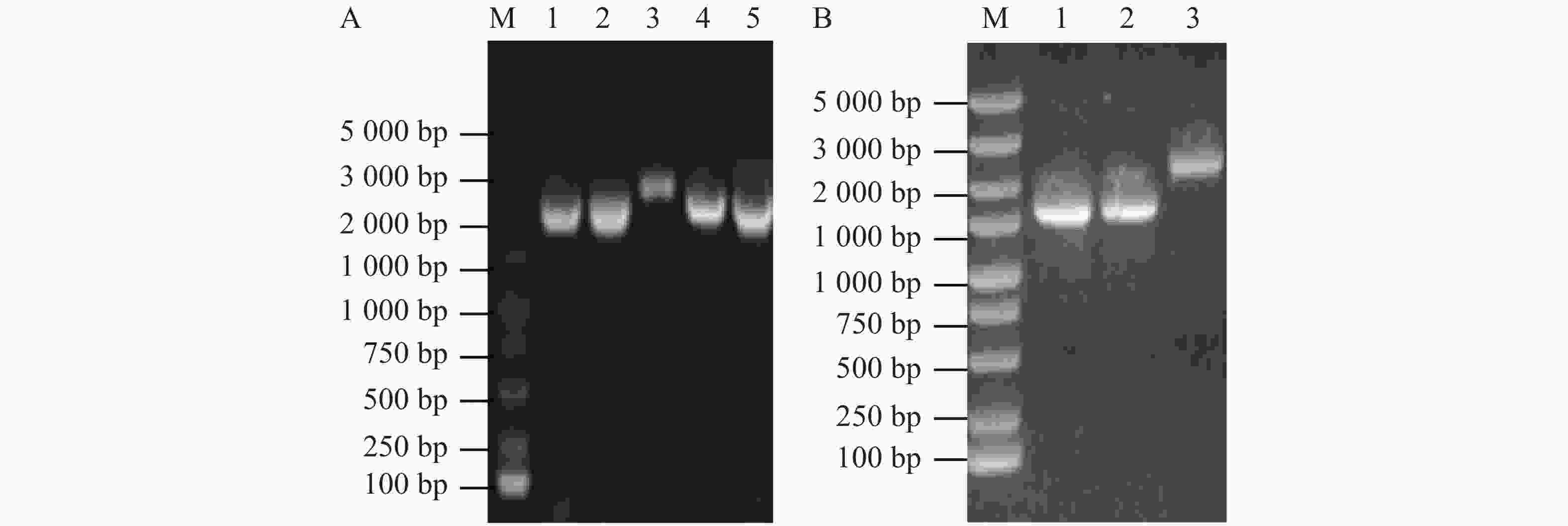
使用接合的方法将大肠杆菌WM3064中的重组pRE112-∆flrB载体传递到维氏气单胞菌中,通过抗性平板筛选并进行PCR验证成功接合菌落。从图2-A可知,泳道1、2、4、5条带大小为2 000 bp,与预期大小一致,表明pRE112-∆flrB载体成功导入野生型维氏气单胞菌中。为筛选发生同源双交换的基因敲除菌株,将成功接合的菌落接种培养并涂布于8%蔗糖平板上筛选,使用PCR验证敲除菌株。从图2-B可知,泳道3为阴性对照,条带大小为2 100 bp,泳道1、2 的PCR条带大小为1 500 bp,减少的片段大小为预期敲除的部分,挑选到2个成功敲除菌株,为验证敲除的准确性,使用F0/R0引物扩增并送生工测序,测序结果表明,这2个菌株为成功敲除菌株。
-
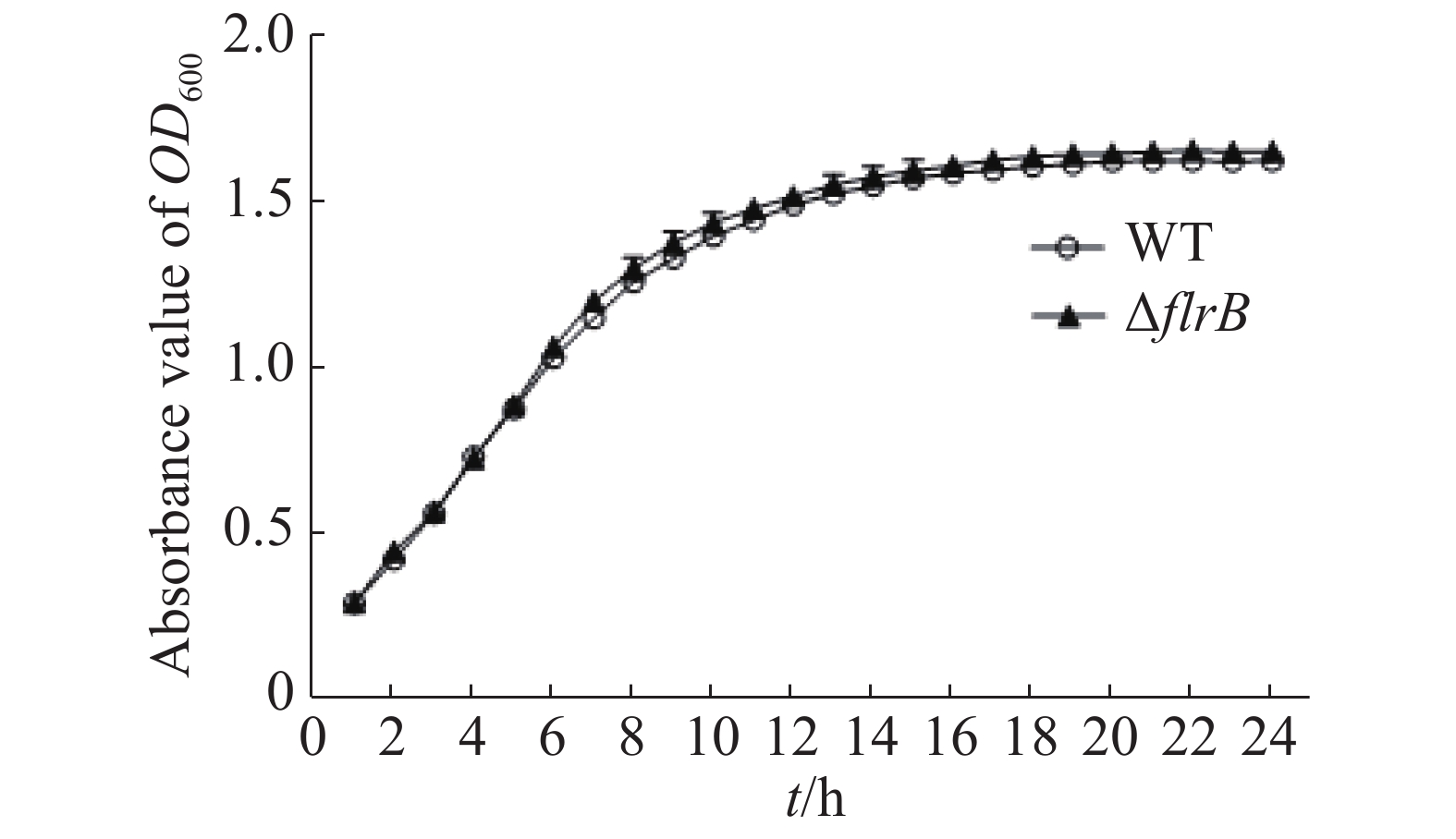
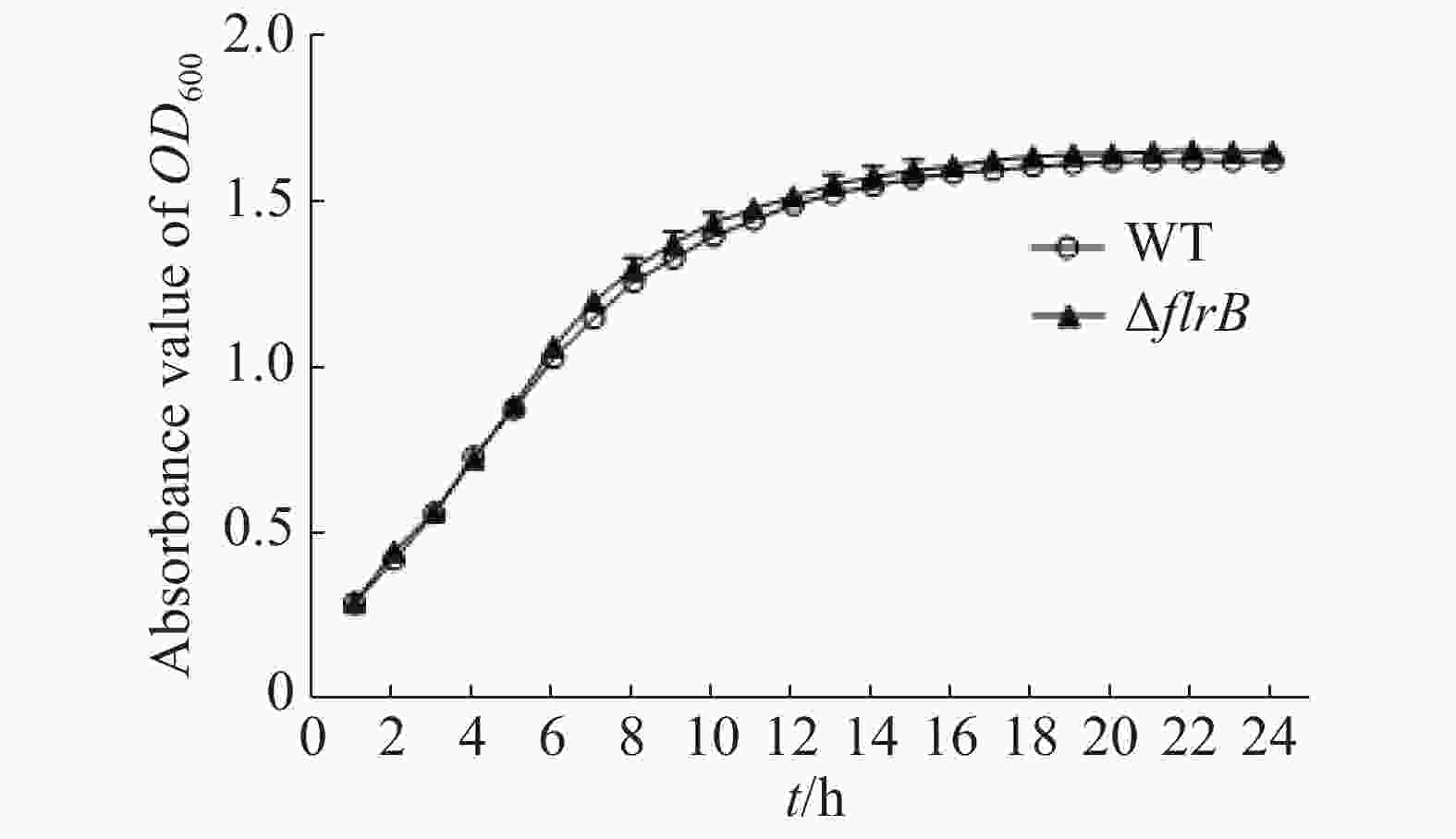
通过测定在LB培养基中野生型和flrB基因敲除菌株的生长曲线来研究flrB基因是否会影响维氏气单胞菌C4的生长。由图3可知,野生型菌株和敲除flrB菌株生长速率一致,说明敲除flrB后对维氏气单胞菌的生长无影响。
-
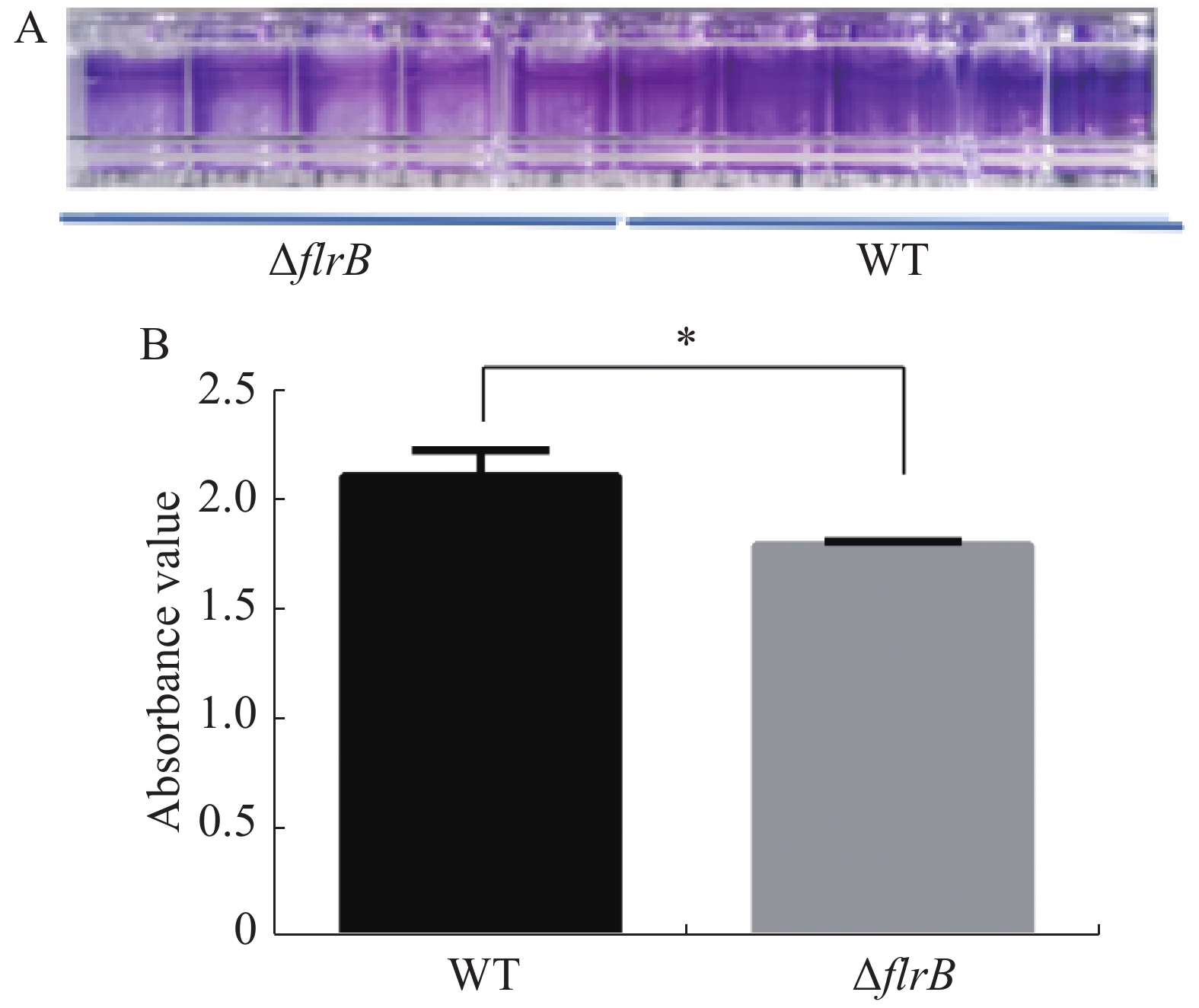
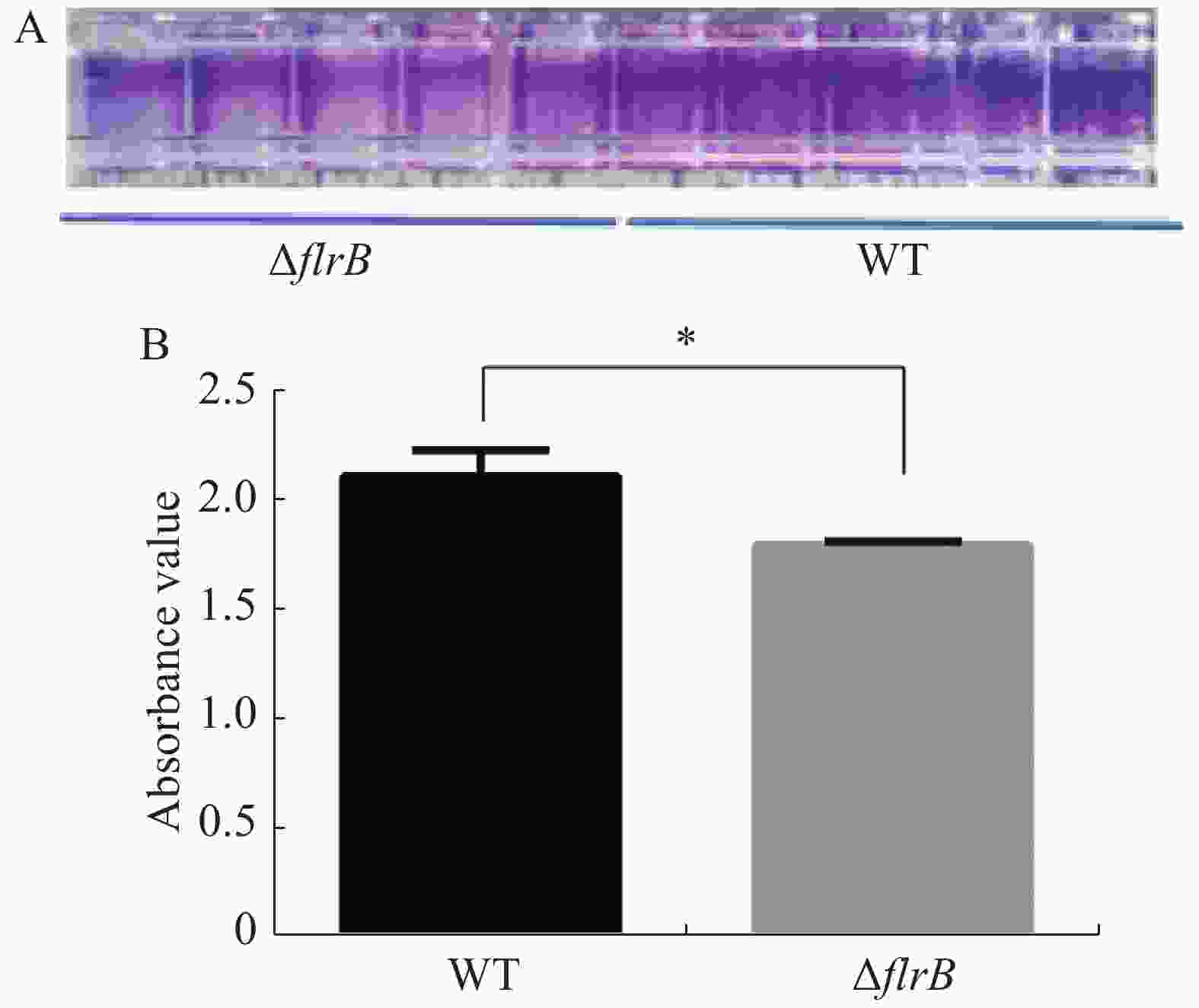
定量接种野生型维氏气单胞菌和flrB敲除菌株并在30 ℃培养箱内培养36 h,吸出菌液使用PBS缓冲液清洗干净,加入结晶紫染色,洗去多余的染料,用33%乙酸进行溶解脱色后,使用酶标仪检测OD595的吸光度值。结晶紫染料可以特异性地染色生物膜,由图4-A可知,敲除flrB后附着在孔壁上的生物膜变少,染色后颜色较浅,而野生型菌株生物膜形成较多,染色较深;使用冰乙酸溶解结晶紫进行定量分析,由图4-B可知,敲除flrB后生物膜形成显著降低。说明敲除flrB后生物膜的形成显著降低,在维氏气单胞菌C4中flrB基因能促进生物膜的形成。
2.1. pRE112-∆flrB载体构建
2.2. 双亲接合及筛选敲除菌株
2.3. 检测flrB基因敲除菌株的生长情况
2.4. 检测flrB基因敲除菌株的生物膜形成
-
维氏气单胞菌是一种广泛存在的人鱼共患致病菌,已对鱼类养殖和人类健康造成了巨大的威胁[15],但目前大多数相关研究仅局限于病原菌的分离,未研究其致病机理,这不利于对病原菌的防治。研究维氏气单胞菌的致病机制将有利于防治病原菌,减少维氏气单胞菌在养殖业上造成的损失。基因敲除是探究生物表型与基因功能的重要方法,通过敲除候选基因观察病原菌的致病性有利于研究发掘潜在致病机制。使用同源双交换进行基因敲除已在革兰氏阴性菌和革兰氏阳性菌中广泛应用,在纳塔葡糖酸蜡杆菌、环己氨降解菌、金黄色葡萄球菌中都已通过同源双交换成功进行基因操作[16-18]。笔者在本研究中采用同源双交换在维氏气单胞菌中进行分子操作,研究靶标基因发挥的生物学功能,进而解析维氏气单胞菌的致病机理。
笔者以维氏气单胞菌中鉴定出的FlrB/FlrC双组分系统为靶标,重点研究flrB基因发挥的功能。FlrB是双组分系统FlrB/FlrC中的传感器激酶,主要功能为感受信号并自磷酸化将磷酸基团传递至同源反应调节器上,从而启动下游一系列基因的表达,进而影响生物学功能。FlrB/FlrC负责调控细菌鞭毛合成的3级基因的转录[19]。flrB的缺失会导致其同源效应调节器不能磷酸化而失去激活下游基因表达的能力,进而影响鞭毛的合成进而影响鞭毛相关的致病表现,如运动性、细胞侵袭、生物膜形成。因此研究flrB基因在维氏气单胞菌的功能对于解析维氏气单胞菌的致病机制具有重要的意义。
本研究还鉴定了维氏气单胞菌中flrB基因对生长和生物膜形成的影响。研究结果表明,敲除flrB基因后并不影响维氏气单胞菌的生长,flrB基因主要调控细菌鞭毛合成,主要影响细菌的运动以及粘附,因此敲除flrB基因不影响生长,该结果与空肠弯曲菌中鞭毛合成系统缺失但不影响生长特性的研究结果一致[20]。敲除flrB基因后生物膜形成显著降低,说明在维氏气单胞菌中flrB具有促进生物膜形成的功能,该结果与溶藻弧菌中flrB基因敲除表型的研究结果一致[13]。本研究可为解析维氏气单胞菌的致病机制提供新的研究思路与作用靶标。






 DownLoad:
DownLoad: