-
维氏气单胞菌(Aeromonas veronii)是一种人鱼共患的革兰阴性病原菌[1],其分布广泛、致病性较强,给水产养殖带来巨大的经济损失[2]。人感染后会出现菌血症、脑膜炎等症状,甚至有死亡的危险[3]。在革兰氏阴性菌中,III型分泌系统(Type III secretion systems, T3SS)通过分泌胞外蛋白和毒力蛋白介导毒力作用的发挥[4],是细菌向宿主细胞分泌毒力因子的重要途径,如铜绿假单胞菌、沙门氏菌及福氏志贺菌对宿主的毒害作用皆由T3SS介导[5]。在急性感染期间,铜绿假单胞菌中T3SS特别活跃,感染者的死亡率增加[6-7]。T3SS在细菌病原体中十分保守,其表达由exoenzyme S transcriptional regulator ExsA激活[8]。在副溶血性弧菌(Vibrio parahaemolyticus)中,HlyU正调控exsA基因启动子,激活T3SS的表达[9];在铜绿假单胞菌中,ExsA可调控细胞外金属蛋白酶ImpA的表达,后者通过T3SS分泌到宿主体内后,可以裂解巨噬细胞表面蛋白CD44,以抑制巨噬细胞对细菌细胞的吞噬作用[10]。免疫球蛋白M(IgM)是一种普遍存在于脊椎动物中,由效应B淋巴细胞特异性分泌的免疫球蛋白[11-12]。根据Ig重链(heavy chain, H)恒定区的差异,硬骨鱼类被划分为IgM、IgD、IgZ/T、IgM和IgZ[13]等类型。在硬骨鱼中,IgM较其他类型的免疫球蛋白在含量上占绝对优势[14-15],检测IgM成为判断特异性免疫形成的标志之一。
疫苗主要分为传统疫苗和基因工程疫苗。传统疫苗分为灭活疫苗和减毒活疫苗(live attenuated vaccine, LAV),基因工程疫苗分为DNA疫苗、重组亚单位疫苗及活载体疫苗[16]。传统疫苗制备简易、成本较低、免疫效果优异,是市场主流。灭活疫苗较减毒活疫苗更加安全,且便于保存;减毒活疫苗接种量更小,但免疫持续时间长,也有一定的开发优势。常规灭活疫苗虽然激发了显著的抗体水平,但因为抗体不能有效进入感染细胞杀灭病原菌,无法提供有效保护;而减毒活疫苗进入宿主体内后,到达靶器官的方式与自然感染途径类似,且持续表达抗原,能有效刺激宿主细胞免疫应答,提高宿主清除感染细胞的能力,是该菌疫苗发展的重要方向[17]。
尼罗罗非鱼(Oreochromis niloticus)是重要的经济养殖鱼类,海南是我国主要的罗非鱼养殖地,曾发生过以维氏气单胞菌为主要病原菌的爆发疾病案例[18]。目前针对维氏气单胞菌的疫苗相对空白,并且现有的嗜水气单胞菌疫苗和杀鲑气单胞菌疫苗对维氏气单胞菌的免疫效果不佳,制备维氏气单胞菌特异性疫苗迫在眉睫。为了展开针对维氏气单胞菌疫苗的研发,本实验构建了维氏气单胞菌ΔexsA1敲除株,检测了其毒力表达与免疫原性,为维氏气单胞菌疫苗的制备奠定实验基础。
HTML
-
维氏气单胞菌野生株及ΔexsA1敲除株、大肠杆菌WM3064,具体见表1。
菌株或质粒 Strain or plasmid 基因型或表型 Genotype or phenotype 来源 Source 维氏气单胞菌野生株 野生型,分离自发病鱼体 实验室保存 维氏气单胞菌 ΔexsA1敲除株 exsA1基因缺失菌株 本研究构建 大肠杆菌WM3064 野生型,用于感受态制备 实验室保存 质粒Plasmid 自杀质粒pRE112 穿梭质粒,含sacB基因,氯霉素(Cm)抗性 实验室保存 Table 1. Bacterial strains and plasmids used for test
-
尼罗罗非鱼(Oreochromis niloticus)鱼苗购自海南宝路水产科技有限公司文笔峰养殖基地,养殖至实验用大小,规格为(10±1)g和(50±1)g。
-
限制性核酸内切酶及其Buffer缓冲液购自NEB公司;T4 DNA Ligase及其Buffer缓冲液购自Monad公司; Rapid Taq Master Mix (2×)、Phanta Max Master Mix、FastPure Gel DNA Extraction Mini Kit、FastPure Gel DNA Extraction Mini Kit等皆购自Vazyme公司;罗非鱼免疫球蛋白M(IgM)酶联免疫分析试剂盒测定购自江苏酶免实业有限公司。培养基(酵母提取粉、胰蛋白胨、琼脂糖、琼脂粉)购自Oxoid公司;二氨基庚二酸(Dap)购自Sigma公司;氯霉素购自北京索莱宝科技有限公司;各种无机盐等购自西陇科学股份有限公司;氨苄青霉素(Amp)购自上海源叶生物科技有限公司。
-
分析exsA1基因及其上下游基因,选择上下游同源臂并设计其敲除扩增引物exsA1-F1/R1、exsA1-F2/R2和敲除验证引物exsA1-F0/R0;在敲除扩增引物中添加内切酶BstXI酶切位点,并在该位点中间添加限制性内切酶KpnI和SacI的识别序列,两同源臂之间添加EcoR I的酶切位点(表2)。提取维氏气单胞菌基因组,用敲除引物扩增上下游同源臂并纯化回收。将上下游同源臂片段用BstXI和EcoR I酶切,pRE112质粒用KpnI和SacI酶切,并连接得到重组质粒,再将连接产物电转进入大肠杆菌WM3064感受态细胞中复苏培养,菌落PCR验证,筛选出阳性菌株。将筛选到的阳性菌株和维氏气单胞菌野生株分别培养至对数期,再按照(1∶2)、(1∶3)和(3∶1)的比例混合为1 mL,6 000 r·min−1离心3 min后,留30 μL菌液滴入无抗的Dap的LB平板上,30 ℃培养30 h,将重组质粒利用双亲接合的方式转入维氏气单胞菌野生株中。取50 μL接合后,将菌液涂布于50 μg·mL−1氨苄青霉素、50 μg·mL−1氯霉素的LB平板上,30 ℃培养过夜。菌落PCR验证是否是维氏气单胞菌、是否有重组质粒。将阳性菌株通过8%蔗糖筛选,挑取筛选后的单菌落,使用敲除验证引物exsA1-F0/R0菌落PCR验证,对得到的阳性菌株用敲除引物进行PCR扩增,对产物进行了切胶回收后送样测序。
引物名称 Primer 引物序列 Primer sequences A.veronii C4-F ATGGTCGCAGAGCTTGTC A.veronii C4-R CAGCACAATAGAACACCAGAC exsA1-F1 CTGCAGAACCAGGTACCTGGCACACCATTAAGTCTGAGTC exsA1-R1 CTGCAGAACCAGAATTCTGGGAATCTGCGTGTAGTACCAG exsA1-F2 CTGCAGAACCAGAATTCTGGCCAGGTCGAGCGGTTGCAAC exsA1-R2 CTGCAGAACCAGAGCTCTGGCTGTGCCGTGTCGGGCACGG exsA1-F0 CTGCTTGTGACTGTTGTAGG exsA1-R0 GCTATGCCTTGCTCATCTTG pRE112-F ACATAGCCCCACTGTTCGT pRE112-R TTTTCGTCTCAGCCAATCC Table 2. Nucleotide sequences of primers used for construction of deletion mutants
-
分别挑取维氏气单胞菌野生株和ΔexsA1敲除株单菌落,置于含有5 mL LB液体培养基的试管中,30 ℃、200 r·min−1过夜培养。紫外分光光度计中测定其OD600值,然后将各菌株菌液稀释至106 CFU·mL−1,分别吸取100 μL稀释液于96孔板相应位置,无菌新鲜的LB液体培养基作为对照。将96孔板置于多功能酶标仪中,设置程序:温度恒定30 ℃,持续振板,共测定36 h,每30 min测定1次OD600值。
-
将维氏气单胞菌野生株和ΔexsA1敲除株单菌落接种于5 mL LB液体培养基中,30 ℃、200 r·min−1过夜培养,紫外分光光度计中测定其OD600值后,取OD600=1的菌液,6 000 r·min−1离心3 min后去上清,用无菌的0.9%生理盐水重悬,定容至2×108 CFU·mL−1,即为感染液。感染方法:将罗非鱼养殖到(10±1)g后,每组平均分20条。接种感染液,按照10 μL·g−1体质量的注射量对罗非鱼进行腹腔注射攻毒。持续观察1周,统计各组每天的死亡数。
-
选取长势和大小相近(50±1)g的罗非鱼,平均分为3组,即空白对照组、野生株感染组和ΔexsA1敲除株感染组,并适应性饲养1周。将维氏气单胞菌野生株和ΔexsA1敲除株单菌落接种于LB液体培养基过夜培养后,配置成上述感染液并稀释10倍,得2×107 CFU·mL−1菌液。对罗非鱼进行腹腔注射攻毒实验,无菌0.9%生理盐水为对照。9天后再次攻毒同一组罗非鱼,分别在攻毒后第2天、第4天和第6天抽取罗非鱼血液。将血液室温静置30 min,2 000 r·min−1离心20min,吸取上清(罗非鱼血清)装入干净1.5 mL EP管中,−20 ℃保存备用。采用罗非鱼免疫球蛋白M(IgM)酶联免疫分析试剂盒测定罗非鱼血清中IgM含量。试剂盒应用双抗原夹心法测定标本中IgM水平。固相抗原先与IgM结合,再与HRP标记的抗原结合,形成抗原−抗体−酶标抗原复合物,最后加底物TMB显色。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中IgM浓度。
-
将罗非鱼养殖到(10±1)g后,分为攻毒对照组、减毒株接种组和接种对照组,每组40条。培养维氏气单胞菌ΔexsA1敲除株,配置成浓度为2×107 CFU·mL−1的注射液。按照10 μL·g−1体质量的注射量对罗非鱼进行腹腔注射,接种对照组注射无菌0.9%生理盐水。9 d后重复上述接种步骤。2次免疫注射结束后,用2×109 CFU·mL−1的野生菌株攻毒减毒株接种组和接种对照组,同等接种量的无菌生理盐水接种攻毒对照组,记录各组罗非鱼每天的死亡个数,计算累计死亡率。
1.1. 菌株、质粒
1.2. 实验动物
1.3. 主要试剂
1.4. 维氏气单胞菌ΔexsA1基因敲除株的构建
1.5. 细菌生长曲线测定
1.6. 罗非鱼的感染
1.7. 血清IgM含量检测
1.8. 减毒株对罗非鱼的免疫保护率测定
-
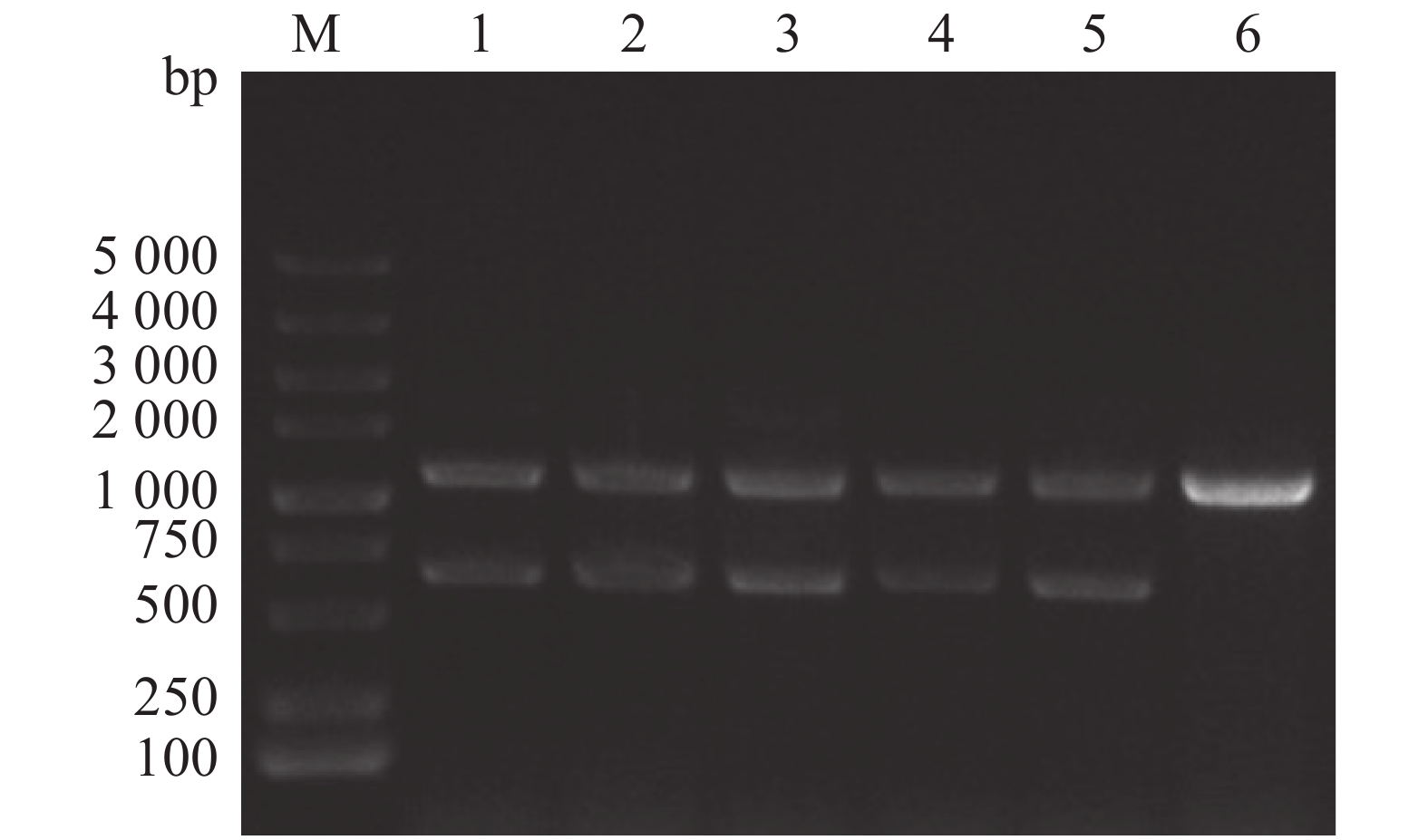
通过同源双交换法,设计特异性引物、重组载体构建以及细菌接合和筛选,成功构建维氏气单胞菌exsA1敲除株,使用敲除验证引物exsA-F0/R0进行对敲除菌株进行PCR验证(图1),由图1可见,野生菌株使用exsA-F0/R0引物进行克隆时,PCR产物大小为1 100 bp;由于在维菌中存在2个拷贝的exsA, ΔexsA1缺失突变体的PCR产物除了有600 bp的exsA1缺失片段外,还有1 100 bp的野生型克隆产物。将敲除片段切胶回收后,送样品至生工生物工程(上海)股份有限公司进行测序,测序结果显示exsA1已成功缺失。因此,将该菌株命名为维氏气单胞菌ΔexsA1敲除菌株。
-
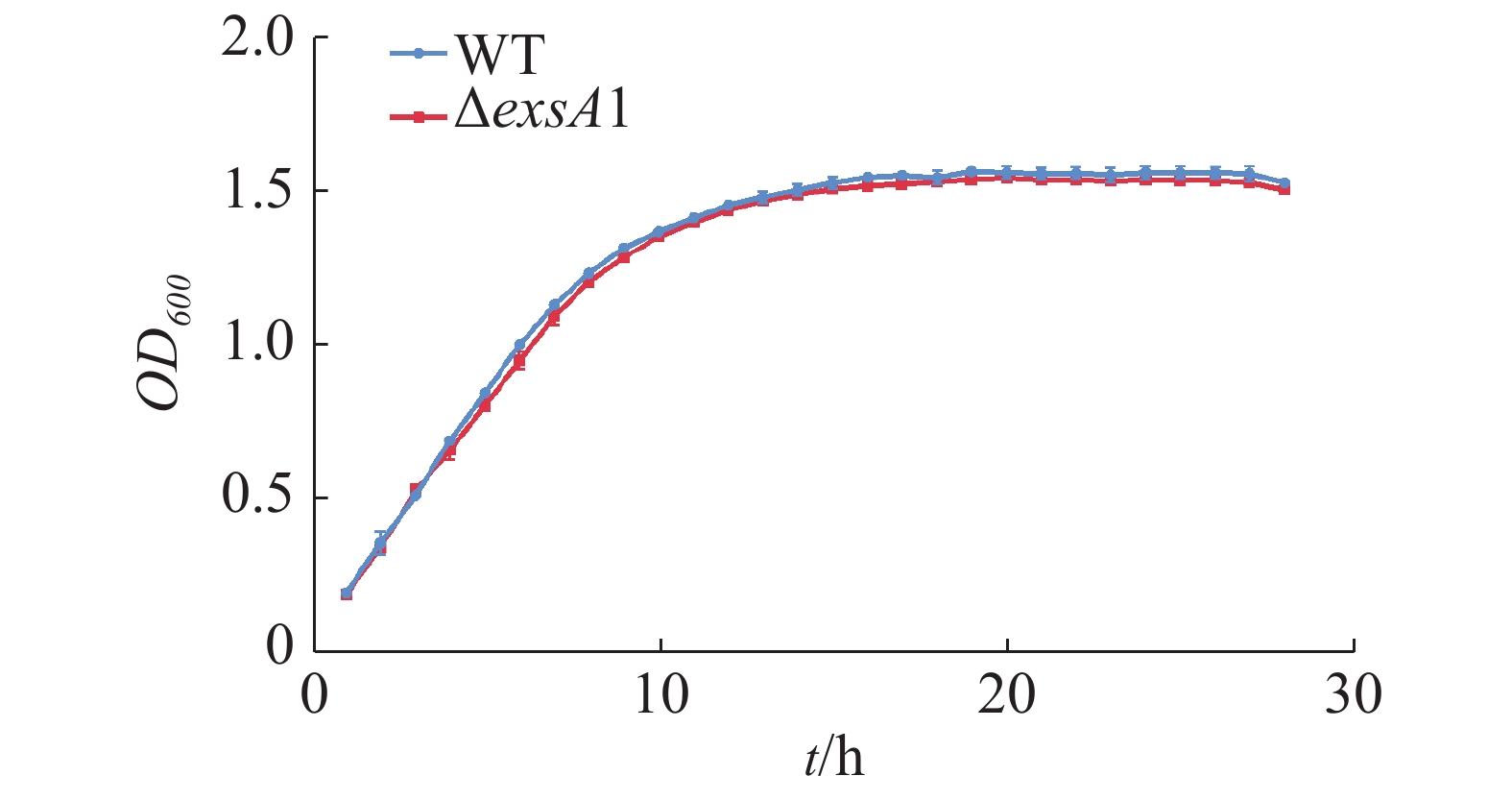
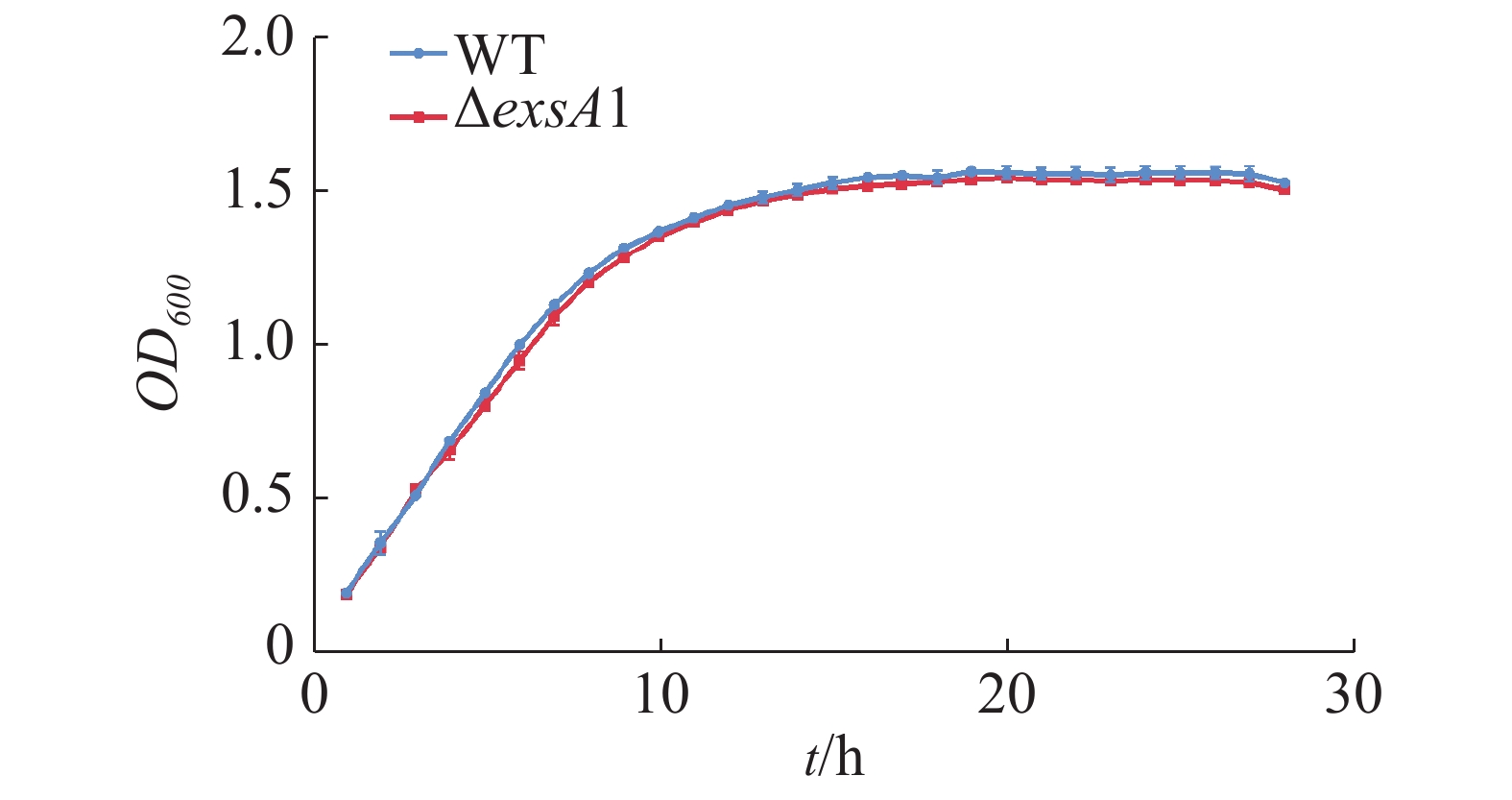
测定维氏气单胞菌C4野生株和ΔexsA1敲除株丰富培养下的生长曲线并作图(图2),由图2可见,在LB液体培养基中,维氏气单胞菌ΔexsA1敲除株与C4野生株在潜伏期时无差异,在对数期和稳定期敲除株的生长量略微低于野生株,但整体相比生长速度不存在显著差异。这说明exsA1基因对维氏气单胞菌的生长没有明显影响。
-
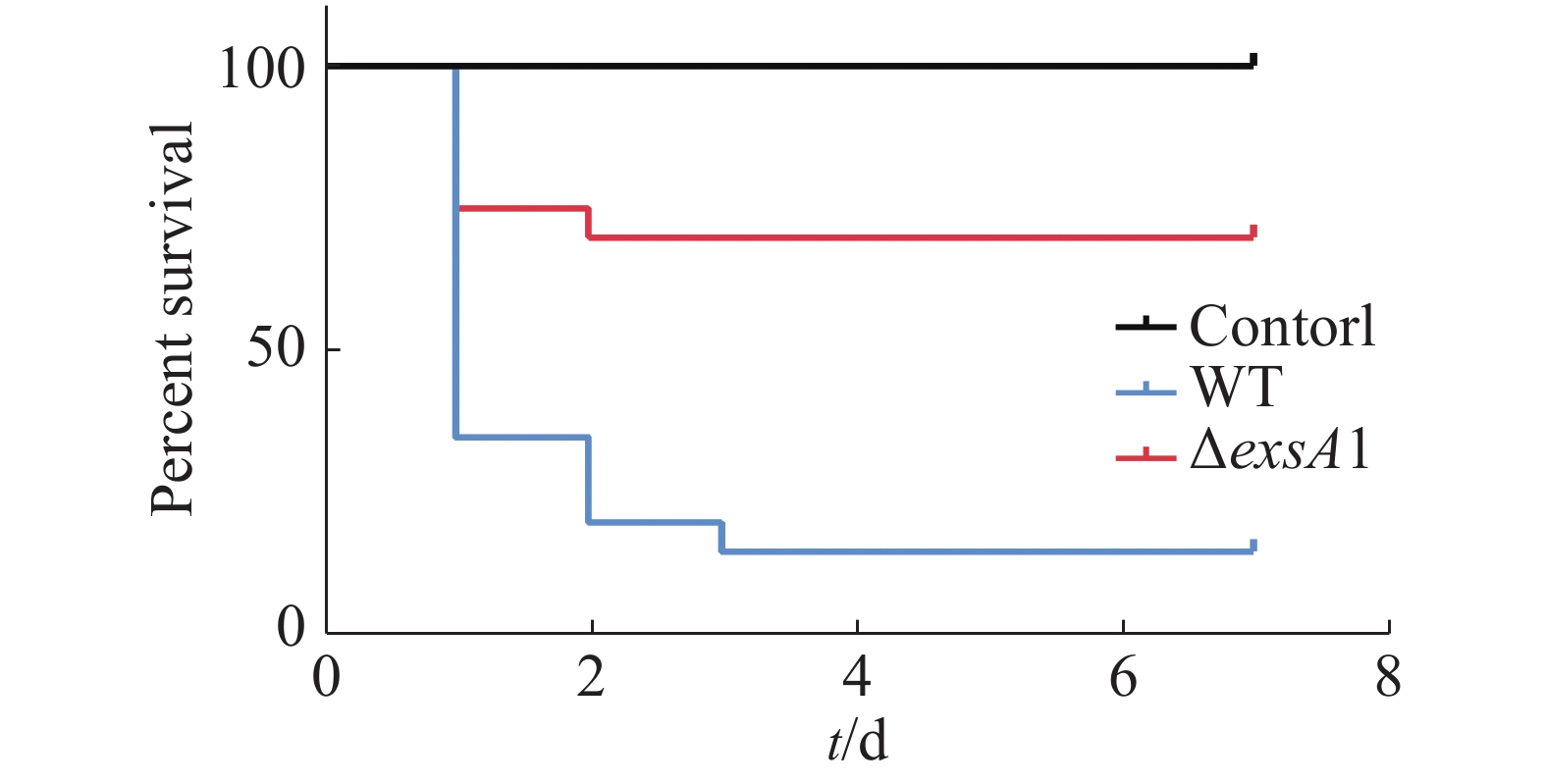
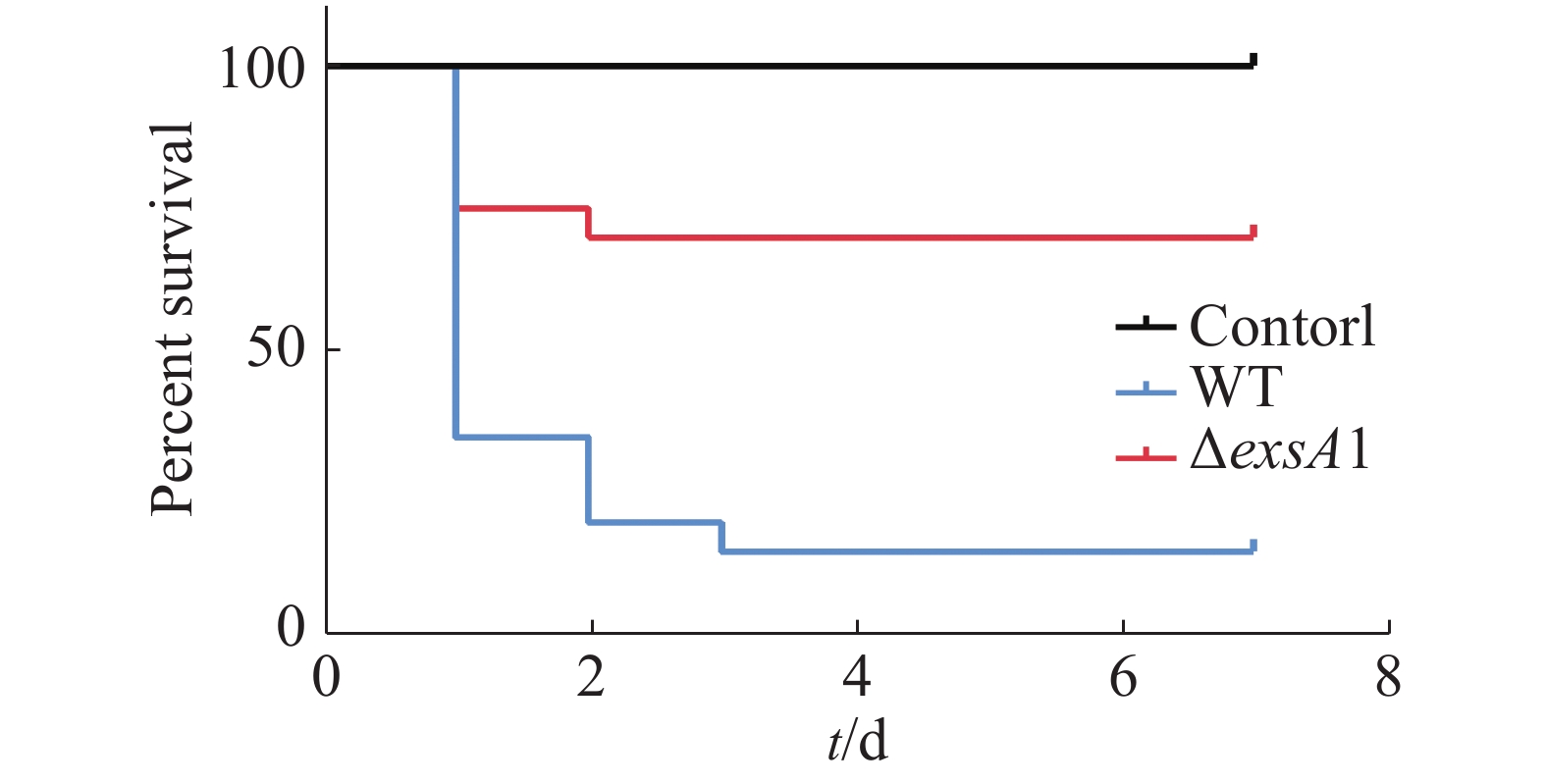
采用腹腔注射的方法对罗非鱼进行攻毒,统计结果见图3。由图3可知,ΔexsA1敲除株的感染能力相对于野生株的感染能力更弱。敲除株感染后罗非鱼在第1天的死亡率为25%,7天内的死亡率为30%;而野生株感染后罗非鱼的第1天时,死亡率就已达到65%,而第3天的死亡率达到85%;空白对照组在观察期内未出现死亡情况。这说明exsA1基因敲除后,维氏气单胞菌的毒力减弱了,即为维氏气单胞菌ΔexsA1减毒株。
-
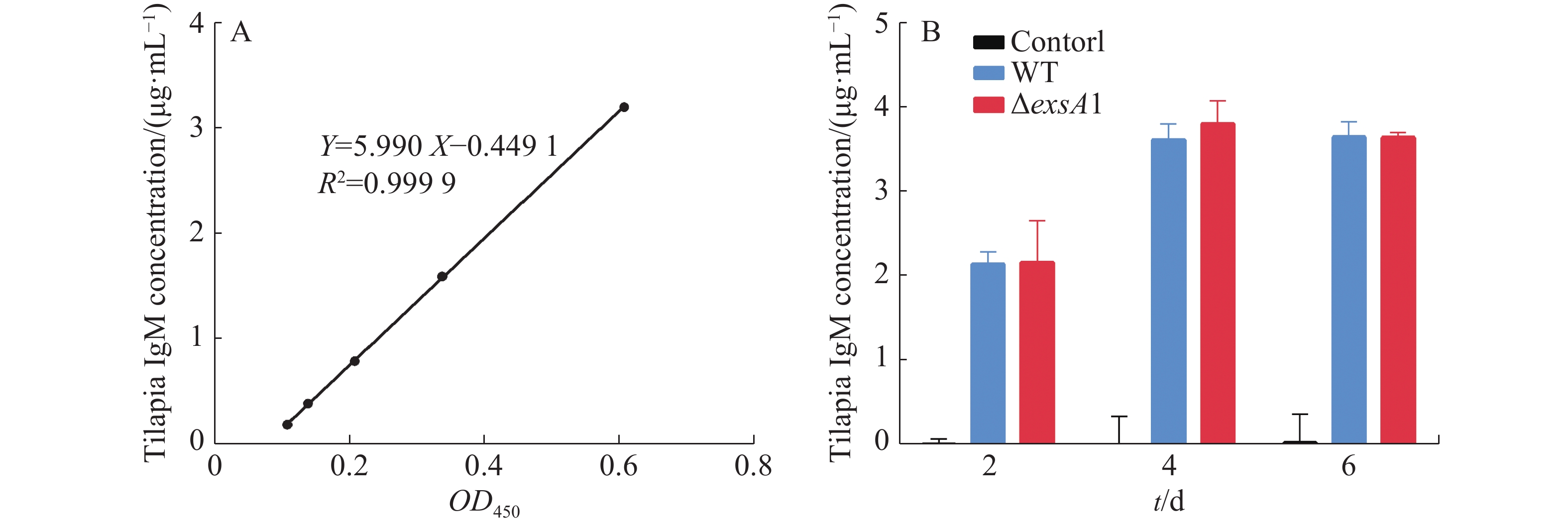
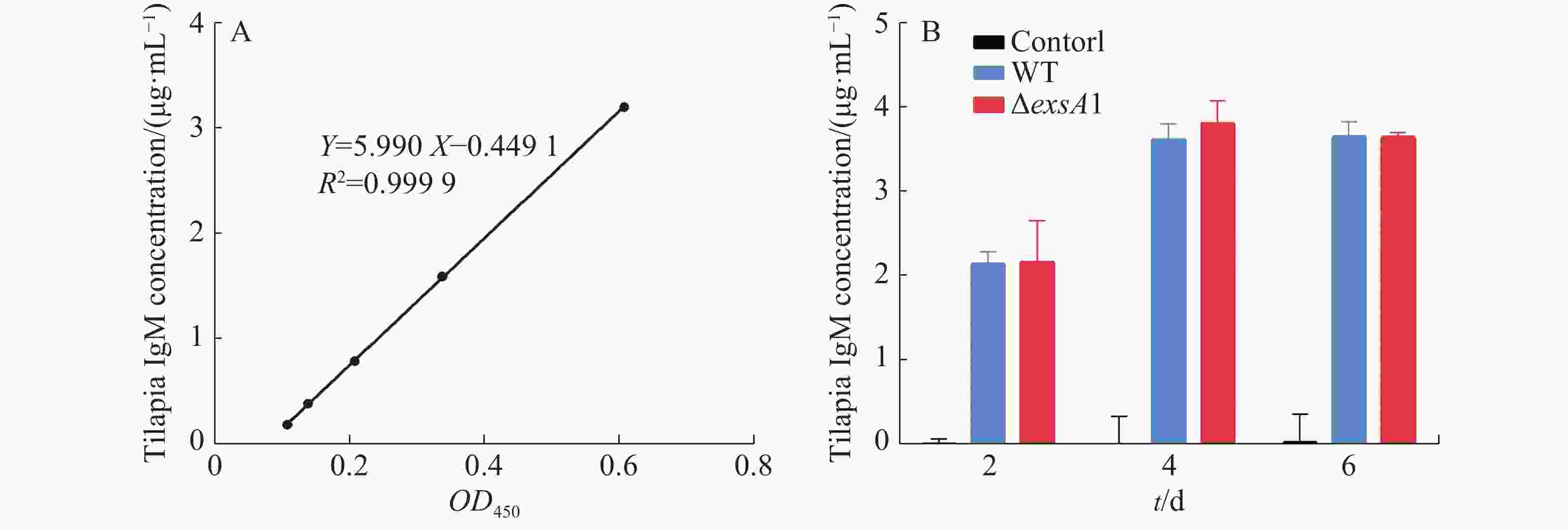
采用非致死剂量的维氏气单胞菌ΔexsA1减毒株,对罗非鱼进行腹腔注射,以验证ΔexsA1减毒株对罗非鱼的免疫原性。罗非鱼IgM的标准曲线见图4-A,结果表明,接种ΔexsA1减毒株后,罗非鱼体内的IgM得到累积。第4天时,IgM的浓度达到3.81 μg·mL−1,与野生株感染组的IgM累积量没有显著差异(图4-B)。上述结果表明,维氏气单胞菌ΔexsA1减毒株可以在不致死的情况下,诱导尼罗罗非鱼产生与野生型相同水平的免疫反应,具有免疫原性。
-
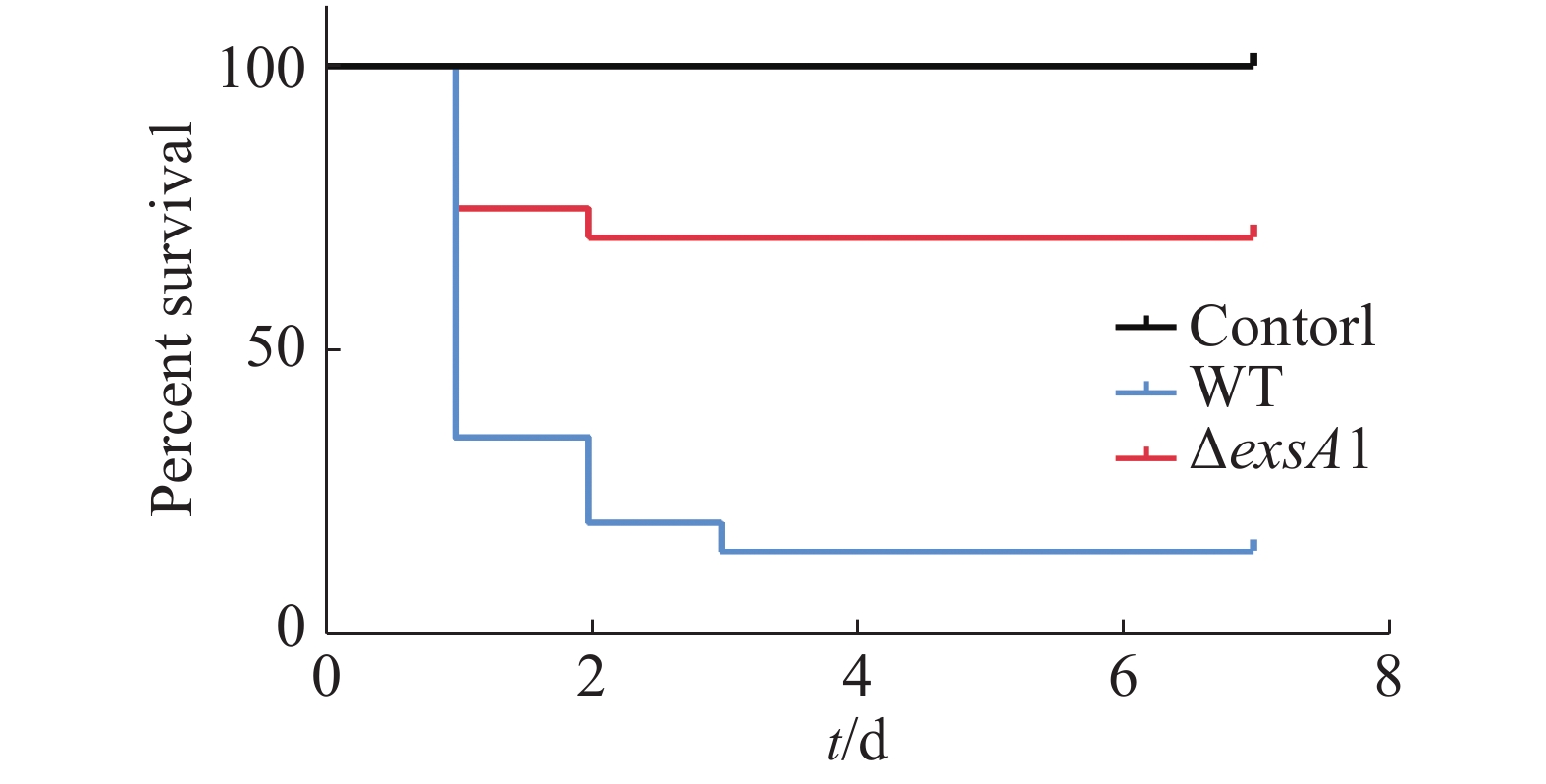
第2次接种疫苗的9 d后,用高浓度的维氏气单胞菌野生型菌株(2×109 CFU·mL−1)攻毒,测定其对罗非鱼鱼苗的免疫保护能力,以验证维氏气单胞菌ΔexsA1减毒株对罗非鱼的免疫保护效应。结果(图5)表明,对照组在攻毒后第1天的死亡率高达95%,并且在第2天全部死亡;减毒株接种组第4天的死亡率为30%,整体下降了70%。这说明ΔexsA1减毒株有开发成疫苗的潜力。
2.1. 维氏气单胞菌ΔexsA1敲除株的构建
2.2. 维氏气单胞菌野生株和ΔexsA1敲除株生长曲线
2.3. exsA1基因影响维氏气单胞菌毒力
2.4. 罗非鱼接种维氏气单胞菌ΔexsA1减毒株后的IgM检测
2.5. 减毒株对罗非鱼的免疫保护率测定
-
气单胞菌(Aeromonas)是革兰氏阴性菌,是人、鱼、兽共患病原菌,其广泛存在于包括海水在内的各种水域环境甚至土壤环境中[19],给国内渔业生产造成了巨大的经济损失。维氏气单胞菌引起淡水渔类的病例在逐年增加[20],但是一直没有得到足够的重视。
随着人们物质生活水平的不断提高,对优质水产品的需求量快速增长,导致渔业规模迅速扩大,水产品产量得到迅速增加。不少养殖户为了追求经济利益,增加水产品的放养密度,导致养殖水质恶化,造成水体的严重污染,水产养殖病害大量爆发,对水产养殖产生了巨大的影响[21]。防治水产病害的方法主要是生态防治、药物防治以及疫苗防治[22]。其中,生态防治对养殖环境要求很高,这会提高水产养殖的成本,我国目前的养殖环境还难以达到。药物防治多以使用抗生素,初期效果十分显著,长期使用会导致出现多重耐药的水产病原菌,使得药效越来越差,水产病害越来越难以治疗。我国获得商品化生产的鱼用疫苗也已有7种,但是我国水产养殖区域广,而且水产病害种类繁多,这些疫苗对不同病原菌的防治效果不一,水产疫苗的种类是远远不够的,所以针对各种水产病原菌的疫苗研发非常重要,尤其维氏气单胞菌疫苗的研发更是如此。
本研究用同源重组双交换的方法,构建维氏气单胞菌ΔexsA1敲除型菌株,并测定其生长曲线,发现exsA1基因不会影响维氏气单胞菌的生长。罗非鱼腹腔注射感染实验,证实ΔexsA1敲除株的毒力确实下降。罗非鱼攻毒后IgM浓度检测,证明维氏气单胞菌exsA1减毒株可以在非致死情况下引发罗非鱼的免疫反应,并在体内产生较高浓度的特异性免疫因子IgM的累积。在高浓度野生株感染下,ΔexsA1减毒株对罗非鱼的免疫保护率能达到70%,结果表明,ΔexsA1减毒株具有制备成疫苗的潜力。
一直以来,对维氏气单胞菌感染的水产病害没有有效的治疗手段,面对这种多重耐药的菌种,制备有效的疫苗刻不容缓。本研究成功构建了具有良好宿主免疫原性的ΔexsA1减毒株,为制备维氏气单胞菌减毒活疫苗提供了可行的实践依据。








 DownLoad:
DownLoad: