-
荧光原位杂交技术(fluorescence in situ hybridization,FISH)作为一种分子细胞遗传学工具,在植物染色体倍性和基数的研究中发挥了重要的作用。大薯(Dioscorea alata L.)又名参薯、脚板薯、菜山药,为薯蓣属单子叶藤本植物,以块茎无性繁殖为主。大薯是薯蓣属中世界范围特别是热带地区分布最广的物种,在我国长江以南地区均有种植。大薯在非洲一些国家是仅次于木薯的主粮[1],具有调节胃肠道、抗衰老、增强免疫力、抗肿瘤、降血糖、降血脂和改善老年性痴呆等功效[2-5]。然而,由于大薯染色体小而多,且形态多呈粒形,难以通过有丝分裂细胞进行核型分析;加之少开花、雄花小、花药剥离困难、难以通过减数分裂观察染色体的联会,导致国内外目前对大薯染色体基数和倍性存在较大争议,这严重制约了其遗传背景研究和基因组的深度分析[6-8]。染色体制片是荧光原位杂交技术成功应用的前提和保障。一般而言,植物的根尖和茎尖比嫩叶更容易制备出高质量的染色体标本。目前,国内外关于大薯及其近缘种染色体制备均以根尖和茎尖为材料[6, 9-12],尚未见利用其嫩叶进行染色体制备的相关研究。由于大薯的生育期为8个月以上,块茎收获后有3~4个月的休眠期,发根时间仅有1~2 个月,通过获取根尖进行染色体标本制备存在时间局限性;茎尖的生长期较长,但茎尖的数量有限,而且大薯茎尖通常含有较多的粘液且不同材料的茎尖粘液含量不同,这增加了细胞解离的难度。大薯叶片生长期长、数量多、取材方便且对植株的伤害较小,因此利用大薯叶片制备染色体标本便显得十分必要。目前,有许多植物已经开展了适于荧光原位杂交的染色体制片技术的研究,如橡胶[13]、杨树[14]、大白菜[15]等,而未见在大薯中应用。本研究拟通过建立大薯叶片染色体制备技术,然后以 45S rDNA 部分序列为探针对其进行荧光原位杂交检测,旨在通过该技术体系的建立为大薯乃至薯蓣属植物分子细胞遗传学研究提供一种简便且实用的细胞学方法。
HTML
-
实验材料为大薯 Da40 的幼叶,取自海南大学薯蓣种质资源圃。
-
染色体标本制备采用酶解去壁低渗法,步骤参照高和琼等[16]报道的方法,稍加改进:(1)取材和预处理:选择天气晴朗的上午8∶30−9∶30 分别采集大薯未展开、刚展开、展开后1周的嫩叶,采用表1方法进行预处理实验。(2)酶解:用终浓度为 3.5% 纤维素酶(Cellulase “Onozuka” R−10,购自 Japan Yakult 公司)和1.75% 果胶酶(Pectinase from Aspergillus niger,购自 Sigma 公司)混合液,37 ℃ 分别酶解0.5,1.0,1.5 h。(3)涂片:将嫩叶小心地平摊在滴有 1 滴固定液的载玻片上,用解剖针在叶边缘刮取少许组织,弃叶片,将残留在玻片上的组织捣碎并均匀涂抹于涂有多聚赖氨酸的载玻片上,酒精灯火焰迅速烘烤后于空气中晾干待用。(4)镜检:经吉姆萨染液染色后用普通光学显微镜进行镜检,在20X物镜下对单位视野面积内处于分裂中期的细胞和全部细胞分别计数,计算分裂中期细胞的比例,每类嫩叶3个重复。
编号Code 预处理药剂Pretreatment reagent 预处理温度/℃ Pretreatment temperature 预处理时间/h Pretreatment time 1 饱和对二氯苯溶液 4 1 2 饱和对二氯苯溶液 4 2 3 饱和对二氯苯溶液 4 3 4 0.002 mol·L−1 8−羟基喹啉溶液 4 1 5 0.002 mol·L−1 8−羟基喹啉溶液 4 2 6 0.002 mol·L−1 8−羟基喹啉溶液 4 3 Table 1. Different pretreatment methods on chromosome preparation
-
45S rDNA 探针的制备、染色体制片的预处理及杂交液配制参考李杨[17]报道的方法。杂交后染色体制片的漂洗、杂交信号的检测参考唐冰霞等[18]报道的方法,略做改进:(1)杂交后染色体制片的漂洗:37 ℃下,孵育后的制片依次置于2×SSC、10%去离子甲酰胺、1×PBS 中各浸泡 10 min,风干待用。(2)杂交信号的放大:依次用25 mg·L−1鼠抗地高辛−Alexa Fluor 488 暗室孵育 1 h,25 mg·L−1 兔抗鼠−Alexa Fluor 488 暗室孵育1 h,25 mg·L−1 鼠抗兔−Alexa Fluor 488 暗室孵育0.5 h。每次孵育完成后用1×PBS 浸泡3次,每次10 min。(3) DAPI染色:加入适量2 mg·L−1 的 DAPI,盖上盖玻片,指甲油封片,黑暗中染色0.5 h。
1.1. 材料
1.2. 染色体制备
1.3. 荧光原位杂交
-
由表2 可知,幼嫩程度对叶片分裂中期细胞比例有较大影响。其中刚展开叶片分裂中期细胞所占比例最大,为 2.88%,且与其他类型叶片相比有较大差异,染色体制备效果最好。其次是展开后一周叶片和未展开叶片,但这两类叶片中期细胞的比例差异并不显著。
叶片幼嫩程度
Leaf age中期细胞所占比例/%
Ratio of metaphase cells未展叶 1.77 刚展叶 2.88 展叶后一周 1.84 Table 2. Effect of leaves at different leaf ages on the ratio of metaphase cells
-
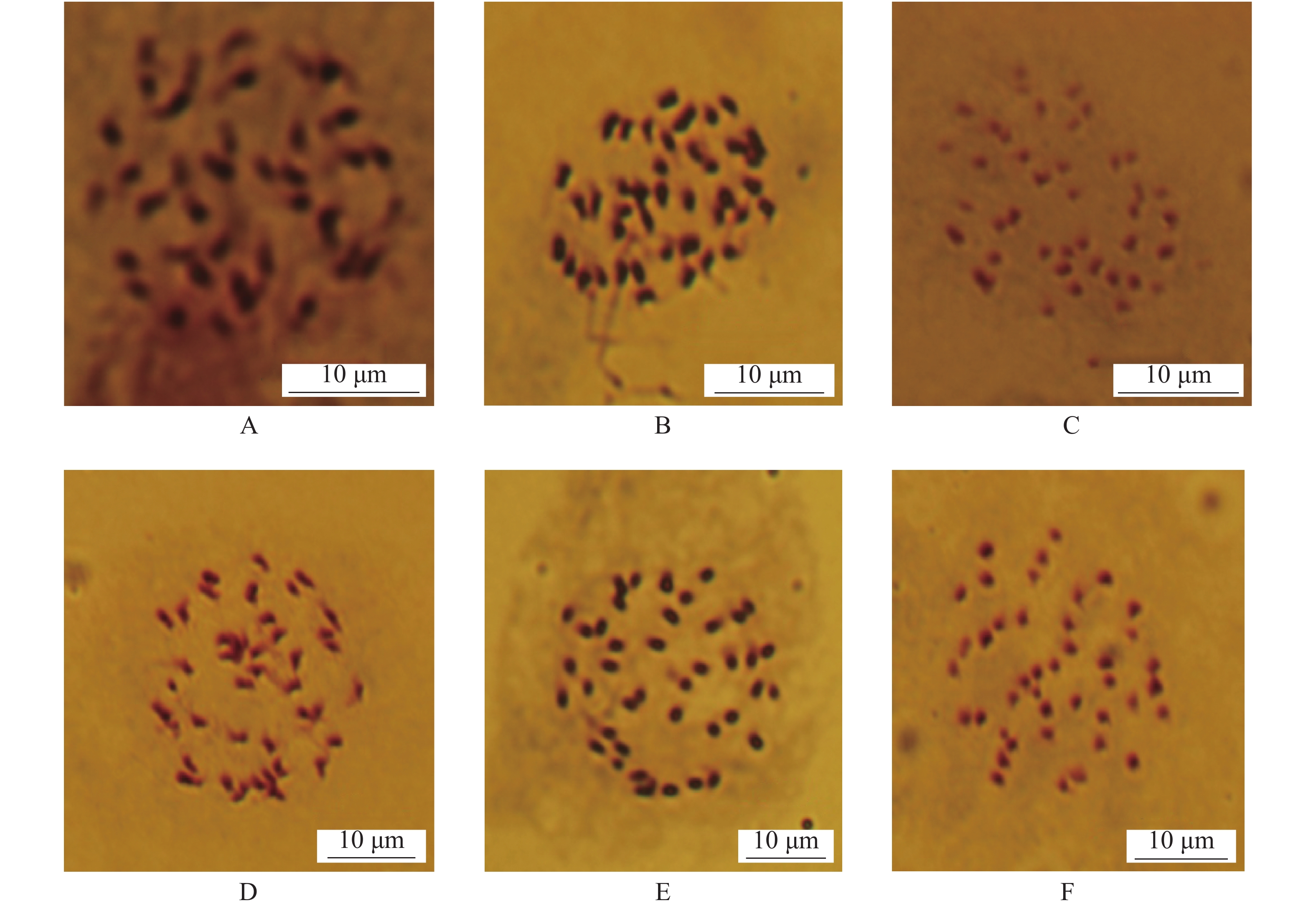
不同预处理方法下大薯嫩叶染色体制备结果(图1,表1)表明:在大薯嫩叶染色体制备过程中不同预处理方法对染色体分散效果和形态均有一定影响,且0.002 mol·L−1 8−羟基喹啉溶液预处理效果明显优于饱和对二氯苯溶液。其中0.002 mol·L−1 8−羟基喹啉溶液处理2 h时效果最好,此时的染色体分散性良好、聚缩程度适中、形态清晰、拖尾现象不明显(图1-E)。其次是饱和对二氯苯溶液预处理2 h,此时染色体分散性一般、聚缩程度欠佳、形态较模糊、略有拖尾现象(图1-B)。而其余预处理方法(图1-A,C,D,F)效果皆均不理想,不适合用于染色体制备。
-
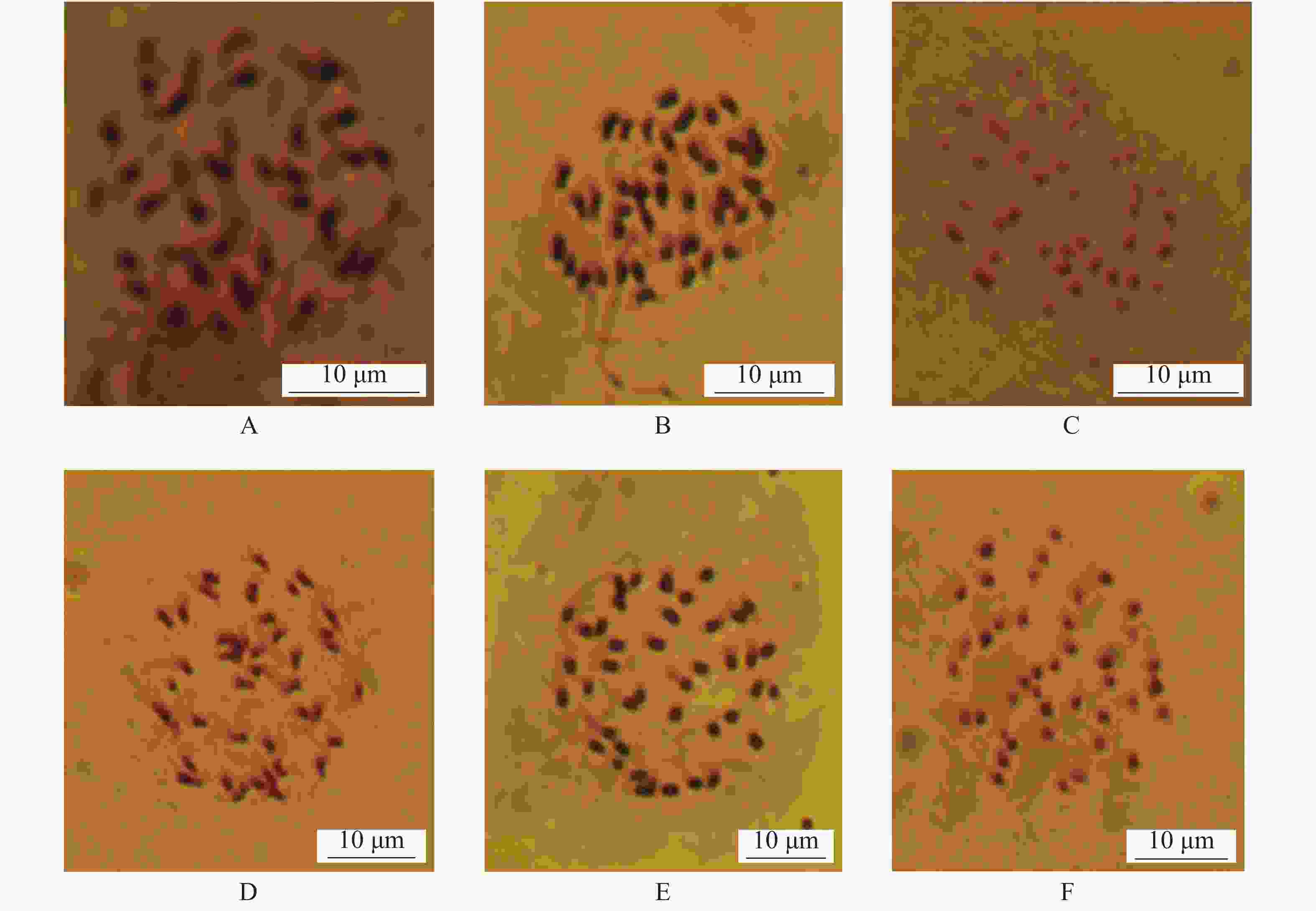
不同酶解时间下染色体制备结果(图2)表明:酶解程度对制片上染色体分散效果和背景的干净程度均有较大的影响。其中最适的酶解时间是1 h,此时细胞壁解离充分、背景干净、染色体分散程度好、染色体形态良好(图2-B)。酶解0.5 h,细胞质浓厚、染色体易重叠、形态不清晰、分散不好(图2-A);酶解1.5 h,染色体分散但形态不太清晰,且细胞易破裂,容易造成染色体丢失或混杂(图2-C)。
-
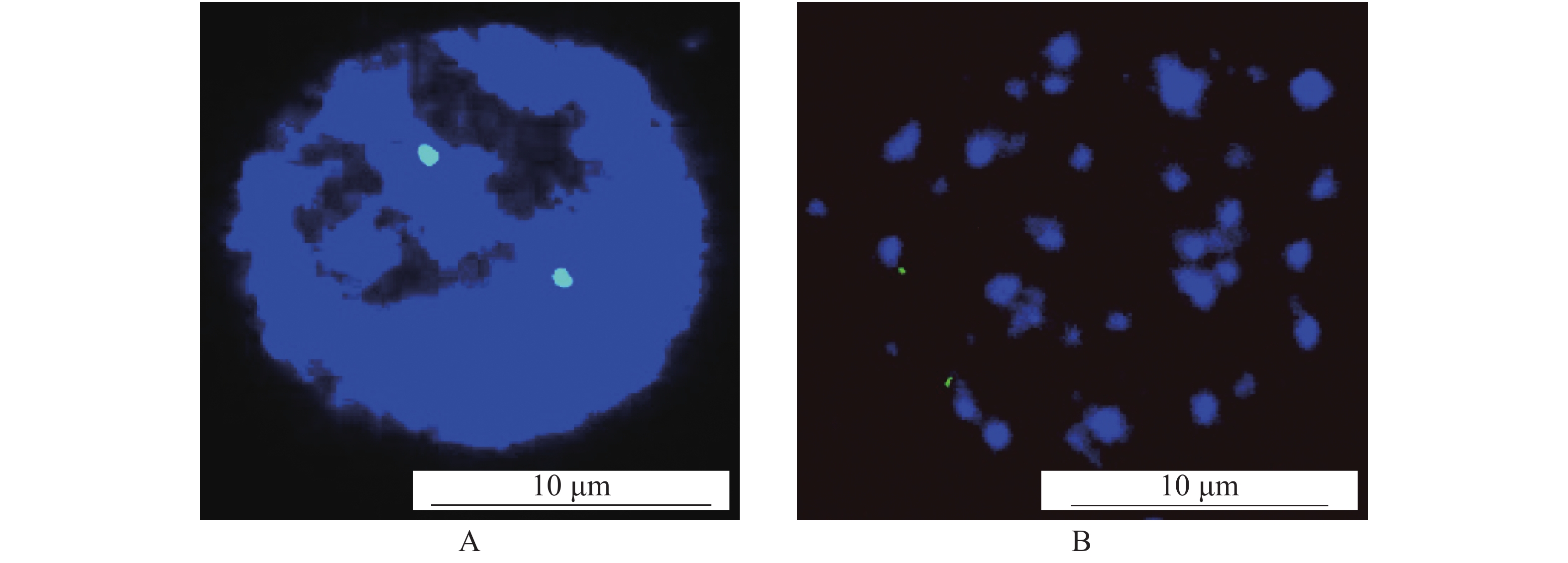
以大薯 45S rDNA 部分序列为探针,对大薯Da40的染色体标本进行原位杂交,检测染色体制片效果,结果(图3)表明:制备的大薯Da40染色体标本均能成功地用于荧光原位杂交,且在有丝分裂间期和中期细胞中均检测到 2 个杂交信号,结果可靠,信号强度相似,没有背景杂信号。
2.1. 叶片幼嫩程度对染色体制片效果的影响
2.2. 不同预处理方法对染色体制片效果的影响
2.3. 不同酶解时间对染色体制片效果的影响
2.4. FISH 信号的检测
-
李懋学[19]认为,凡是进行细胞分裂的组织或部位均可用于染色体制备。叶片由叶原基分化发育而来,幼嫩的叶片生长迅速、细胞分裂旺盛,这是可以利用其进行染色体制备的主要原因。相较于根尖和茎尖,叶片生长期更长,凡植物生长季节均可获取;其次嫩叶的数量更多,取材更加方便且对植株的生长发育影响更小,利用幼嫩叶片为材料进行染色体制备便显得更加方便快捷,但是嫩叶染色体的制备仍具有一定的局限性。一般来说,根尖分生区细胞因其稳定活跃的细胞分裂和较大的细胞核,常作为染色体制备的最佳取材部位。而利用嫩叶进行染色体制备的效果普遍不如根尖的好,且制备流程更加复杂,如叶片的选择和涂片时叶边缘组织的刮取等。解离是植物细胞染色体制片过程中重要的一环,其作用是为了去除细胞间果胶层、软化细胞壁,利于后期的涂片。然而,在对盾叶薯蓣染色体制备研究中,黄贤兰等[20]、郑晓琴等[11]分别用不同含量的纤维素酶和果胶酶混合液,在相同温度和时间下,均制备出了较好的染色体制片。针对这种情况,笔者推测可能是因为使用的酶来自不同的生产商,从而导致酶的活力存在差异造成的。荧光原位杂交技术常用于作物远缘杂交育种以及植物起源和进化的研究中。荧光原位杂交要求染色体制片背景干净、染色体分散。在本研究中,笔者对大薯叶片染色体制片进行了荧光原位杂交检测,结果显示杂交信号清晰稳定,且没有信号杂背景。这说明,这种方法获得的染色体制片可以满足荧光原位杂交,效果良好且方便实用。本研究结果为后续大薯及其近缘种植物的细胞遗传学分析,特别是数量少且珍贵的植物材料,提供了一种较好的染色体制备方法。








 DownLoad:
DownLoad: