-
甘蔗(Saccharum officinarum L.)是世界范围内热带、亚热带地区栽培的核心糖料和生物燃料作物,被广泛用于制糖工业、乙醇生产和生物能源开发[1]。然而,甘蔗在生长发育阶段易受系统性病原病毒侵染[2],造成显著的经济损失和甘蔗产业安全隐患,严重威胁蔗糖产业链的稳定性[3]。在中国甘蔗主产区,甘蔗病毒病害由多种病原体引发,主要包括甘蔗杆状病毒(sugarcane bacilliform virus,SCBV)[4]、甘蔗花叶病毒(sugarcane mosaic virus,SCMV)[5]、高粱花叶病毒(sorghum mosaic virus,SrMV)[6]、甘蔗线条花叶病毒(sugarcane streak mosaic disease virus,SCSMV)[7]和甘蔗黄叶病毒(sugarcane yellow leaf virus,SCYLV)[8]等。此外,SCBV是甘蔗杆状病毒病和甘蔗叶斑病的核心致病因子[9-10]。
SCBV隶属于花椰菜病毒科(Caulimoviridae)杆状DNA病毒属(Badnavirus)[11],SCBV基因组为环状双链DNA,大小为7.3~8.0 kb。侵染甘蔗后,导致甘蔗叶片出现特征性叶部病变,初期表现为不规则的斑驳,后期发展为褪绿条纹等典型症状;同时,造成甘蔗的单茎质量下降、出汁率降低及蔗糖分损失,使得甘蔗的产量降低(受SCBV侵染的蔗株茎秆细弱,节间缩短,单株质量减少导致亩产降幅达25%~37.5%)和品质下降[12]。近年来,随着国内外甘蔗种质的频繁交流,SCBV在全球甘蔗种质中的传播蔓延极为迅速,在甘蔗种苗中的隐性传播率高达68%,已成为制约甘蔗产业可持续发展的重要生物灾害因子。甘蔗产业正面临着由DNA病毒引起的甘蔗杆状病毒的严峻挑战,造成了巨大的经济损失[1]。此外,SCBV主要通过种苗调运进行远距离传播,SCBV近距离传播主要通过甘蔗红粉蚧(Saccharicoccus sacchari)和灰粉蚧(Dysmicoccus boninsis kuwana)[13]传播,在田间条件下其自然侵染具有显著广泛性和普遍性;该病毒可突破甘蔗属(Saccharum)种间遗传屏障,完成对热带种(S. officinarum)、大茎野生种(S. robustum)、中国种(S. sinense)、印度种(S. barberi)及割手密种(S. spontaneum)的系统性侵染;同时可感染禾本科高粱属(Sorghum)等非甘蔗近缘植物。快速、准确地检测SCBV,明确其在甘蔗植株中的分布规律,对病害防治、抗病育种等方面意义重大。
目前,SCBV的检测方法主要有电子显微镜观察法[14]、血清学检测法[15]、PCR检测法[4]和实时荧光定量PCR法,然而,这些方法均只能进行定性检测,不能对SCBV进行定量测定。同时,SCBV在甘蔗不同组织部位中的分布与含量仍缺乏系统性研究。
甘蔗作为多年生C4糖料作物,其生长阶段和器官的不同功能分化可能导致不同组织部位的病毒感染和复制的差异[16]。此外,SCBV的致病性与病毒载量阈值密切相关,明确病毒在关键组织(如叶片和输导组织)中的累积规律,可为精准防控策略优化提供理论基础。本研究拟建立一种基于实时荧光定量PCR技术的SCBV绝对定量检测方法,实现病毒载量的精确测定,分析SCBV在甘蔗不同组织(叶片、茎秆、根系和芽)中的病毒载量,揭示SCBV病毒在甘蔗组织中的分布规律,为田间精准采样和SCBV防控提供技术支撑和理论依据。
-
于海南文昌基地选取经过鉴定感染SCBV的10份甘蔗种质(‘ROC22’‘中糖3号’‘海蔗28号’‘桂糖47号’‘柳城05-136’‘柳城031-182’‘云蔗05-51’和‘云蔗08-1609’‘桂糖51号’和‘粤甘55’),对每个甘蔗种质材料,采集三株生长状态一致的植株作为混合样本,并实施三个生物学重复测定,分别采集其负1叶、正1叶、正2叶、正4叶、根、茎、芽等组织样品。本实验中所用到的单一感染甘蔗条点病毒、甘蔗花叶病毒、甘蔗线条花叶病毒、高粱花叶病毒、甘蔗黄叶病毒的5种甘蔗材料由本实验室鉴定保存。
-
提取DNA所用试剂(CTAB、异丙醇和乙醇等)、2 x Taq plus Master Mix(由北京全式金生物技术股份有限公司提供)、PowerUpScientific荧光定量PCR试剂盒、Omega Plasmid Mini Kit I质粒小提取试剂盒、ToloBio的DH5α感受态细胞、Aidlab琼脂糖凝胶回收试剂盒(AidQuick Gel Extraction Kit)、东胜生物的DNA Marker,Biowest Agarose琼脂糖、宝日医生物技术(北京)有限公司的pMD19-T载体试剂盒、博迈德生物的DNA Marker等。
-
冷冻离心机(Centrifuge 5 430R,Eppendorf)、电泳仪(PowerStation 300,Labnet)、凝胶成像系统(Tanon 500)、德国耶拿梯度PCR仪、高压蒸汽灭菌锅(HVE−50,HIRAYAMA)、Roche罗氏LightCycler 96荧光定量PCR仪、恒温摇床、恒温水浴锅(N.JG−27EKISO)等。
-
在NCBI 网站上以关键词SCBV在Genome数据库搜索进入核酸序列KM214 358.1页面并下载其基因组序列,选取SCBV-ORF 1 DNA序列在SCBV上层分类单元Badnavirus中进行blastn,选取MEGA BLAST的所有比对结果并下载其aligned region。利用MultAlin 对8组SCBV基因组序列进行序列比较,选取较为保守区域进行引物设计。使用软件Primer Premier 5设计引物。用primer-blast进行引物特异性比对检测。根据比对结果选取引物对SCBV-qF:5′-GAAGGTGTGGAATACCTGAA-3′和SCBV-qR:5′-TCACCATGTGGTGAACCGT-3′进行合成,目的片段长度为171 bp。引物由上海生工有限公司合成。
-
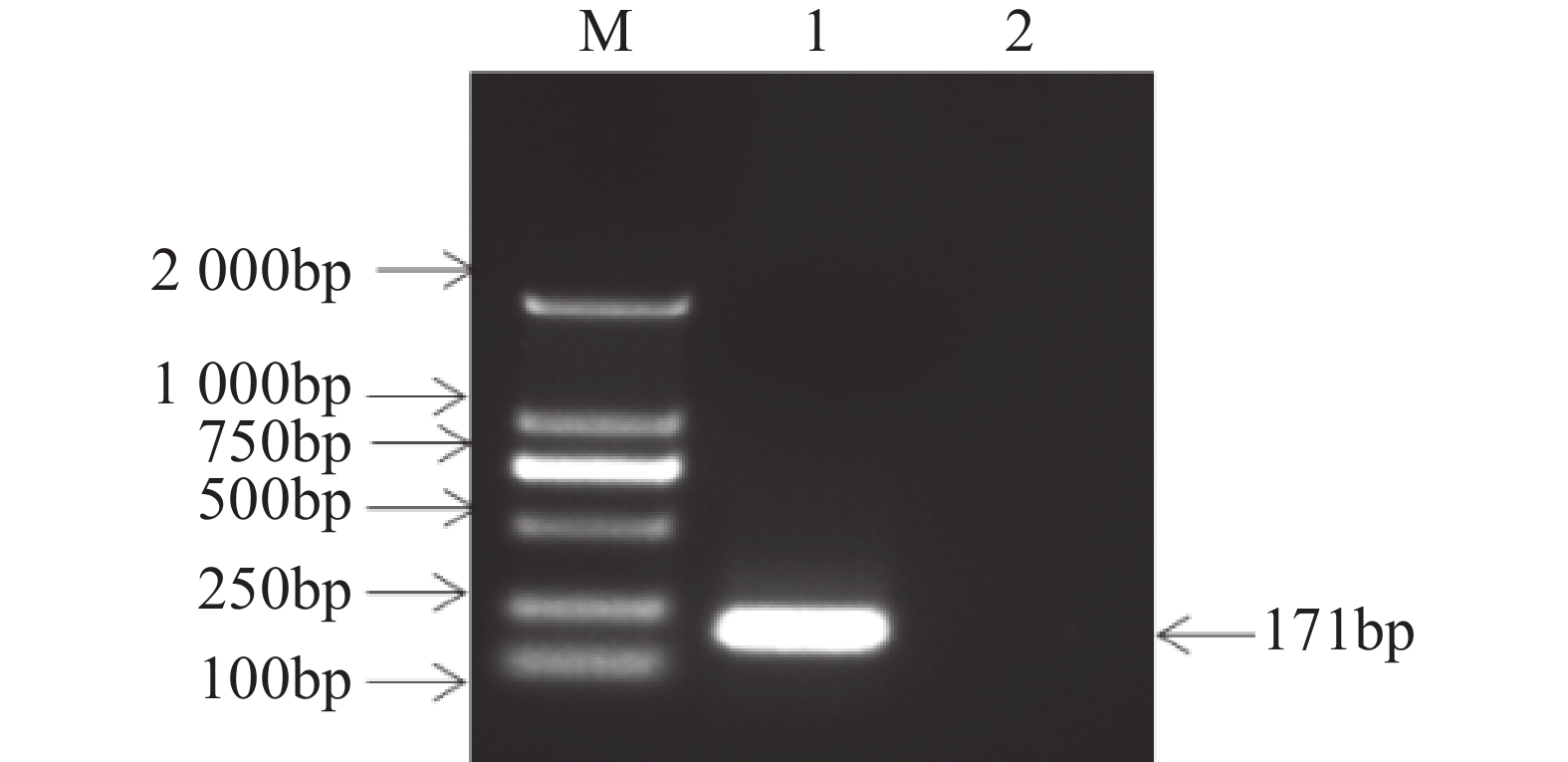
取甘蔗叶片剪碎放入研钵中,加入液氮磨成粉末,取约0.1 g的粉末装入2.0 mL离心管中,采用改良版CTAB法提取甘蔗叶片总DNA[14]。以SCBV阳性甘蔗样品总DNA为模板,利用设计的特异性引物对SCBV-qF/qR为特异引物进行SCBV基因的PCR扩增,使用无菌双蒸水作为阴性对照,扩增目的片段大小为171 bp。反应总体系构建采用25 μL标准体系:主反应混合物2×Taq plus Master Mix为12.5 μL,分别加入特异性正向引物与反向引物各1 μL,加入2 μL模板DNA,用无菌双蒸水补足至25 μL。PCR扩增程序:初始变性95 ℃维持5 min;变性阶段95 ℃维持30 s,退火阶段58 ℃维持30 s,延伸阶段72 ℃维持1 min,(35 cycles),最后72 ℃延伸10 min完成扩增产物。PCR扩增产物经琼脂糖凝胶电泳验证:质量分数1%琼脂糖凝胶(含Maker染色)在120 V电压下电泳20 min,紫外成像系统检测显示单一目的条带(片段大小171 bp)。随后采用Aidlab琼脂糖凝胶回收试剂盒进行纯化。回收DNA片段经T4 DNA连接酶催化与pMD19-T载体构建重组质粒,热激法转化DH5α感受态细胞(预冷LB培养基,42 ℃维持45 s)后,挑取单菌落进行菌落PCR鉴定,PCR鉴定为阳性的菌株提取获得重组质粒pMD19T-SCBV-P1;将PCR检测为阳性的菌株抽提重组质粒pMD19T-SCBV-ORF1进行测序,将测序验证正确的质粒作为阳性质粒标准品,采用紫外光谱分析法对质粒DNA样品进行质量评估,计算得出质粒浓度及纯度参数。利用公式(1)计算质粒DNA拷贝数[17]。
-
绝对荧光定量PCR反应条件的优化:退火温度优化(55~62 ℃梯度实验,最终选定58 ℃);反应体系引物优化(0.2~1.2 μL梯度实验,最终选定0.4 μL)。扩增总体系20 μL:预混体系2×Q3 SYBR qPCR Master Mix为10 μL、特异性引物SCBV-QF/QR各添加0.4 μL、基因组DNA模板2 μL、用无菌双蒸水补充反应终体系。标准曲线的建立:重组质粒标准品按照十倍递增系列稀释法制备7个浓度梯度(2.41~2.41×10−6 copies·μL−1)作为模板,实验采用四孔复测法处理不同浓度模板,使用设计的特异性引物 SCBV-qF/qR,通过qPCR检测体系完成核酸扩增后生成标准曲线。敏感性实验:制备重组质粒标准品检测范围为7.14×108~7.00 copies·µL−1 (10倍倍比梯度稀释),采用本实验构建的qPCR方法与传统PCR方法实施扩增实验,比较两者的检测灵敏度差异。绝对荧光qPCR特异性检测:本研究以SCBV及5种其他主要甘蔗病毒(SCSMV、SrMV、SCMV、SStrV、SCYLV)为检测对象,通过开展qPCR扩增实验并同步设立阴性对照,系统评估分析该方法的特异性表现。重复性检测:以10倍递增系列稀释法得到的重组质粒标准品为模板,分别进行实时荧光定量PCR的批内和批间检测,基于反应获得的荧光信号阈值循环数(Cq值)计算批次内及批次间变异系数(CV),公式为:CV=SD/均值×100%(SD:标准差;mean:几何均值),以此验证方法的批内重复性与批间精密度。此外,取定量的高值质粒(7.14×108 copies·µL−1)进行10倍比梯度稀释至(7.14 copies·µL−1)。提取稀释产物作为待测样本开展重复性检测,每个稀释浓度设置4次重复检测,实验分2批次完成,全面评估该方法在不同浓度水平下的稳定性[18]。
分别提取SCBV常规PCR检测呈阳性的10份甘蔗种质的负1叶、正1叶、正2叶、正4叶、根、茎和芽的DNA作为模板,基于前期建立的qPCR绝对定量技术,通过构建标准曲线对甘蔗不同组织器官样本(叶、茎、芽、根)中的SCBV核酸拷贝数进行精准检测。
-
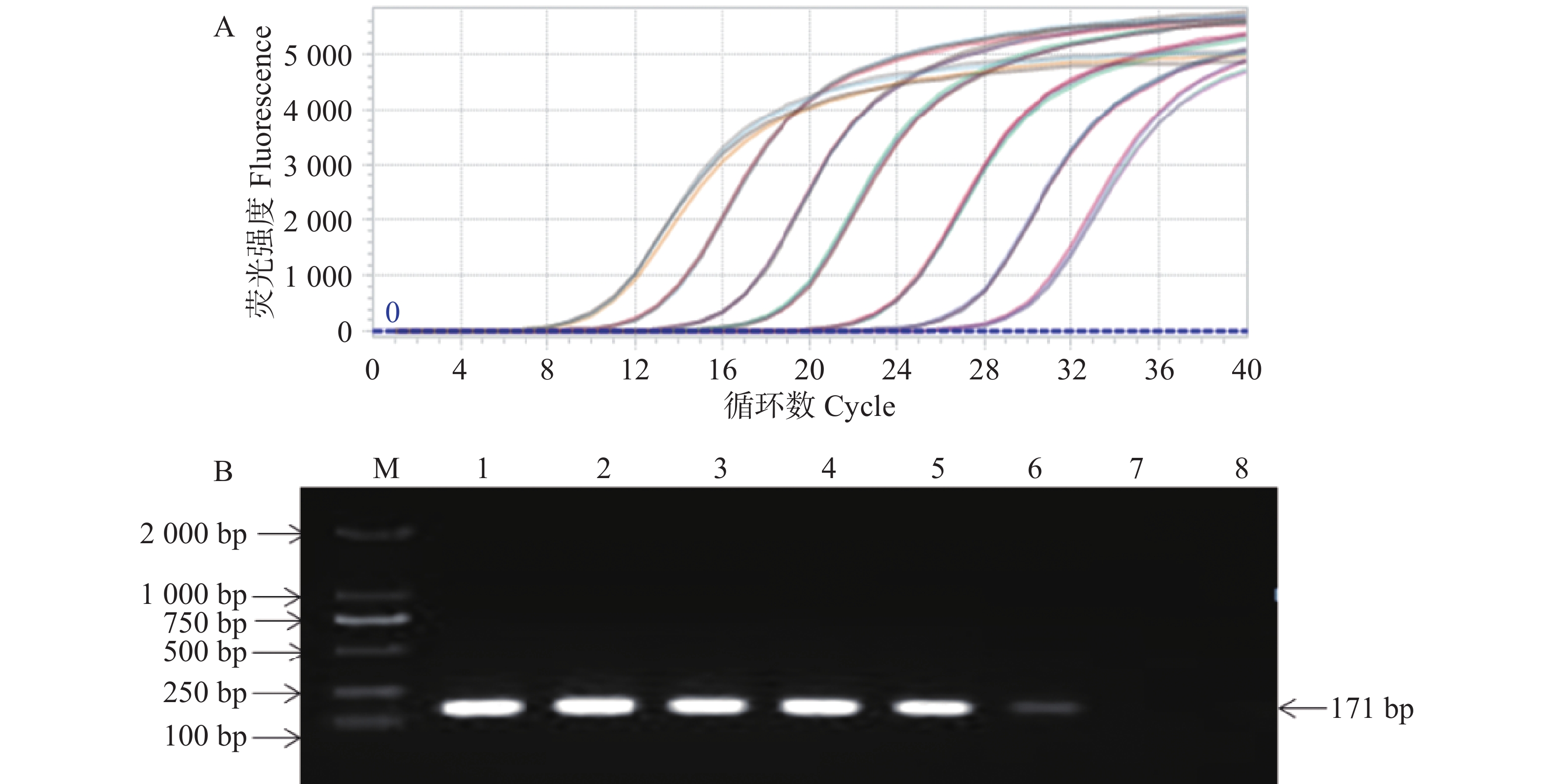
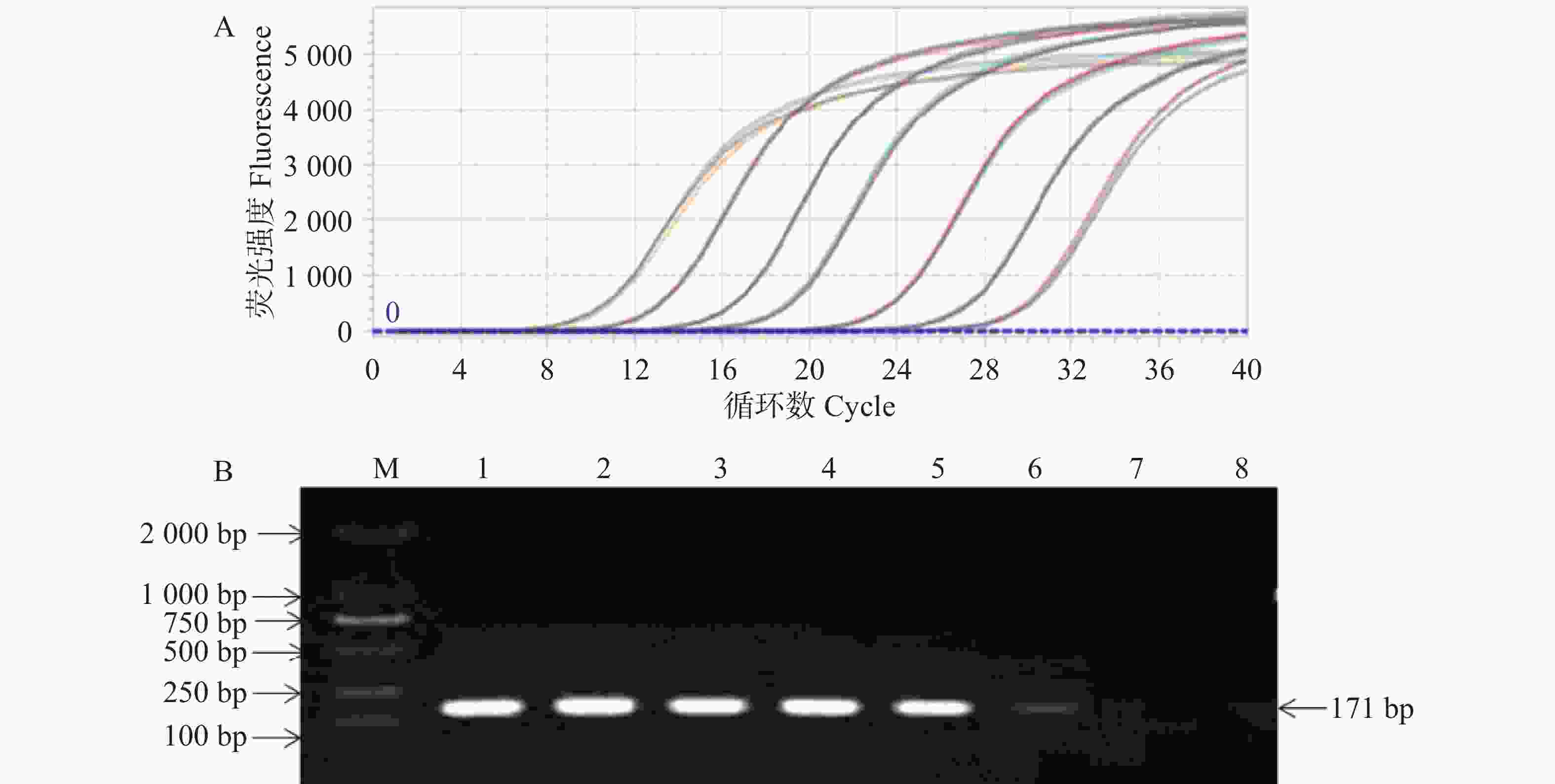
基于SCBV基因组DNA模板,使用SCBV-qF/SCBV-qR特异性引物对进行PCR扩增,通过琼脂糖凝胶电泳检测,观察到与预期大小(171 bp)一致的单一特异性条带如(图1)。通过Aidlab琼脂糖凝胶回收试剂盒将该条带回收纯化,随后与pMD19-T载体进行连接反应构建重组质粒,经测序验证序列正确的重组质粒命名为pMD19T-SCBV-P1,作为qPCR检测阳性质粒标准参照物。采用紫外可见分光光度法评估质粒的纯度和浓度,OD260/OD280 的比值为 1.88,纯度符合要求(OD260/OD280 >1.8)。测得质粒质量浓度为241.7 copies·μL−1,通过公式(1)计算出质粒 DNA 拷贝数为7.14×1010 copies·µL−1。
-
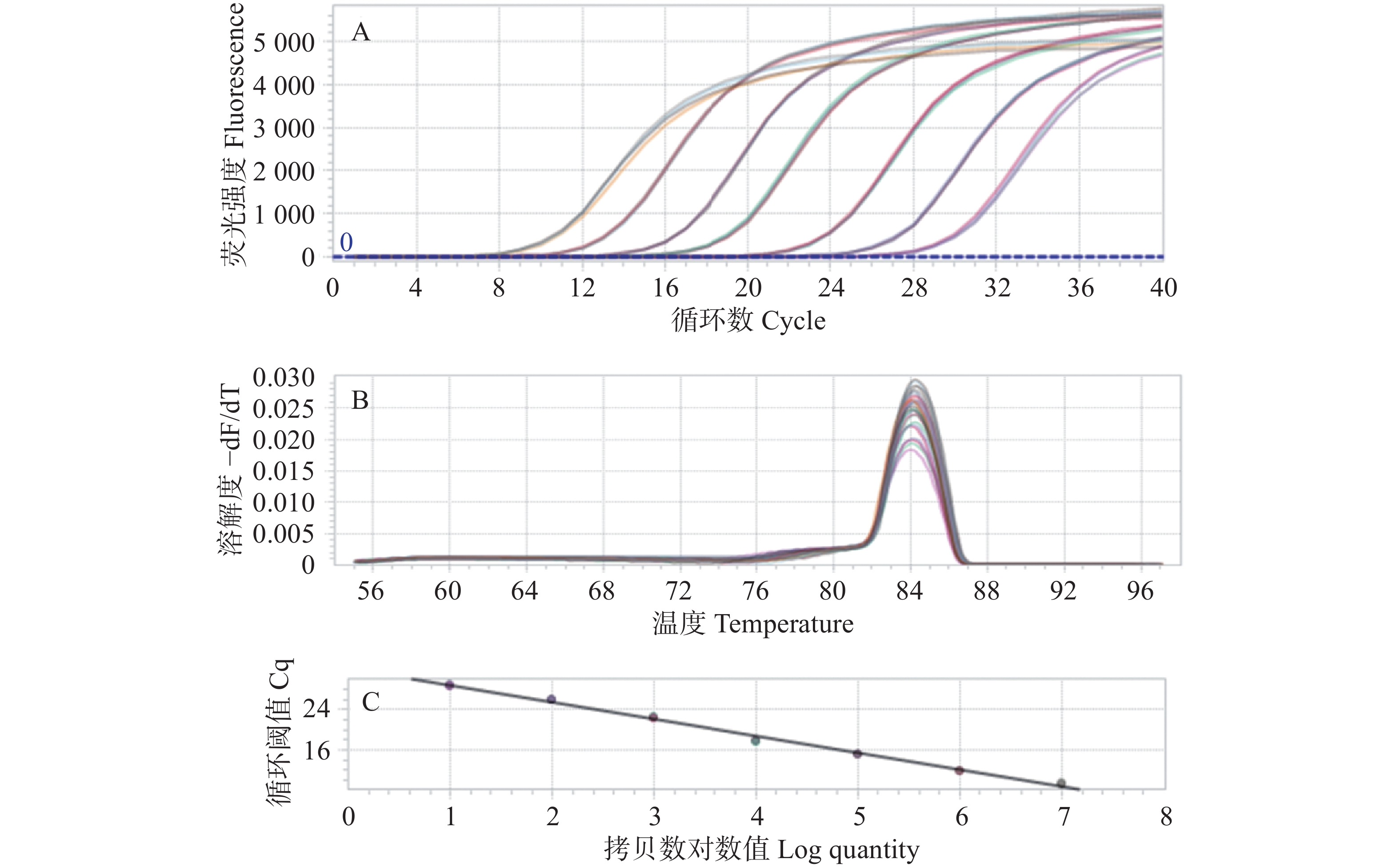
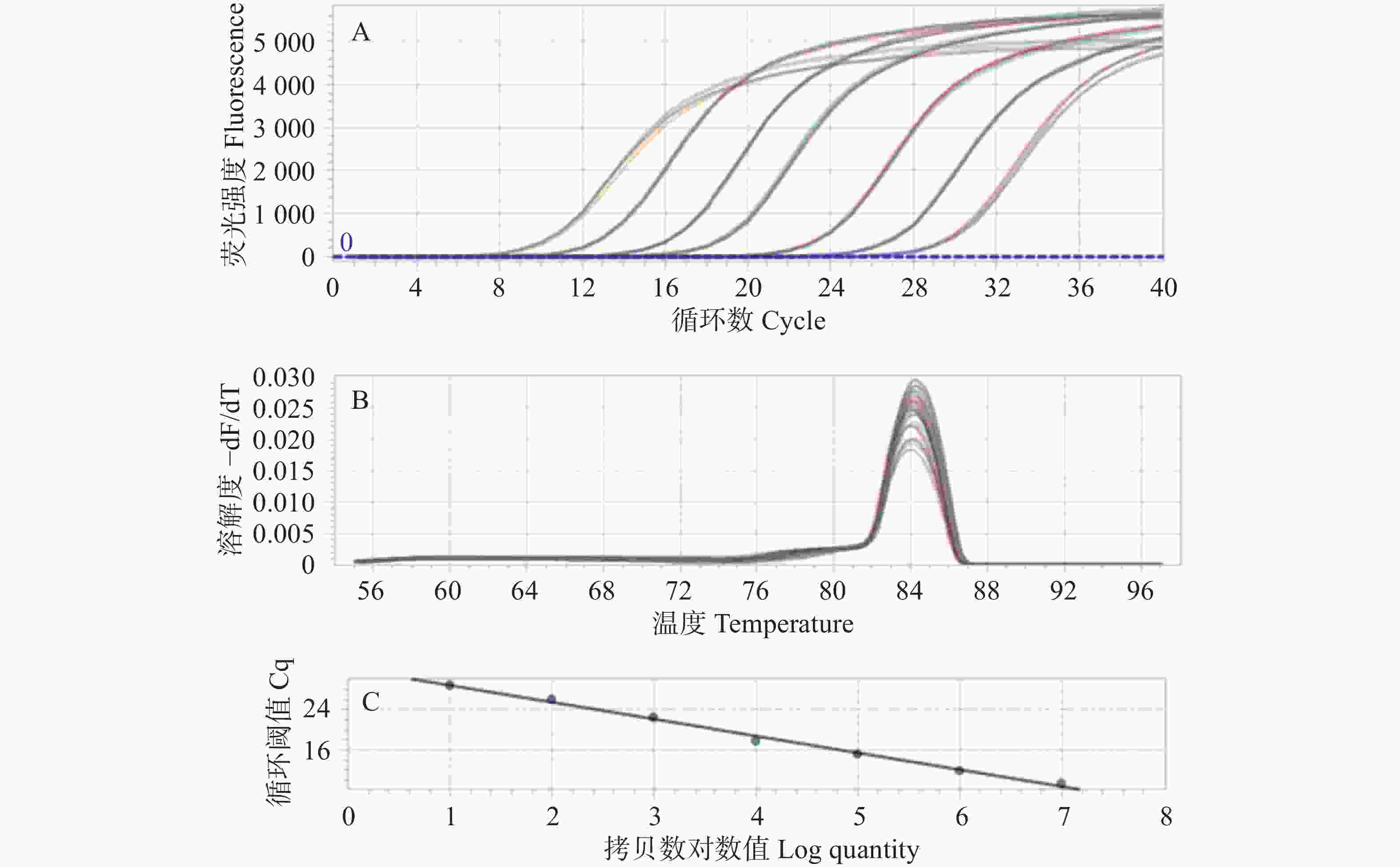
使用重组质粒标准品按照10倍递增系列稀释法制备7个质量浓度梯度(2.41~2.41×10−6 copies·μL−1)作为模板,实验采用四孔复测法处理不同浓度模板,使用设计的特异性引物SCBV-qF/qR,并在优化后的反应条件和体系下完成核酸扩增后生成标准曲线。结果显示:其扩增曲线良好如(图2-A),DNA标准品qPCR解链曲线分析采用Roche罗氏LightCycler 96荧光定量PCR仪进行实时监测,目标产物Tm值(84.1±0.1) ℃时,单峰特征符合特异性扩增标准,实验未检测到非特异性扩增产物及引物二聚体(图2-B),反应结束后生成绝对定量标准曲线。该方法在模板量为7.14×108~7.14 copies·µL−1时,表现出显著的线性相关性,相关系数(R2)达到0.999,斜率为−3.339 7。绝对定量方程曲线:
$ {y}= -3.339\; 7\times\mathrm{l}\mathrm{o}\mathrm{g}\left({x}\right)+32.05 $ (图2-C)。 -
实验整合SCSMV/SrMV/SCMV/SCYLV的cDNA模板与SCBV/SStrV(sugarcane striate virus,SStrV)的DNA模板,采用特异性引物进行qPCR 扩增反应,检测该方法特异性。结果显示,除了SCBV外,SCSMV、SrMV、SCMV、SCYLV和SStrV的均未得到有效扩增(图3),表明建立的绝对荧光定量检测法的特异性好。
-
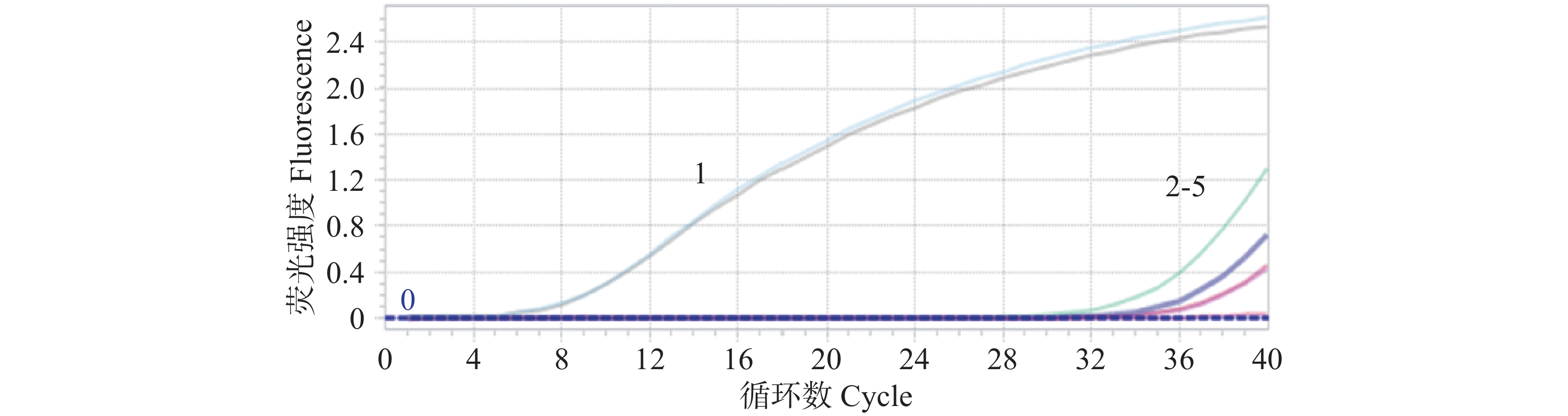
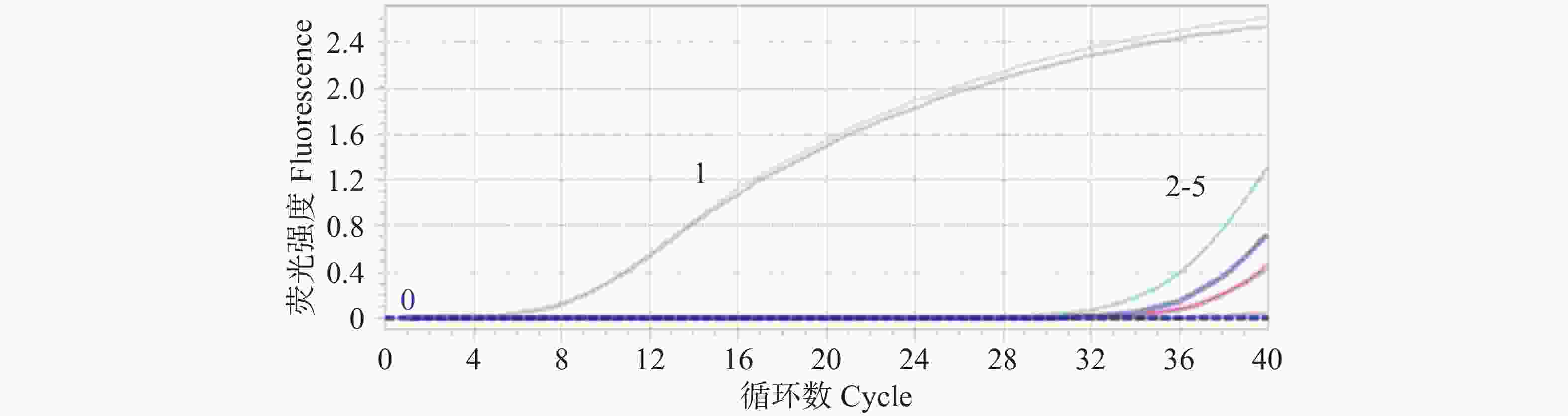
将重组质粒标准品以7.14×107~7.14 copies·μL−1梯度稀释作为模板,同时利用建立的绝对荧光定量PCR法和常规PCR方法进行扩增,比较分析两种方法的灵敏度。结果显示:绝对荧光定量PCR法可以检测SCBV模板最低限度为7 copies·μL−1(图4),常规PCR可以检测SCBV模板最低限度为7.14×102 copies·μL−1,与传统的常规PCR法相比,绝对荧光定量PCR法的灵敏度提高了近100倍。
-
采用10倍递增系列稀释法得到重组质粒标准品构建绝对荧光定量检测体系,进行批内重复性验证和批间重复性实验。通过反应得到的Cq值(循环阈值)计算批内和批间的变异系数(CV),对该方法进行批内重复性验证和批间精密度评估。计算批内变异系数(0.37%~0.90%)与批间变异系数(0.11%~0.90%),所有参数均满足<1%的精度要求(表1),表明本研究所建立的SCBV绝对荧光qPCR检测方法具有优异的实验重复性。
标准质粒/(copies·µL-1)
Concentration of standard plasmid批内重复性(Ct值) Intra-assay (Ct value) 批间重复性(Ct值) Inter-assay (Ct value) 均值($\bar x \pm s $)
Mean value变异系数(CV)/%
Coefficient of variation均值($\bar x \pm s $)
Mean value变异系数(CV)/%
Coefficient of variation1$ \times $108 9.94±0.08 0. 85 9.96±0.09 0.90 1$ \times $107 12.76±0.07 0.59 12.78±0.10 0.65 1$ \times $106 16.39±0.06 0.37 16.39±0.18 0.34 1$ \times $105 19.37±0.17 0.90 19.30±0.11 0.31 1$ \times $104 23.02±0.16 0.73 23.18±0.04 0.11 1$ \times $103 25.97±0.10 0.42 26.09±0.16 0.38 1$ \times $102 29.16±0.16 0.54 28.91±0.10 0.71 Table 1. The repeatability results of absolute quantitative real-time PCR for SCBV
-
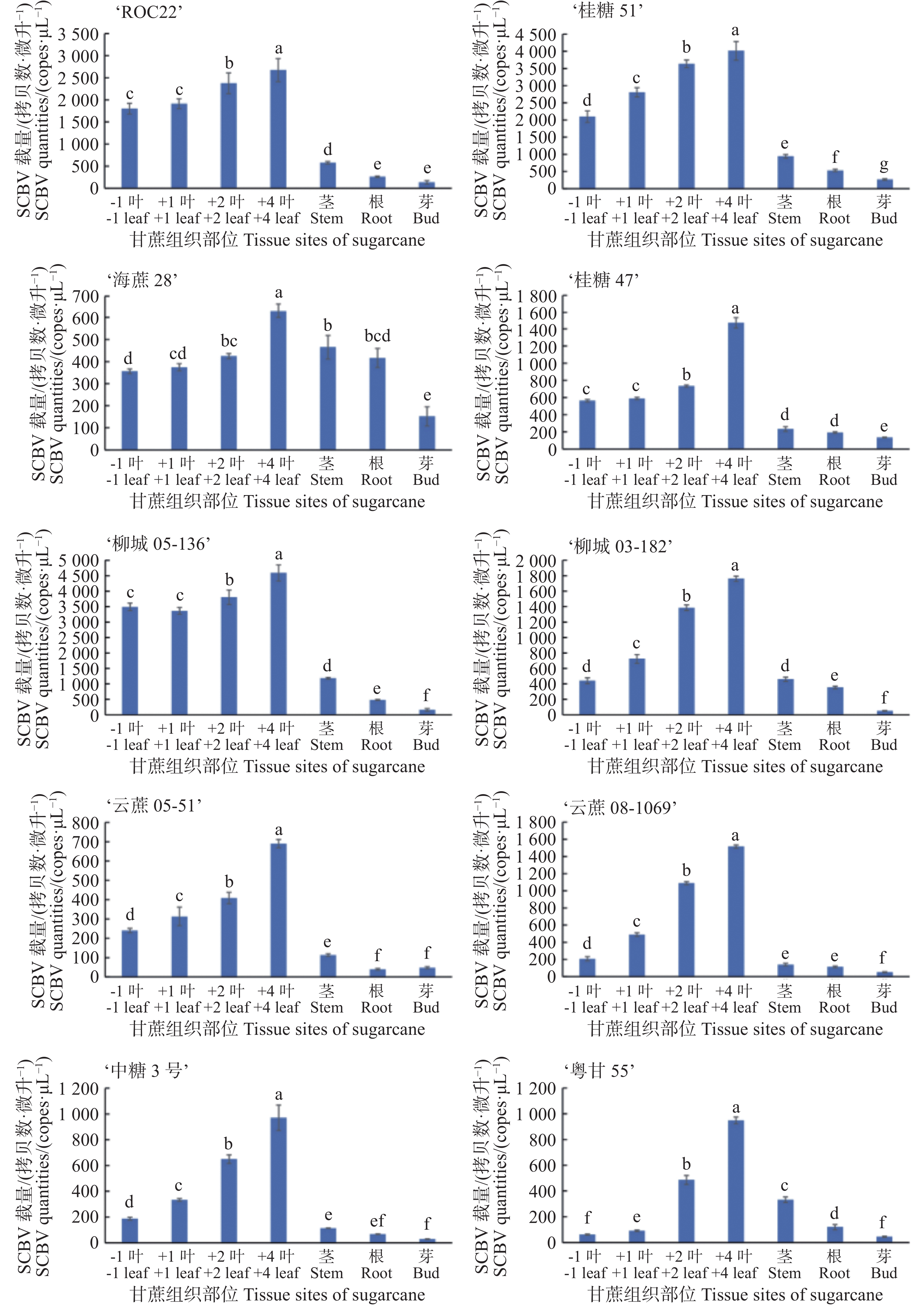
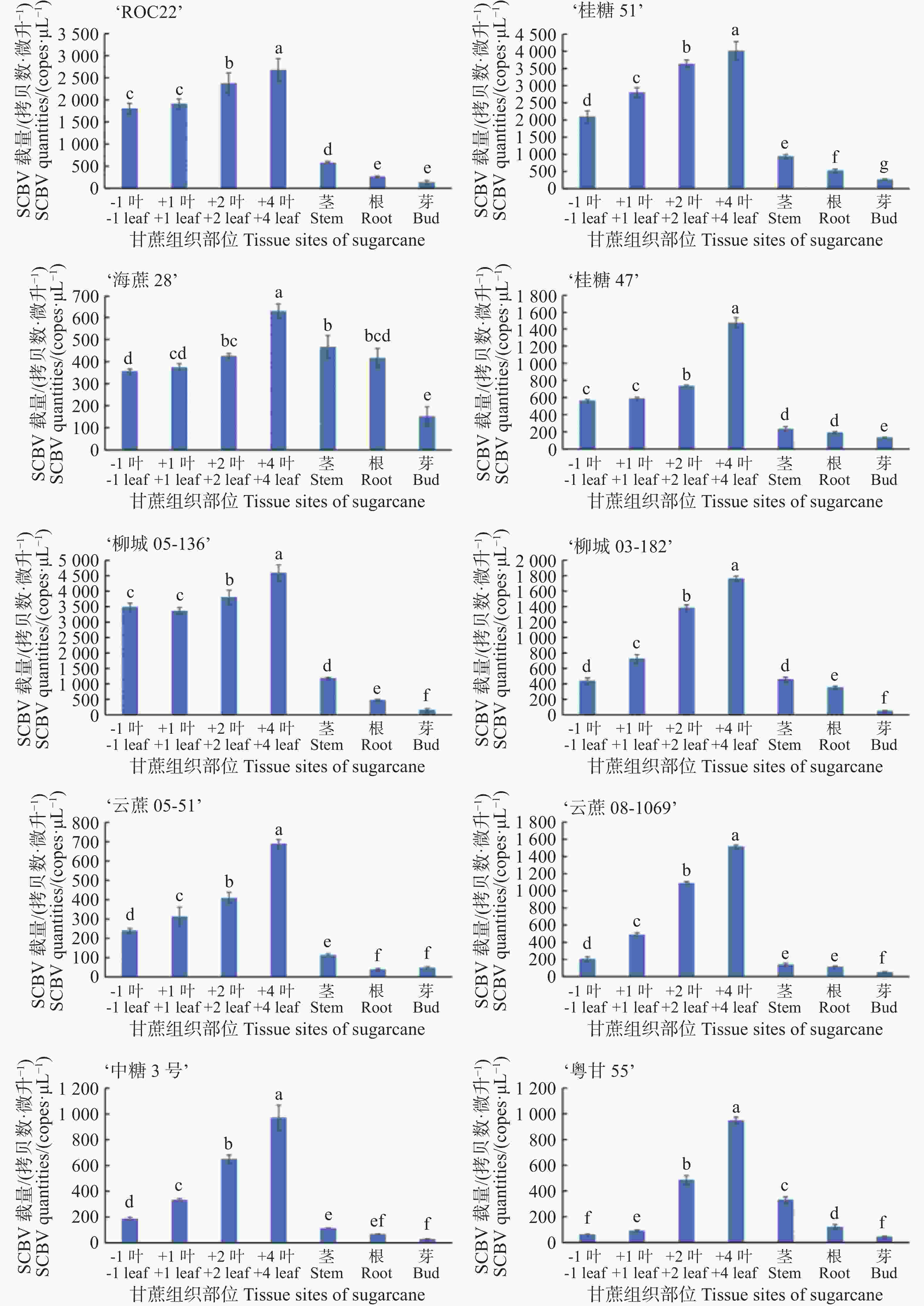
使用本实验建立的SCBV绝对荧光定量PCR法对感染SCBV的10份甘蔗种质(‘ROC22’‘桂糖51号’‘海蔗28号’‘桂糖47号’‘柳城05-136’‘柳城031-182’‘云蔗05-51’‘云蔗08-1609’‘中糖3号’和‘粤甘55号’)成熟期植株的7个不同组织部位(负1叶、正1叶、正2叶、正4叶、根、茎和芽)SCBV病毒载量进行测定。结果显示,在甘蔗叶、茎、根和芽4个部位中均能检测到SCBV病毒,其中叶片中载量高于根、茎和芽三个部位;在大多数甘蔗种质中,正4叶中SCBV载量显著高于负1叶、正1叶和正2叶三个位置叶片(图5)。
-
甘蔗杆状病毒病是近年来新发的一种甘蔗病毒性病害[17],其病原SCBV被认为是世界范围内危害甘蔗生产最严重的病原之一[19]。目前,在中国广西、云南、广东、海南、福建和江西等都有 SCBV的报道[20],建立一种早期、高效、灵敏、定量的检测方法对甘蔗杆状病毒病的防治至关重要[21]。当前SCBV的检测方法主要有电子显微镜观察、血清学检测、常规PCR检测和实时荧光定量PCR检测。电子显微镜观察法耗时耗力,灵敏度低,不宜大范围使用。血清学法的检测虽然操作简单,但要求有特异性抗体,不能检测全部株系。常规PCR检测法是最常用的分子检测方法,但常规PCR灵敏度低,难以满足低含量样本检测需求。且上述方法均只能定性检测,不能对SCBV进行定量检测,对于病毒含量较低的样品检测效果欠佳。近年来,绝对实时荧光定量PCR技术能够对待测样品中的病原进行定量分析,具有快速、准确、灵敏度高等特点,目前已被应用于多种甘蔗病毒的检测,如条纹花叶病毒[17]、甘蔗条点病毒[22] 和高粱花叶病毒[23]等。本研究建立了SCBV的绝对荧光定量PCR检测法,对反应条件进行优化,并进行了特异性试验、灵敏性试验和重复性试验验证。研究结果表明该检测法特异性好,能特异性扩增检测SCBV[24];灵敏度高,可检测低至7 copies·μL−1的病毒基因组,是常规PCR方法的100倍;同时具有良好的重复性,批内和批间重复性的变异系数均小于1%;标准曲线线性关系良好(R2>0.999),适用于SCBV载量的精确评估。
甘蔗的一生可以分为萌芽期、幼苗期、分蘖期、伸长期和成熟期5个时期。萌芽期、幼苗期甘蔗的叶片为1~5片,分蘖期甘蔗的叶片通为5~7片,伸长期和成熟期甘蔗的叶片通常为7~15片。在甘蔗上,通常将完全伸展开的第一片叶子定义为正1叶,紧挨着正1叶未完全伸展开的叶子为负1叶,紧挨着负1叶伸展开一部分的叶子为负2叶,通常负2叶前面的叶子还未伸展开,紧紧包裹在一起。正1叶后面完全伸展开的叶子依次为正2、正3、正4、正5、正6、正7、正8等。负2叶大多数时候仅伸展开一部分的,取样不方便,因此选择从负1叶开始取样。负1叶至正4叶(第2~6片叶子)通常为甘蔗新鲜的叶片,生命力旺盛,伸长期和成熟期甘蔗普遍都能取到。从正5叶(甘蔗第7片叶子)开始,许多甘蔗的叶片已经进入衰老期,开始干枯发黄,甚至完全干枯脱落。这样的叶片中病毒核酸的提取困难,实验误差大。因此本研究对甘蔗叶部组织中SCBV病毒载量进行分析时,选择甘蔗的负1叶、正1叶、正2叶、正4叶进行定量分析。基于本研究建立的SCBV绝对荧光定量PCR检测体系,对中国不同蔗区10份被SCBV侵染的甘蔗种质成熟期植株7个不同组织部位(包括负1叶、正1叶、正2叶、正4叶、根、茎及芽)中的病毒载量进行定量测定。结果显示,在甘蔗叶、茎秆、根系和芽4个部位中均存在SCBV,且病毒载量在不同组织中存在显著差异,其中叶片SCBV载量显著高于根系、茎秆和芽三个部位。在大多数甘蔗种质中,正4叶中SCBV载量显著高于负1叶、正1叶和正2叶。
已有研究指出,利用绝对荧光定量PCR技术对多种植物病原病毒进行快速、准确的检测[25];为开展植物病毒研究奠定了良好的基础,已成为甘蔗病毒病害研究的核心工具。本研究建立的SCBV绝对荧光定量检测方法有助于甘蔗杆状病毒病早期诊断;对病害综合防治具有实际应用价值。未来可通过引物设计优化、设备便携化及多技术整合,突破应用瓶颈,为甘蔗抗病育种和病害绿色防控提供更强支撑。
-
本研究成功构建了甘蔗杆状病毒高灵敏度绝对荧光定量PCR检测体系,实现SCBV核酸的精准定量检测。该方法灵敏度达到7 copies·μL−1,显著高于传统PCR方法的714 copies·μL−1,特异性和重复性较好。使用该方法对感染SCBV的10份甘蔗种质成熟期植株的7个不同组织部位(负1叶、正1叶、正2叶、正4叶、根、茎和芽)中的SCBV病毒的载量进行测定。结果显示,在甘蔗叶、茎、根和芽4个部位中均存在SCBV,叶片中SCBV病毒的载量高于根、茎和芽三个部位,在大多数甘蔗种质中,正4叶中SCBV病毒的载量要高于负1叶、正1叶和正2叶。王超敏等[22]基于绝对荧光定量PCR检测技术,对8个甘蔗品种7个组织部位(包括负1叶、正1叶、正2叶、正4叶、根、茎和芽)的SStrV病毒核酸载量进行系统检测,实验数据显示该病毒在正4叶中的含量显著高于其他组织部位,与其他组织存在极显著差异。因此,建议采集SCBV检测样品时,优先采集甘蔗植株的正4叶,或者对甘蔗正1叶、正2叶、正4叶进行混合取样。
Development and application of an absolute quantitative real-time PCR assay for Saccharum bacilliform virus
DOI: 10.15886/j.cnki.rdswxb.20250060
- Received Date: 2025-04-18
- Rev Recd Date: 2025-08-23
- Available Online: 2026-01-15
- Publish Date: 2026-01-15
-
Key words:
- sugarcane bacilliform virus /
- absolute quantitative real-time PCR /
- viral load distribution /
- detection
Abstract: An attempt was made to establish an absolute quantitative real-time PCR method for the detection of sugarcane baculovirus (SCBV) to determine the load of SCBV in different tissue parts of sugarcane. Specific amplification primers were designed from the conserved region of the SCBV genome (SCBV-ORF1), and the recombinant plasmid pMD19T-SCBV-P1 was constructed as a positive plasmid standard and used as a template to establish an absolute quantitative real-time PCR detection method for SCBV. This established detection method was tested in sensitivity, specificity and stability and then used to determine the SCBV load in different tissues of sugarcane germplasm. The recombinant plasmid containing the SCBV genomic sequence was diluted 10 times into a standard, and it was used as a template for quantitative real-time PCR. The standard curve y =
| Citation: | Xia Baoshan, Wang Wenzhi, Zhang Shuzhen, Yuan Qianhua, Shen Linbo. Development and application of an absolute quantitative real-time PCR assay for Saccharum bacilliform virus[J]. Journal of Tropical Biology, 2026, 17(1): 108-116. doi: 10.15886/j.cnki.rdswxb.20250060 |







 DownLoad:
DownLoad: