-
温郁金(Curcuma wenyujin)是姜科(Zingiberaceae)姜黄属(Curcuma)郁金的栽培品种,多年生药用植物,主产于浙江省温州市瑞安地区,植株中富含莪术挥发油、姜黄素类及多糖等多种功能代谢成分,具有抗肿瘤、抗炎抑菌、抗病毒、抗血栓、保肝、保护神经和抗氧化等功效。其药用部位主要是根茎和块根,根据不同的部位和方法,可加工成3种不同中药材:主根茎煮熟晒干称“温莪术”、块根煮熟晒干称“温郁金”、鲜侧生根茎纵切厚片后晒干称“片姜黄”。其中,“温郁金”为著名的道地药材“浙八味”之一[1]。莪术挥发油中的莪术醇(curcumol)、莪术双酮(curclione)、β−榄香烯(β-elemene)等为抗癌有效成分。以莪术挥发油为原料研制开发出疗效好、副作用小的新型抗肿瘤、抗炎抑菌等的药物制剂日益增多,如妇科外用良药保妇康栓的主要成分即为莪术挥发油。温莪术在莪术商品中以挥发油含量高、质量好而备受青睐,故温郁金不仅在原产地浙江温州瑞安原产区栽培,国内其他适栽的省份如海南、云南、贵州等异地也引种扩大种植[2]。温郁金的传统种植材料是根茎,长期无性繁殖导致植株在不同程度上携带、累积病毒和感染土传病原体等,引起种性退化,根茎品质参差不齐;利用根茎作为种茎,繁殖系数低,耗费大量原本可作为商品的根茎,种苗成本高;根茎繁殖的种苗良莠不一,造成根茎品质不均、产量降低,难以获得安全、有效、稳定和可控的中药材[3]等。这给温郁金产业可持续性发展带来严重挑战。
利用组培快繁进行温郁金组培苗繁育,不受季节限制,可周年生产,繁殖效率明显提高,是常规大田根茎繁殖种苗的有效补充手段[4-7]。当前,温郁金以组培苗种植时,主要以生根绿苗移栽为主,根细且长,炼苗移栽过程中根容易受伤、易受湿度影响造成死苗,若不经过假植炼苗,其移栽成活率低或不够稳定,不利于大面积推广应用。植物根茎不仅能储存养分,还能通过不定根和芽形成新的植株,进行无性繁殖,根茎的存在使得植物能够在不利环境下生存和繁衍。研究表明,根茎植物在组织培养合适条件下,可在瓶内诱导形成微型根茎[8-10],并可利用无菌微根茎或者微块茎等作为人工种子进行播种,省略绿苗炼苗假植环节及减少因绿苗对湿度严苛要求而导致的种苗损失;且微型根茎或块茎种苗也利于存储和远距离运输,从而提高植物种苗繁育效率,其大田栽种在长势、成品质量上均显示出试管微根茎或微块茎繁殖的优点[11]。微根茎或微块茎的诱导解除了传统种植方式对规模化扩大种植的限制,实现高效繁殖;且促进次生代谢产物的高效合成[9]。植物生长调节剂种类与配比、蔗糖浓度、矿质元素水平以及光质等均是试管微根茎诱导的主要调控因素[9-10]。在现实生产中,植物生长调节剂氯化胆碱(CC),具有促进植物光合作用而使植株次生代谢产物合成增加的效果,促进根系发育,有助于光合作用产物高效输送至地下储存器官,如块茎和块根,从而显著增加块茎块根的产量、改善品质[12-13];CC在山药(Dioscorea oppositifolia)等多种植物上经过登记,可合法、安全施用;IBA和CC配合使用明显促进木薯光合效率[14];通过测定鳞茎内养分含量及相关酶活性也表明CC可促进石蒜(Lycoris radiata)小鳞茎膨大[15]。复硝酚钠(CSN)及其制剂,能有效增强细胞质的流动性,对于调控药用植物、蔬菜等的生长发育和提高产量效果显著,尤其在根茎的生长和发育中发挥着重要的作用。在适宜范围内,CSN还可消除由吲哚乙酸(IAA)形成的顶端优势,利于腋芽等侧芽的生长,是国际粮农组织(FAO)指定为绿色食品工程推荐的植物生长调节剂。马铃薯(Solanum tuberosum)块茎形成初期喷施CSN,能显著增加块茎干物质积累[16]。当NMP和CC联合使用时,可以提高植物的整体光合能力等促生能力,能够更好地促进离体根茎的生长,提高其生长速率和生产效率。本实验拟在前期课题组已筛选出温郁金适宜生根培养基的基础上,添加广谱性植物生长调节剂CC和CSN等,诱导温郁金试管微根茎形成,并以常规组培苗为对照,将根茎组培苗进行盆栽,观测组培苗不同时期的生长势,初步构建温郁金微根茎组培体系,旨在为后续微根茎诱导优化、生产微根茎繁育种苗、利用微根茎生产莪术挥发油等目标次生代谢物以及研究根茎发育机制等提供理论依据和基础技术体系。
-
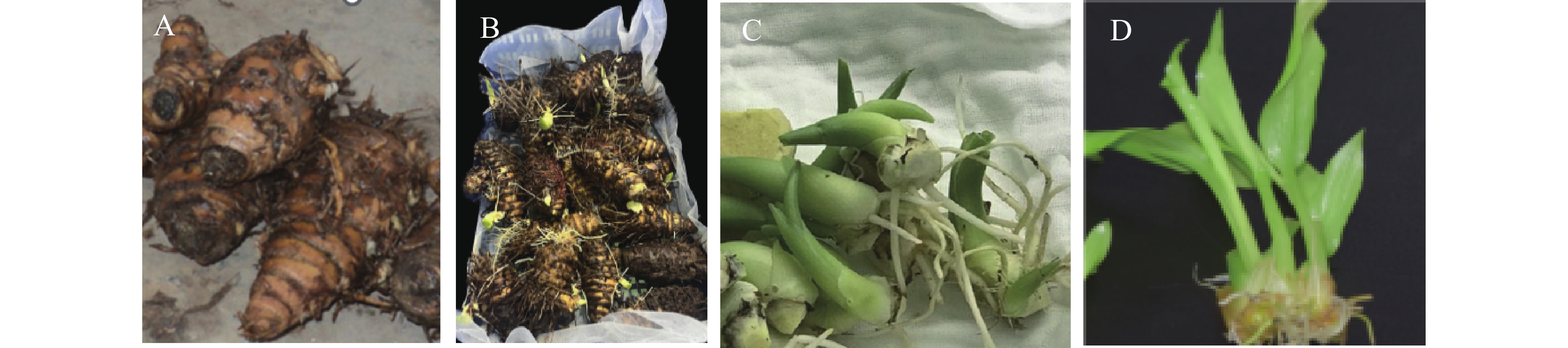
于2023年12月选取引种已适应海南地区生态环境、健康、丰产的温郁金优株为外植体母株。根茎采集时,尽量避免伤口并保持根茎的完整性,清洗干净后带回实验室晾干备用。以清水浸泡10 min的新鲜根茎为对照CK,将供试根茎用广谱杀菌剂多菌灵(有效含量50%可湿性粉剂)0.1%(w/w)溶液进行初步表面消毒10 min,每组20个根茎外植体,然后将2组根茎置于(25±2) ℃光照培养箱中进行催芽。待芽长到2~3 cm时,分别切取萌芽进行表面消毒:先用70%(V/V)乙醇消毒45 s,无菌水冲洗2次,再用2%(V/V)次氯酸钠消毒15 min,无菌水冲洗5次,然后把含生长点的萌芽上半部叶片切除,留芽长约1 cm,将单芽纵切成2块,插接于培养基上进行初代芽启动诱导,7 d后统计外植体接种污染情况。获得的初代无菌芽继代增殖3~4次后,以温郁金第4~5代组培芽作为离体根茎诱导的培养材料(图1)。
-
课题组前期研究显示,温郁金组培芽在壮根培养基1/2MS+NAA 0.5 mg·L−1条件下生根良好,但未曾见到微根茎分化[4]。本实验中,将温郁金增殖丛芽剔切成单芽,并将每个芽苗基部多余的组织、不定根和上部鞘叶切除,修整成保留生长点、约3 cm的单个芽苗,以单芽插接的方式转接至根茎诱导培养基上(表1)培养。30 d后,根据微根茎诱导率、微根茎数(条·株−1)、微根茎的生长和形态以及生根状态等,进行微根茎诱导适宜植物生长调节剂的初步筛选。
培养基
Medium培养基配方
Medium formulaZ1 1/2MS+0.5 mg·L−1NAA Z2 1/2MS+0.5 mg·L−1NAA+2.0 mg·L−1 CC Z3 1/2MS+0.5 mg·L−1NAA+2.0 mg·L−1 CSN 注:以上培养基均添加30 g·L−1 蔗糖、2.3 g·L−1植物凝胶,pH5.8。 Note: All the above media were supplemented with 30 g·L−1 sucrose and 2.3 g·L−1 phytagel, and the pH was adjusted to 5.8. Table 1. Screening of plant growth regulators for inducing in vitro rhizomes of Curcuma wenyujin
微根茎诱导率=(诱导出微根茎的芽数/原始接种芽数)×100%。
微根茎数以每株诱导出的微根茎数目为准;微根茎粗度(cm)测量方法:先用水清洗粘在微根茎上的培养基后,使用游标卡尺测量整条微根茎最粗部位,测量中宜拉直以便测量准确;生根数(条/株)以每株诱导出的根数为准,以上微根茎诱导,每瓶接种3个单芽,每个处理10瓶,共30个单芽,重复3次;在
1500 lx光照培养,(25±2) ℃,75%相对湿度的条件下培养,下同。 -
在观测对比不同植物生长调节剂添加对温郁金组培芽离体微根茎诱导的初步效果后,在培养基中复合添加不同质量浓度的CC(1.0、2.0、3.0 mg·L−1)和CSN(1.0、2.0 、3.0 mg·L−1),进行两因素三水平正交试验,进一步对根茎分化培养基进行优化(表2)。培养30 d后,微型根茎诱导率、微根茎数以及微根茎粗(mm)等生长和形态指标观测如1.2.1,以上指标再结合组培芽增殖和生长状态进行微根茎分化培养基优化选择。其中,根茎长(cm)、根长(cm)、根茎粗(mm)以游标卡尺测量。
培养基
Medium添加植物生长调节剂/(mg·L−1)
Plant growth regulators/(mg·L−1)NAA CC CSN F1 0.5 1.0 1.0 F2 0.5 1.0 2.0 F3 0.5 1.0 3.0 F4 0.5 2.0 1.0 F5 0.5 2.0 2.0 F6 0.5 2.0 3.0 F7 0.5 3.0 1.0 F8 0.5 3.0 2.0 F9 0.5 3.0 3.0 Table 2. Screening and optimization of in vitro rhizome differentiation media for Curcuma wenyujin
组培芽增殖系数=接种30 d后芽的总数/原接种芽数。
-
以常规组培生根苗为对照(培养基为1/2MS+NAA 0.5 mg·L−1),将对照组、筛选出的根茎分化培养基培养出具根茎的组培苗同时直接移栽至盛有等体积的蛭石和营养土的小盆中,散射光下缓苗10 d。然后,将盆栽苗置于正常光照下培养,视天气情况每盆定量浇灌去离子水,每月用稀释
1000 倍的可溶性肥溶液定量浇灌1次,培养第30天统计存活率,在第31~40天间测定植株高度绝对生长速率AGR(mm·d−1),第60天观测统计组培苗的植株萌发叶数和分蘖(片或个·株−1)以及称量地下部质量(g,含根茎和块根)等生长情况。其中,移栽成活率=(成活植株数/移栽总植株数)×100%,AGR为10 d的平均值;地下根茎和块根的质量(g)以天平称重测量。 -
采用Excel 2007软件录入并整理数据,利用SPSS 23.0软件进行方差分析。
-
获得无菌外植体是确保植物组织培养成功的核心要素之一,创建简便快捷又高效的外植体消毒方法,对于提高植物组织培养的效率和成功率尤为关键[17]。如表3所示,温郁金根茎在光照培养箱中培养30 d,均能正常萌发新芽,切取新萌芽作为外植体进行初代芽启动诱导。培养一周后,以清水浸泡10 min的对照根茎萌芽外植体约1/3受真菌污染,而经0.1%(w/w)多菌灵溶液消毒10 min的根茎萌芽外植体污染率仅10%左右,比对照的显著降低68.4%,且培养基清澈,初代芽生长壮实。2组处理中未受污染的外植体在芽启动培养基上培养至第30天,其初代芽诱导率无显著差异,均在90%以上。综上,用0.1%(w/w)多菌灵溶液对根茎进行10 min消毒预处理,能明显提高温郁金根茎萌芽外植体的初代芽启动诱导效率。
萌芽外植体类型
Types of sprouted explants污染率/%
Contamination
rate芽诱导率/%
Bud induction
rate无菌芽生长状态
Growth state of contamination-free buds清水浸泡根茎萌发
Germination of rhizomes
soaked in clear water32.6±4.6a 93.4 ±5.7a 新芽正常;部分受真菌污染的芽很快褐坏或死亡。
The new buds are normal; some of the buds contaminated
by fungi turn brown and die quickly.多菌灵消毒根茎萌发
Germination of rhizomes disinfected
with carbendazim10.3±3.1b 91.5 ±3.2a 新芽茁壮,生长良好,培养基清澈。
The new buds are robust and growing well,
and the culture medium is clear.注:表中同一列数字不同小写字母表示差异达到显著水平(P<0.05),下同。 Note: Different lowercase letters in the same column indicate a significant difference (P < 0.05) similarly hereinafter. Table 3. Influence of different root and stem pretreatments on disinfection effect of sprout explants
-
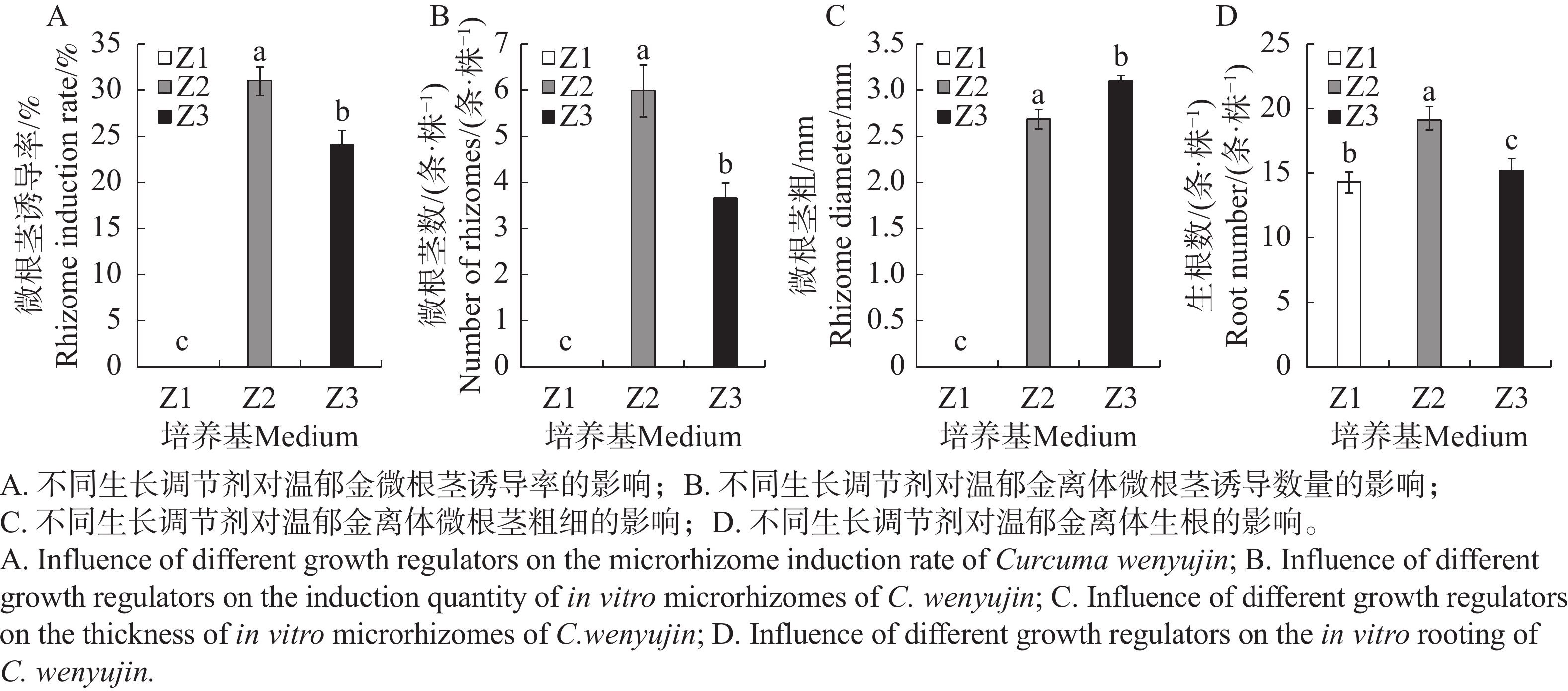
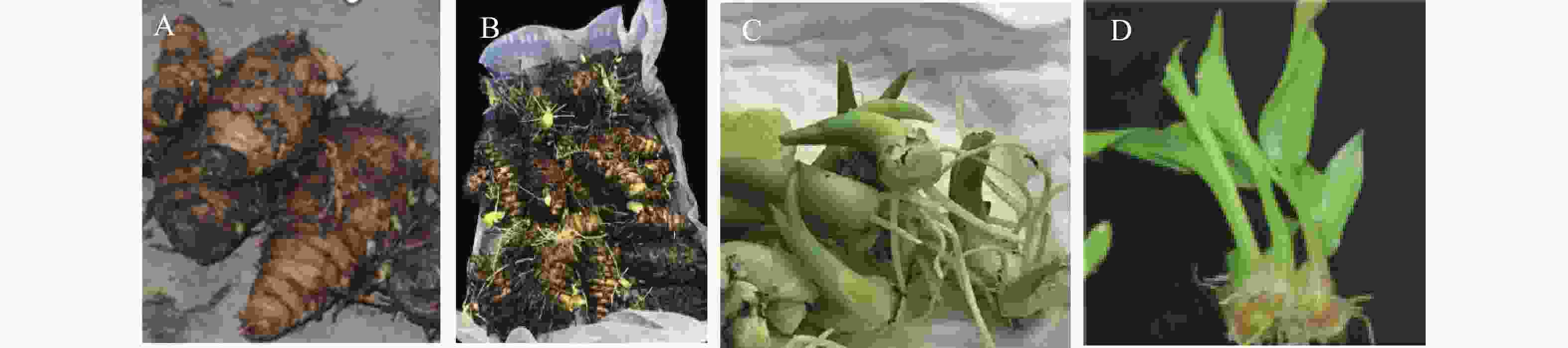
CSN、CC均是一类集营养、调节、预防为一体的环保型广谱性植物生长调节剂,具有加快根系发育、提高光合效率以促进光合产物积累到块茎、块根中的功能特点。如图2和表4所示,在只有添加NAA的Z1生根培养基中,温郁金组培生根良好,但未能诱导分化出根茎;在NAA的基础上,分别额外添加了2.0 mg·L−1 CC或2.0 mg·L−1 CSN的Z2、Z3培养基上,均能诱导出根茎,同时促进生根。CC在根茎诱导率以及增长根茎上作用明显,分别比添加CSN的显著增加17.9%和14.3%,而添加CSN则在促进根茎增粗上作用更显著,比添加CC的显著增加14.8%。
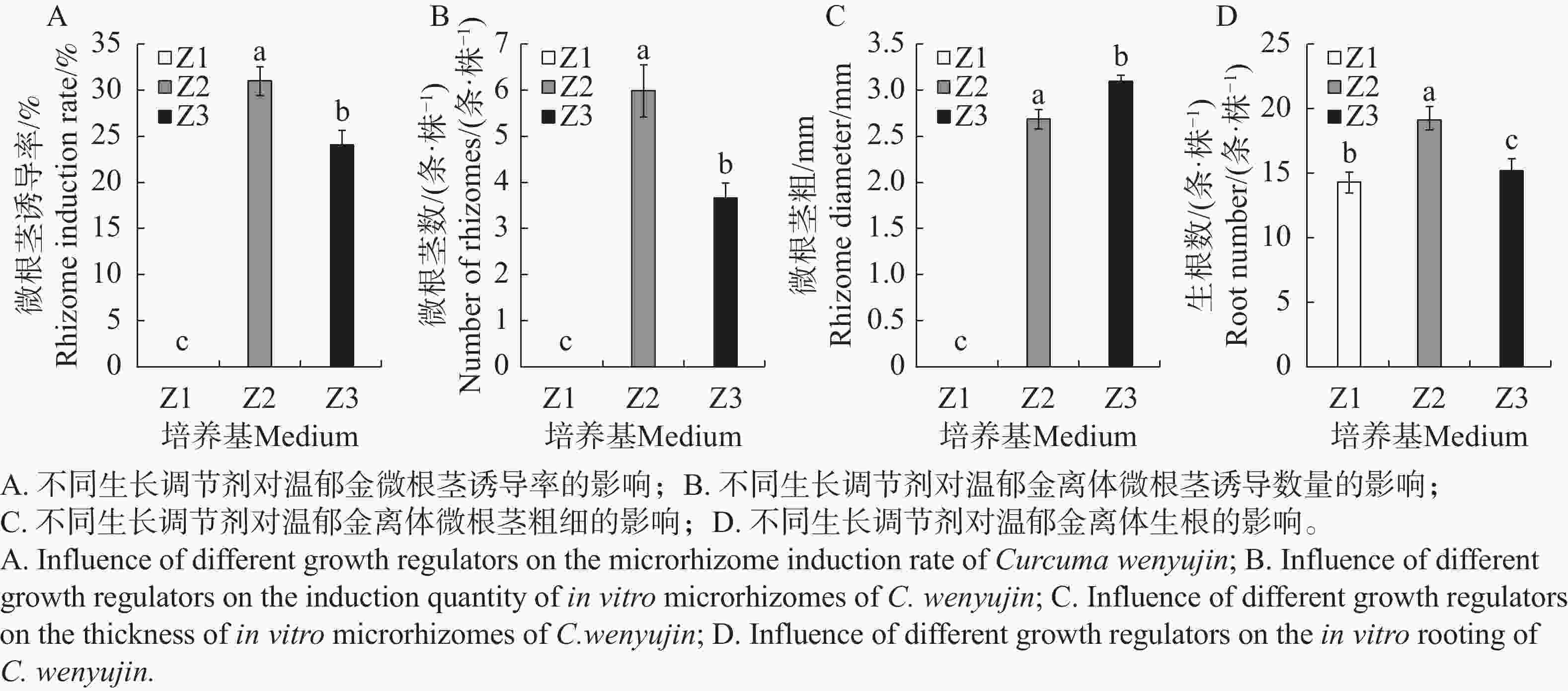
Figure 2. Effects of different plant growth regulators on rooting of tissue-cultured buds and rhizome induction of Curcuma wenyujin
培养基
Medium微根茎诱导率/%
Microrhizome
induction rate/%微根茎长/cm
Microrhizome
length/cm微根茎粗/mm
Microrhizome
thickness/mm根长/cm
Root
length/cm根粗/mm
Root
thickness/mmF1 − − − 3.2±0.1de 1.1±0.1ef F2 62±1.0a 1.8±0.2a 4.5±0.3b 6.5±0.3a 2.3±0.0b F3 − − − 3.4±0.4d 1.3±0.1ef F4 − − − 4.3±0.1b 0.7±0.2g F5 − − − 4.1±0.2bc 1.1±0.2f F6 20±2.0d 0.9±0.6b 3.1±0.2c 3.5±0.1cd 1.8±0.2c F7 46±2.6b 1.7±0.2a 6.8±0.1a 2.8±0.2e 4.5±0.2a F8 28±0.6c 0.5±0.3c 2.8±0.2c 3.6±0.0cd 1.6±0.0cd F9 − − − 3.4±0.0de 1.4±0.1de 注:表中“−”为该化学成分因含量相对低暂未被检出,下同。 Note: In the table "−" indicates that the chemical component has not been detected temporarily due to its relatively low content, similarly hereinafter. Table 4. Effects of sodium nitrophenolate and choline chloride at different mass concentrations and ratios on the microrhizome differentiation of tissue-cultured plants of Curcuma wenyujin
-
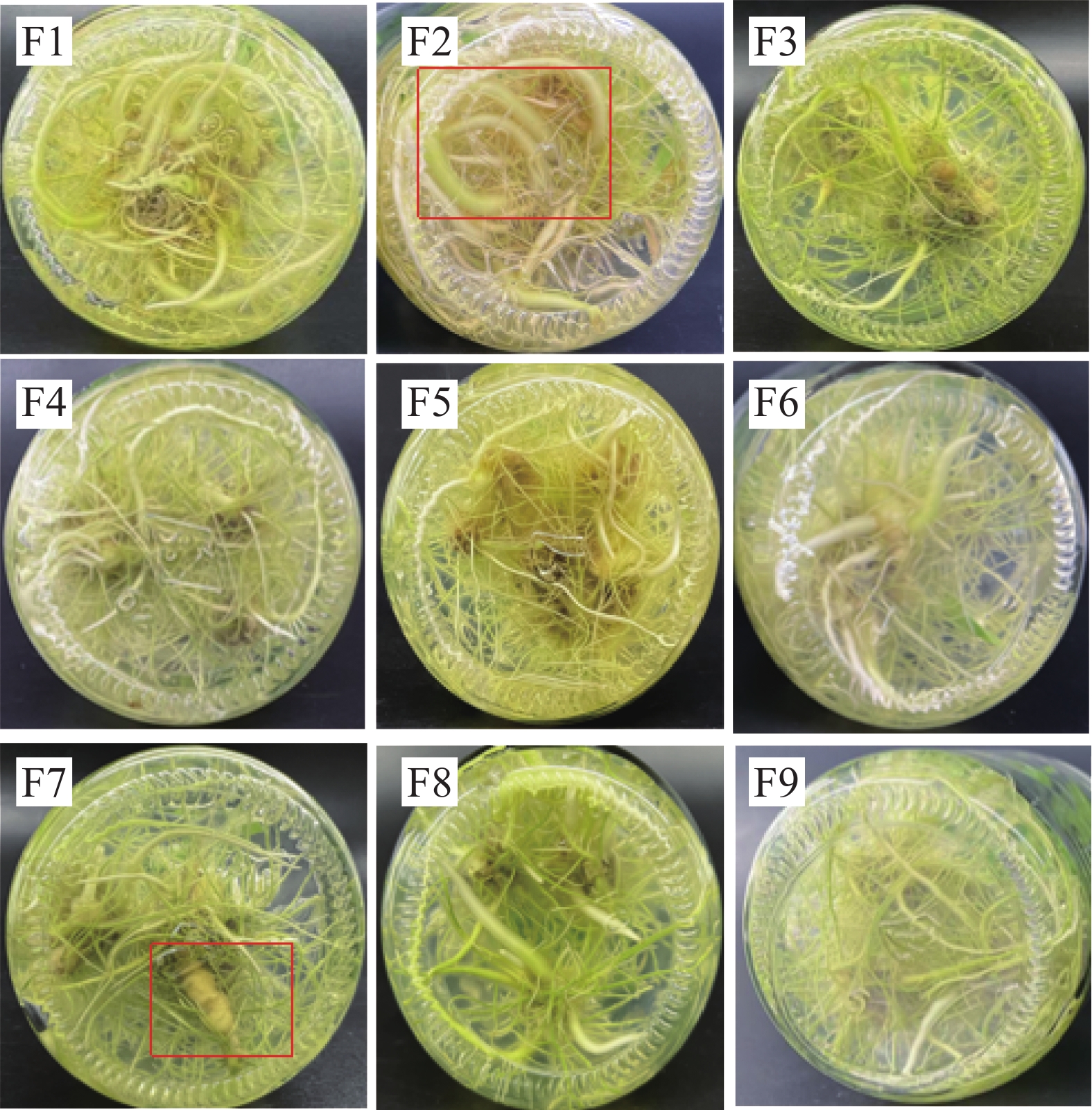
试验表明,添加一定量的CC、CSN,可有效诱导温郁金微根茎的分化。为进一步筛选出适宜的CC和CSN复合添加配比,在原1/2MS+NAA的生根培养基上,添加不同种类(CC、CSN)、不同质量浓度(1.0、2.0、3.0 mg·L−1)的植物生长调节剂进行两因素三水平正交实验。如表4和图3所示,在9组培养基中,都能诱导生根,无明显主根,但诱导分化形成根茎的仅有4种培养基,且相互间诱导率差异显著,以F2培养基诱导率最高,达62%,微根茎诱导率由高到低依次为F2>F7>F8>F6;微根茎的长度和粗度是衡量微根茎生长及产量的关键指标,如表4和图3所示,F2培养基显著促进了微根茎的伸长,与F7培养基间无显著差异,两者显著优于F6、F8培养基,而促进微根茎增粗则以F7培养基最明显,根茎最大处直径6.8 mm,其次为F2,两者均显著高于F6和F8培养基,后两者间无显著差异。综合根茎诱导率、根茎长度和根茎粗,4种培养基诱导效果由大到小依次为F7>F2>F6>F8。
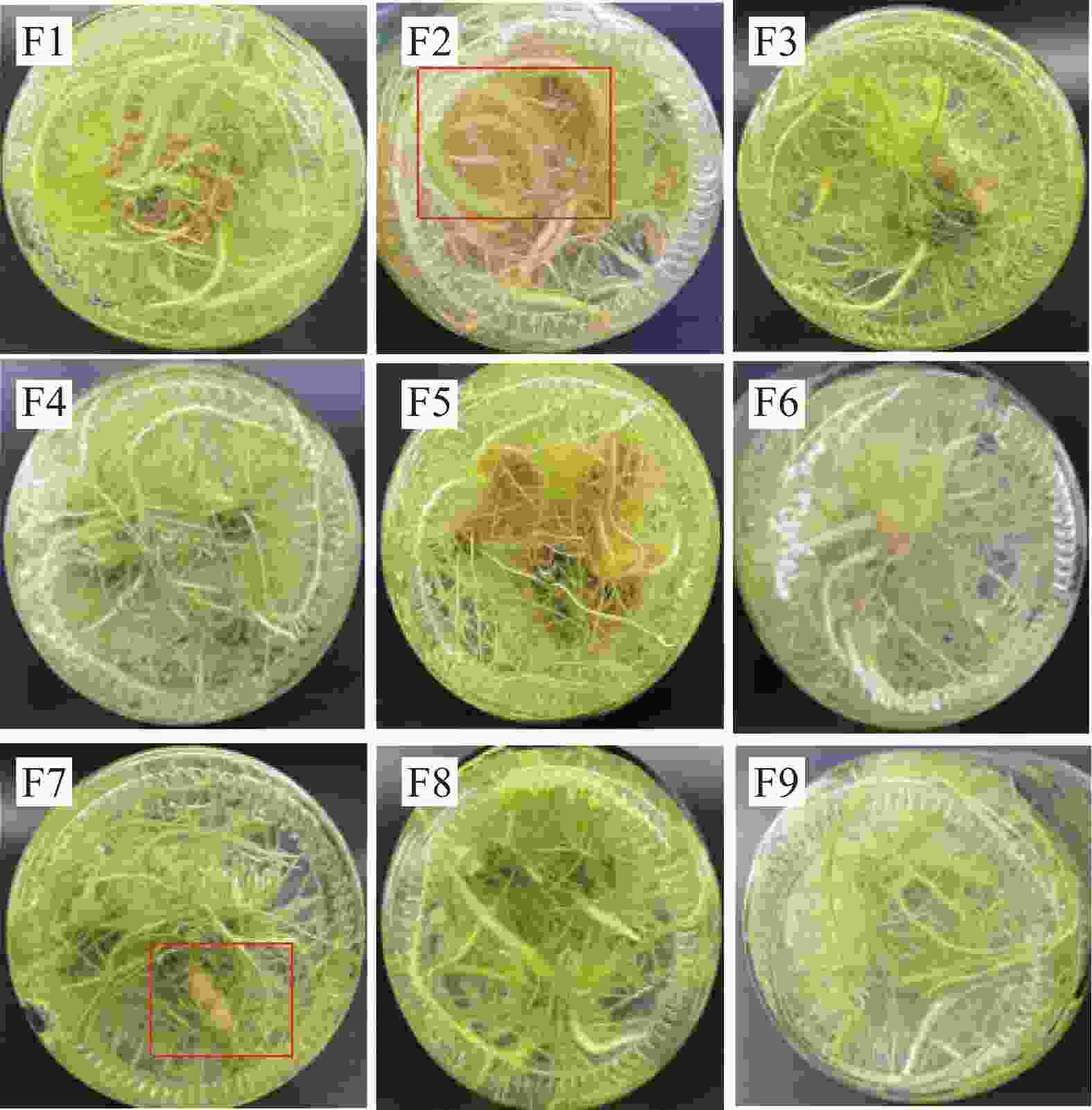
Figure 3. Effects of treatments with different additives on the induction of microrhizome differentiation in Curcuma wenyujin
如表5所示,结合正交实验设计中微根茎诱导实验数据的分析表明,在试验处理水平的选择范围内,比较2种因素的极差 R(23.33>18),影响从大到小为CSN>CC。说明CSN对根茎诱导率的影响大于CC,后续培养基优化中,若以微根茎为主要产品的研发如提取挥发油以及生产人工微型根茎种子等可在添加CSN为主的F2(1.0 mg·L−1 CC、2.0 mg·L−1 CSN)培养基的基础上进行优化,以期得到更多的微根茎产品。
编号
NumberingCC CSN 根茎诱导率/%
Transformation efficiency/%F1 1.0 1.0 − F2 1.0 2.0 62±1.0a F3 1.0 3.0 − F4 2.0 1.0 − F5 2.0 2.0 − F6 2.0 3.0 20±2.0d F7 3.0 1.0 46±2.6b F8 3.0 2.0 28±0.6c F9 3.0 3.0 − K1 62 46 K2 20 90 K3 74 20 k1 20.67 15.33 k2 6.67 30 k3 24.67 6.67 R 18 23.33 注:K和k表示根茎诱导率在各因素不同处理水平下的总值和平均数;R表示根茎诱导率的极差;表中各数据为每个处理的平均值±标准误。 Note: K and k represent the total value and the average value of the range of the induction rate of microrhizomes at different treatment levels of each factor, respectively; R represents the range of the induction rate of microrhizomes. Each figure in the table is the average value ± standard error of each treatment. Table 5. The influence of CC and CSN on the induction rate of microrhizomes
-
植物地上部分与地下部分在生长过程中存在相互依赖、相互促进的关系,同时也可能因资源如水肥不足而表现出相互竞争的关系。如表6所示,添加不同浓度和配比的CSN和CC,温郁金无菌芽生长差别明显。在根茎诱导培养时,在生根培养基1/2 MS+NAA 0.5 mg·L−1的基础上,CC维持在1.0 mg·L−1相对低浓度时,随着CSN浓度从1.0 mg·L−1至3.0 mg·L−1递增,无菌芽基部萌生的新芽呈先升后降趋势,在CC 1.0 mg·L−1/CSN 2.0 mg·L−1时,芽基部萌生新芽的数量最大,与根茎诱导效果一致;CC维持在2.0 mg·L−1,随着CSN浓度的递增,无菌芽基部萌发的新芽在不同CSN质量浓度间并无显著差异;在CC 维持在3.0 mg·L−1,随着CSN质量浓度的递增,无菌芽萌生无显著差异,但芽长势逐渐细弱,CSN 添加1.0 mg·L−1时,芽体粗壮,与根茎诱导效果一致,萌芽数在添加CSN为1.0 mg·L−1和2.0 mg·L−1时,两者间无显著差异,但3.0 mg·L−1时萌芽数明显减少且生长细弱。综上,在1/2 MS+NAA 0.5 mg·L−1的生根培养基基础上,添加CC 1.0 mg·L−1、CSN 2.0 mg·L−1(F2培养基配比)或CC 3.0 mg·L−1、CSN 1.0 mg·L−1(F7培养基配比)时,利于温郁金微根茎的诱导分化,并能维持着有一定量新芽正常萌发。
培养基
Medium增殖系数
Proliferation coefficient芽生长状态
The growth state of the budsF1 3.7±0.4d 芽生长正常,叶绿色
The buds are growing normally and the leaves are green.F2 4.9±1.0ab 芽生长旺盛,粗壮;叶浓绿
The buds are growing vigorously and are robust; the leaves are dark green.F3 3.4±0.9d 芽小,长势差;叶淡绿
The buds are small and have a poor growth trend; the leaves are light green.F4 3.9±0.5bcd 芽正常,生长良好;叶绿色
The buds are normal and growing well, and the leaves are green.F5 3.9±0.9cd 芽小,生长良好;叶绿色
The buds are small but growing well, and the leaves are green.F6 4.8±0.5abc 芽正常,生长良好;叶绿色
Buds are normal and growing well; leaves are green.F7 4.3±0.9abcd 芽生长旺盛,粗壮;叶浓绿
The buds are growing vigorously and are thick and strong. The leaves are deep green.F8 5.6±1.0a 芽多,生长一般;叶浓绿
There are many buds, and their growth is average; the leaves are dark green.F9 4.2±0.6cd 芽细弱;叶淡绿
The buds are thin and weak; the leaves are light green.Table 6. Effects of supplement of sodium nitrophenolate and choline chloride at different concentrations on the proliferation of contamination-free buds of Curcuma wenyujin
-
植物的地上部和地下部存在着物质交换、协同生长的关系,根茎可增强植物地下部的营养吸收利用能力,助力地上部光合产物合成和高效输送至地下部又促进根茎的生长。如表7和图4所示,与温郁金常规生根组培苗相比,具根茎的组培生根苗能明显提高其移栽效率以及不同时期的生长势,与对照常规组培生根苗的相比,具根茎组培苗的存活率、生长速率、分蘖数、新增叶片数和地下根及根茎重量分别显著提高36.4%、112.5%、83.0%、103.9%和83.2%。综上,具根茎的组培生根苗能有效简化组培苗驯化移栽和促进生长。
种苗类型
Plant type存活率/%
Survival
rate生长速率/(mm·d−1)
Growth rate分蘖数/个
Number of
tillers新增叶片/片
Newly emerged
leaves90 d地下根茎及块根/(g·株−1)
Underground rhizomes and
tuberous roots after 90 days常规生根组培苗
Conventional rooted tissue culture plants73.3±5.8b 0.8±0.1b 5.3±0.6b 10.3±0.6b 18.4±0.8b 具根茎组培苗
Tissue cultured plants with rhizomes100±0.0a 1.7±0.3a 9.7±1.5a 21.0±3.6a 33.7±1.3a 注:具根茎的组培苗为F7培养基培养的具根茎组培苗。 Note: The tissue-cultured plants with rhizomes refer to those cultured on medium F7. Table 7. Growth status of transplanted Curcuma wenyujin plants after different Treatments
-
根茎是植物地下变态茎的一种,具养料贮藏、地上部分和地下部分营养物质交换通道的功能,是根茎类植物的主要收获产品和常规繁殖材料。优质种苗是根茎收获产品高产优质的前提,离体快繁生产组培苗是繁育良种壮苗的有效途径之一。在药用植物离体培养中,通过添加适度配比的不同种类和浓度的植物生长调节剂,增产的同时还提升药材中的有效成分含量。如姜科姜黄属药用植物芒果姜(Curcuma Roxb.)利用微根茎组培苗大田栽种,提高生产效率,且与外植体母株的相比,组培苗栽种收获的根茎中的药用有效化学成分、含量和质量均保持了母株的稳定性,在疗效活性上同样稳定,促进其产业可持续发展[18-19]。适度多效唑和膨大素协同处理可显著提升地黄产量及叶片中毛蕊花糖苷等有效活性成分含量[20]、水杨酸(SA)促进山葵(Wasabia japonica)试管根茎的伸长、膨大和质量等[21]。研究表明,温郁金利用组培苗种植,不但能保持优良种质遗传稳定、提高生产效率,也提高了其药材质量,以组培苗种植收获的根茎中,主要成分莪术挥发油中的主要有效药用活性成分吉马酮、莪术二酮、姜黄素等均高于相应的普通温郁金[3,22]。本实验对温郁金的根茎诱导形成进行研究,提优种苗质量,推行良种良法助力GAP规范化及品质改良等具有重要意义。
CSN有利于促进细胞分裂与膨大,从而促进根茎的生长与发育,对番茄(Lycopersicon esculentum)施加合适浓度的CSN可促进地下部生物量的分配效果优于地上部[23];CC具有促进光合成作用而使植株次生代谢产物合成增加,促进根系发育,有助于光合作用产物高效输送至地下储存器官,从而显著增加块根、块茎的产量、改善品质[24]。本实验中,在MS+0.5 mg·L−1 NAA的条件下,单一添加CC或CSN均能诱导出温郁金试管微根茎,但以复合添加1.0 mg·L−1 CC、2.0 mg·L−1 CSN时,微根茎诱导率最高,达62%;而添加 3.0 mg·L−1 CC、1.0 mg·L−1 CSN时,对促进微型根茎膨大作用最明显,微根茎的茎粗可达6.8 mm。综合根茎诱导率、根茎长和根茎粗等指标的观测,结合9种(F1~F9)诱导根茎分化的正交实验数据的直观分析,可以发现,CC对诱导根茎的影响相对大于CSN。在F2培养基(1/2MS+0.5 mg·L−1 NAA+1.0 mg·L−1 CC+2.0 mg·L−1 CSN)和F7培养基(1/2MS+0.5 mg·L−1 NAA+3.0 mg·L−1 CC+ 1.0 mg·L−1 CSN)条件下,温郁金组培芽在诱导根茎形成的同时,依然能维持相对旺盛的芽增殖生长,表明辅以添加1.0~2.0 mg·L−1 CSN,可能利于解除多营养元素间的拮抗,提高组培芽对营养元素的吸收和转运或有助于一定程度消除IAA引起的顶端优势,维持一定量腋芽的增殖,将利于根茎组培苗或试管微根茎产品的良性循环生产。与普通生根组培苗相比,根茎组培苗在移栽存活率以及根茎和块根的产量上也呈现出更强的生长势。在生姜生产中,尽管复硝酚钠和DA-6均能显著提高生姜产量,但不适宜的配施对生姜产量的交互效应为负值[24],在IBA和CC单独及配合使用对木薯光合作用的影响中也类似[16]。本试验中,CC均为3.0 mg·L−1时,随着CSN质量浓度升高 (F7、F8、F9),根茎粗度明显递减,可能也存在着复合添加CC、CSN高于一定质量浓度时会存在交互效应为负值的情况,有待进一步的实验研究。
综上所述,在温郁金组培生根培养基1/2MS+NAA 0.5 mg·L−1+蔗糖30 g·L−1,pH5.8的条件下,复合添加适度的CC和CSN,两者能相辅相成地有效诱导温郁金试管微根茎的发生和膨大,其组培苗微根茎的形成既有效简化组培苗移栽环节又增强了植株生长势,整体提高了温郁金种植生产效率。本实验结果中,F7(1/2MS+0.5 mg·L−1NAA+3 mg·L−1CC+1 mg·L−1CSN+椰子水5%+蔗糖30 g·L−1+ 植物凝胶 2.3 g·L−1,pH5.8)培养基对于微根茎增粗的效果更为明显,适宜进一步优化以生产微根茎提取目标次生代谢产物以及根茎膨大机制等研究应用,而F2(1/2MS+0.5 mg·L−1NAA+1 mg·L−1CC+2 mg·L−1CSN+椰子水5%+蔗糖30 g·L−1+植物凝胶 2.3 g·L−1,pH5.8)培养基诱导微根茎发生率更高,适宜建立高效、稳定的温郁金脱毒微根茎组培苗工厂化生产、种质提纯复壮等应用。下一步研究将根据不同培养目的,结合微根茎诱导率、生长速率、根茎形态、产量和内含有效活性成分等综合指标,对不同培养基进一步优化利用以促进温郁金种植提质增效。
In vitro induction of microrhizome in Curcuma wenyujin
DOI: 10.15886/j.cnki.rdswxb.20250012
- Received Date: 2025-01-12
- Accepted Date: 2025-03-18
- Rev Recd Date: 2025-03-12
- Available Online: 2025-03-25
- Publish Date: 2026-01-15
-
Key words:
- Curcuma wenyujin /
- microrhizome /
- induction and formation /
- transplantation efficiency /
- rhizome
Abstract: In order to improve the propagation efficiency of Curcuma wenyujin plants, tissue cultured plants of C. wenyujin was cultured on in vitro rooting medium (1/2MS + NAA 0.5 mg·L−1) supplemented with broad spectrum plant growth regulators, choline chloride (CC) and compound sodium nitrophenolate (CSN), at different mass concentrations and ratios to induce the differentiation of their microrhizomes, and the growth status of the tissue-cultured plants after transplantation was observed. The results showed that the tissue cultured plants cultured on the medium supplemented with a combination of CC at 1.0 mg·L−1 and CSN at 2.0 mg·L−1 were induced to form microrhizomes obviously, with an inducing rate of 62%. In the medium supplemented with a combination of CC at 3.0 mg·L−1 and CSN at 1.0 mg·L−1, the induction rate was 46%, but the swelling and thickening of microrhizomes were the most obvious, with a transverse diameter of about 6.8 mm. There was no significant difference in the length of microrhizomes between the two groups. All the tissue-cultured rooted plants with microrhizomes survived after transplantation, and their survival rate, growth rate, tiller number, number of new leaves, and the weights of tuberous roots and rhizomes increased by 36.4%, 112.5%, 83.0%, 103.9%, and 83.2%, respectively compared with the control tissue-cultured rooted plants.
| Citation: | Wang Kaixuan, Guo Jiaxin, Chen Jianmiao, Zeng Jinsong, Liang Jing, Li Ying. In vitro induction of microrhizome in Curcuma wenyujin[J]. Journal of Tropical Biology, 2026, 17(1): 66-74. doi: 10.15886/j.cnki.rdswxb.20250012 |






 DownLoad:
DownLoad: