-
随着对果酒发酵微生物的深入了解,各种果酒和发酵饮料中使用的酵母分为酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母(Non-Saccharomyces cerevisiae)两大类[1]。商业酿酒酵母因操作简单、稳定性高而广泛应用在果酒酿造行业中,但同时也导致果酒的风味缺乏多样性和典型性,而非酿酒酵母恰好能弥补这一缺点[2]。目前非酿酒酵母在果酒发酵工程中很受欢迎,因为它们可以使果酒的风味更加丰满、口感更好[3]。香气是果酒品质最重要的方面之一,近年来,非酿酒酵母与酿酒酵母混合发酵方式是一种新兴的改善果酒香气复杂性的策略,非酿酒酵母通常对提高果酒香气的多样性、增强果酒产品的差异性有积极的作用[4]。目前,果酒酿造研究上报道较多的非酿酒酵母有:有孢汉逊酵母(Hanseniaspora uvarum)、布鲁塞尔德克酵母(Dekkera bruxellensis)、库德毕赤酵母(Pichia kudriavzevii)、戴尔有孢圆酵母(Torulaspora delbrueckii)等。非酿酒酵母在提高果酒质量方面有很大的潜力,研究发现酿酒酵母和非酿酒酵母的混合发酵对改善葡萄酒、柑橘果酒、桑葚酒、石榴酒、苹果酒、火龙果酒等果酒质量有巨大的有益影响,混合发酵不仅降低不利的挥发性化合物浓度,还增加有利挥发性化合物,对果酒的香气、感官属性等有一定改善。
戴尔有孢圆酵母(Torulaspora delbrueckii)具有较好的发酵性能,被认为是最适合酿酒的非酿酒酵母。它具有独特的代谢和生理特性,在果酒酿造中有许多潜在的应用价值[5]。戴尔有孢圆酵母通常被用于改变果酒的香气特征,它不仅能够增强果酒的果香,还能通过提高如酯类、酚类等化合物含量来增强果酒的风味[6]。研究发现,戴尔有孢圆酵母和酿酒酵母混合发酵能够提高脐橙酒的果香、花香、甜味,并且挥发性风味物质中的苯乙醇、香茅醇、香芹酚含量最高[7]。戴尔有孢圆酵母发酵纯度高,产生硫化氢等不良挥发性化合物水平低,可降低果酒中乙酸乙酯含量,提高高级醇含量,对乙醇和二氧化硫具有高耐受性[8],增强葡萄酒的花香和果香,因此能够产出优质的果酒[9]。戴尔有孢圆非酿酒酵母与酿酒酵母混合发酵,比纯酿酒酵母发酵的蓝莓酒中的乙醇含量降低1.1%,总花色苷增加27.7%~85.0%,增加蓝莓酒气味中的芳樟醇、玫瑰醚和苯乙醛的含量,这与增强果酒的果香和甜味有关[10]。酿酒酵母与戴尔有孢圆非酿酒酵母混合发酵的白兰地酒比酿酒酵母纯发酵增加4.13%的脂类物质、21.93%的高级醇类物质和52.07%的萜类物质,并提高白兰地酒的主要风味化合物含量[11]。以戴尔有孢圆非酿酒酵母和酿酒酵母采用单一接种、共同接种、顺序接种的方法发酵苹果酒,发现顺序接种显著提高总多酚、黄酮含量,提高抗氧化能力和苹果酒香气的丰富性、多样性[12]。
目前,市场上没有专门发酵哈密瓜果酒的商业酵母,本次试验主要目的是从海南乐东本地哈密瓜表皮上筛选出适合发酵哈密瓜酒的酵母。同时,加强海南乐东本地具有特色的酵母资源充分开发利用,进而提高哈密瓜酒的品质,从而突出当地哈密瓜酒酿造的地方特色。本次试验从乐东县佛罗镇本土的哈密瓜表面的多种微生物中筛选出的一株本土野生酵母,通过生理生化试验、分子生物学试验鉴定出该酵母为戴尔有孢圆非酿酒酵母,对该酵母的生理特征、硫化氢产量、嗜杀性检验进行测定,测试该酵母是否适合果酒发酵条件,并初步验证戴尔有孢圆酵母在哈密瓜果酒的感官品质上的效果,为后续的哈密瓜果酒发酵试验提供理论依据和试验材料。
-
哈密瓜取自于海南省乐东县佛罗镇(18°32′37″N,108°56′26″E)种植基地。
-
称取5 g哈密瓜表皮于20 mL的酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium, YPD)中,在28 ℃摇床中富集培养2~3 d。将培养好的菌液稀释至10−9、10−10,并吸取0.2 mL稀释液分别涂布在YPD固体培养基上,在28 ℃培养箱中培养2~3 d。挑取具有酵母菌菌落特征的单个菌落,用平板划线法反复分离纯化,直到得出纯菌落,将纯化好的菌株置于50%(v/v)甘油中,−80 ℃保存备用。
-
将保持−80 ℃的菌株用接种环接种至YPD液体培养基中,28 ℃摇床进行活化。取0.1 mL活化好的菌液进行稀释涂板,于28 ℃培养箱中培养2~3 d。挑取培养好的单菌落置于载玻片上,并用无菌水进行混匀,盖上盖玻片通过显微镜观察酵母的形态。
-
将保持−80 ℃的菌株用接种环接种至YPD液体培养基中,28 ℃摇床进行活化12~16 h。使用通用基因组DNA提取试剂盒,进行酵母菌株的DNA提取,以酵母DNA为模板,采用酵母18S通用引物ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增,其扩增体系(50 μL)为:Mix 25 μL,模板DNA 0.4 μL,ITS1 1 μL,ITS4 1 μL,dd H2O 22.6 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃再延伸8 min。PCR扩增产物经琼脂糖凝胶电泳检测、纯化,送至擎科生物公司进行测序。将测序的结果提交至NCBI上进行BLAST比对,选择并下载同源性高的序列,采用MEGA11软件构建系统发育进化树。
-
脲酶试验用培养基配方(表1)参考季翠等[13]的方法。取1 mL脲酶试验用培养基分别分装在2 mL的EP管中,接种1%(v/v)的待测菌液,培养1~2 d的酵母菌到EP管中,以不接种酵母菌为空白对照,在37 ℃培养箱中进行培养。每隔30 min观察培养液颜色的变化,如果4 h内培养液呈红色,则为阳性,反之阴性。
药品名称
Drug用量/(g·L−1)
Dosage/(g·L−1)蛋白胨
Peptone1.0 氯化钠
Sodium chloride5.0 磷酸氢二钾
Dipotassium hydrogen phosphate2.0 葡萄糖
Glucose1.0 尿素
Urea20.0 酚红
Phenol red0.008 Table 1. Medium for urease test
-
YM(Yeast malt)培养基配方(表2)参考高兴亮[14]的方法。将待测菌液稀释到10−8,取200 μL的稀释液接种到YM培养基上,以不接种的培养基作为空白对照,放入28 ℃培养箱中培养2~3 d。将DBB(Diazonhm-blue B)染色剂倒入培养好的培养基中,在温室放置1~2 min,如果菌落呈红色为阳性,反之为阴性。
药品名称
Drug用量/(g·L−1)
Dosage/(g·L−1)麦芽浸粉
Malt powder3.0 酵母浸粉
Yeast infusion powder3.0 蛋白胨
Peptone5.0 葡萄糖
Glucose10.0 琼脂粉
Agar powder20.0 Table 2. YM medium
-
糖发酵基础培养基配方参考侯小歌等[15]的方法。将糖发酵基础培养基分装到15 mL试管中,每支试管装10 mL培养液,分别加入2%(w/v)的葡萄糖、乳糖、麦芽糖、蔗糖,每种糖3个平行。配制好后进行高温高压灭菌,室温冷却后,每支试管接种1%(v/v)的戴尔有孢圆酵母菌液,同时以未加入糖类物质的试管作为空白对照,于28 ℃培养箱中培养2~3 d,取200 μL培养好的培养液在酶标仪上测OD600值。
-
碳源同化基础培养基配方参考蒋莉[16]的方法。将碳源同化基础培养基分装到15 mL试管中,每支试管装10 mL培养液,分别加入0.5%(w/v)的葡萄糖、蔗糖、麦芽糖、淀粉、山梨糖醇,每种碳源3个平行。配制好后进行高温高压灭菌,室温冷却后,每支试管接种1%(v/v)的戴尔有孢圆酵母菌液,同时以未加入碳源的试管作为空白对照,于28 ℃培养箱中培养2~3 d,取培养好的培养液在酶标仪上测OD600值。
-
氮源同化基础培养基配方参考闫瑞[17]的方法。将氮源同化基础培养基分装到15 mL试管中,每支试管装5 mL培养液,分别加入0.5%(w/v)的蛋白胨、硫酸铵、硝酸钾、硝酸钙,每种碳源3个平行。配制好后进行高温高压灭菌,室温冷却后,每支试管接种1%(v/v)的戴尔有孢圆酵母菌液,同时以未加入碳源的试管作为空白对照,于28 ℃培养箱中培养2~3 d,取培养好的培养液在酶标仪上测OD600值。
-
挑取单菌落到10 mL的YPD液体培养基中,于28 ℃摇床下培养24 h活化;将活化后的菌液按1%(v/v)的接种量接种到100 mL YPD液体培养基中进行相同条件的培养,每隔2 h测定OD600的菌体浓度。
-
按照1%(v/v)的接种量分别接种于含4%、8%、12%、16%、20%乙醇的YPD液体培养基中,28 ℃条件下培养24 h,测定OD600值,3个平行。
-
按照1%(v/v)的接种量分别接种于pH为2.0、2.4、2.8、3.2、3.6的YPD液体培养基中,28 ℃条件下培养24 h,测定OD600值,3个平行。
-
按照1%(w/v)的接种量分别接种于含100、200、300、400、500 mg·L−1二氧化硫浓度的YPD液体培养基中,28 ℃条件下培养24 h,测定OD600值,3个平行。
-
BIGGY(Bismuth sulphite glucose glycine yeast)试验用培养基配方参考张驰等[18]的方法。将5 μL戴尔有孢圆酵母菌液均匀点样在BIGGY培养基上,28 ℃培养2~3 d,观察酵母颜色,判断该酵母产硫化氢的情况。
-
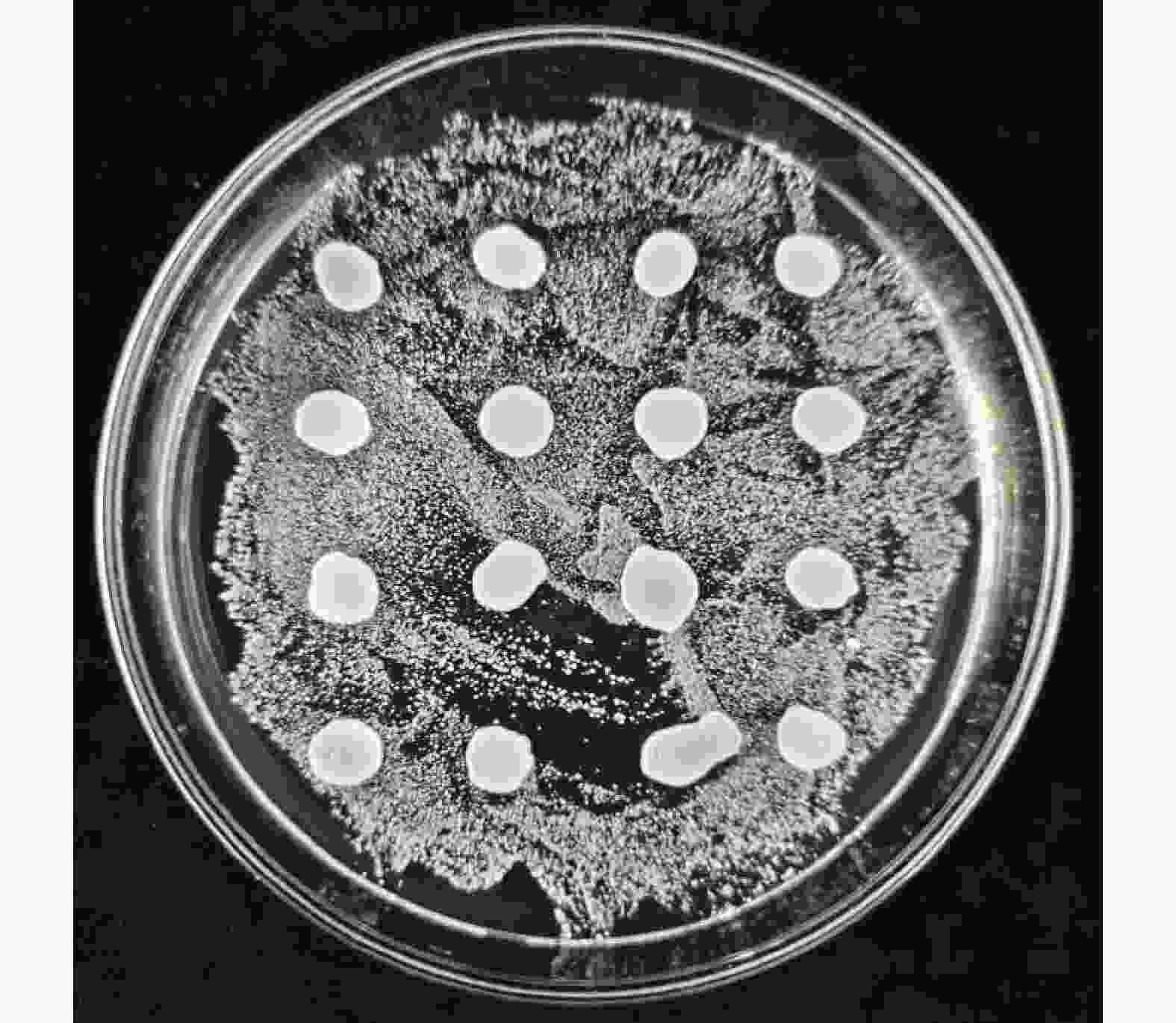
YEPD-MB(Yeast Extract Peptone Dextrose Medium-Methylene blue)试验用培养基配方参考张春芝等[19]的方法。将5 μL戴尔有孢圆酵母菌液均匀点样在涂有酿酒酵母YEPD-MB培养基上,28 ℃培养2~3 d。如果待测菌为嗜杀菌,其周围会形成蓝色的死菌带和透明抑制圈。
-
挑选无病害的哈密瓜,用水清洗干净,将哈密瓜切成小块,放入破碎机中榨浆,通过破碎机破碎的浆汁分装于发酵桶中,每个发酵桶放5 L的哈密瓜浆汁,每个发酵桶分别加入0.01%(w/v)的K2S2O5,静置1~2 h。每个发酵桶分别加入0.5%(w/v)水解酶,酶解1~2 h。最后每个发酵桶分别加入0.2 g·L−1酵母进行发酵。
酵母接种分为3组:(1)Td:只接种戴尔有孢圆非酿酒酵母;(2)MA:只接种MA商业酿酒酵母;(3)T-M:将戴尔有孢圆非酿酒酵母与MA商业酿酒酵母同时接种发酵。共3组,每组3个重复。
本次试验由15名具有果酒品评经验人员进行评分,具体评分细则参考 GB/T 15038—2006《葡萄酒、果酒通用分析方法》。
-
每组试验至少3次重复,采用IBM SPSS Statistics 20软件对试验数据进行统计分析,作图软件为Origin 2024。
-
将筛选出的待测菌株Wild Yeast No.1及MA酿酒酵母在培养基及显微镜(500×)下的形态如图1所示,待测菌株呈现出椭圆形,表面光滑,细胞核明显,以出芽形式进行无性繁殖,其外观形态与MA酿酒酵母没有太大的区别。
-
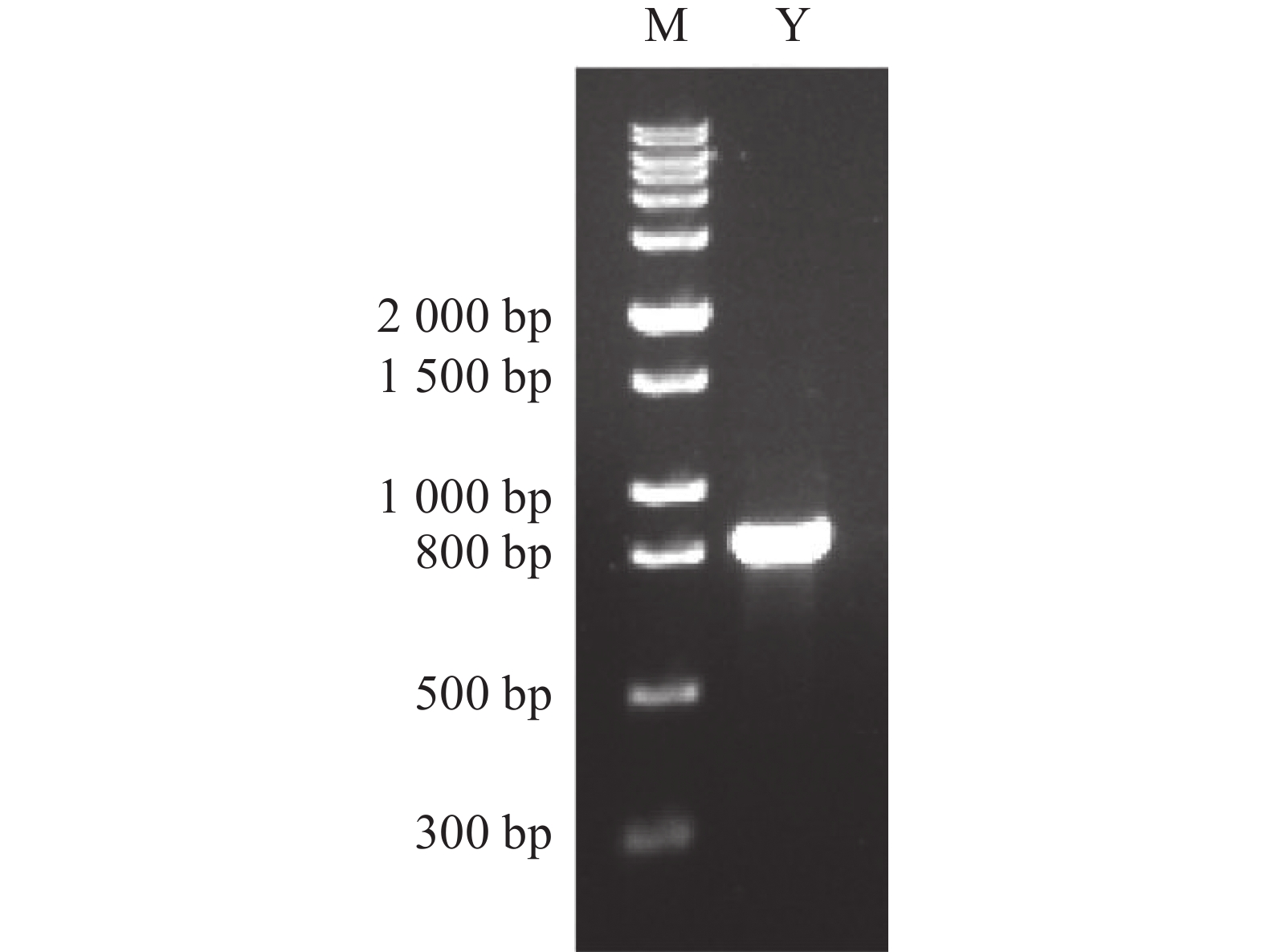
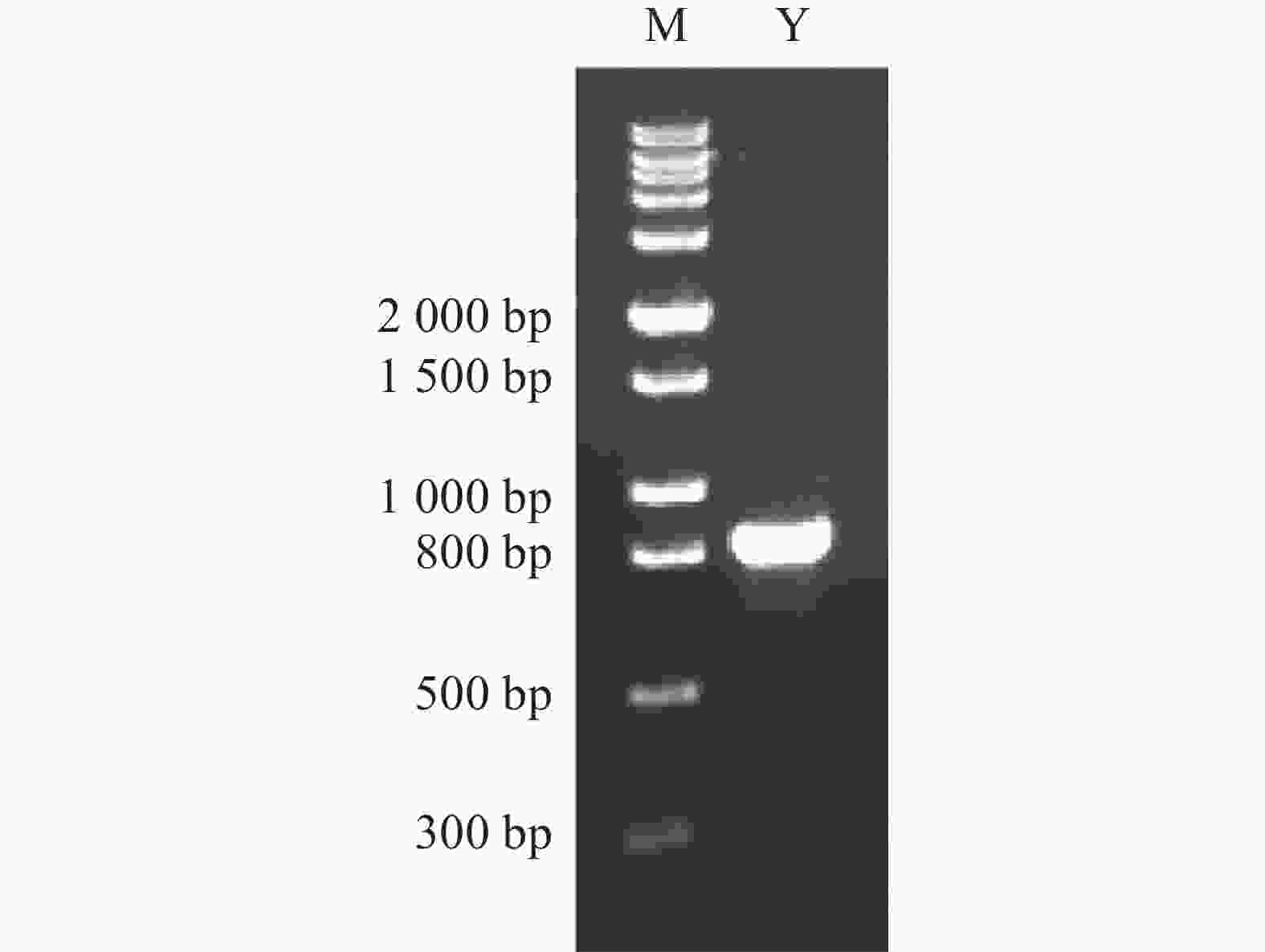
以待测菌株Wild Yeast No.1的DNA为模板进行PCR扩增,根据1%(w/v)的琼脂糖凝胶电泳显示(图2),得到1条800 bp左右的条带,PCR产物送测序结果与其条带大小一致。
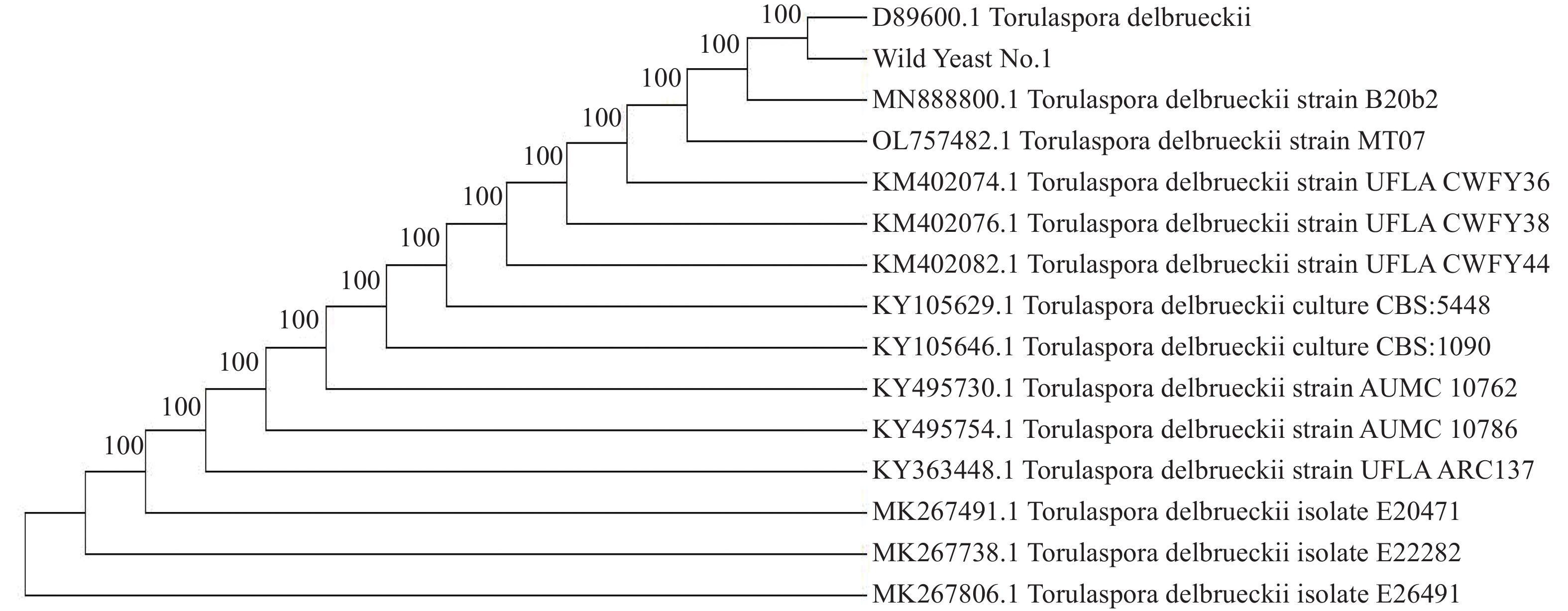
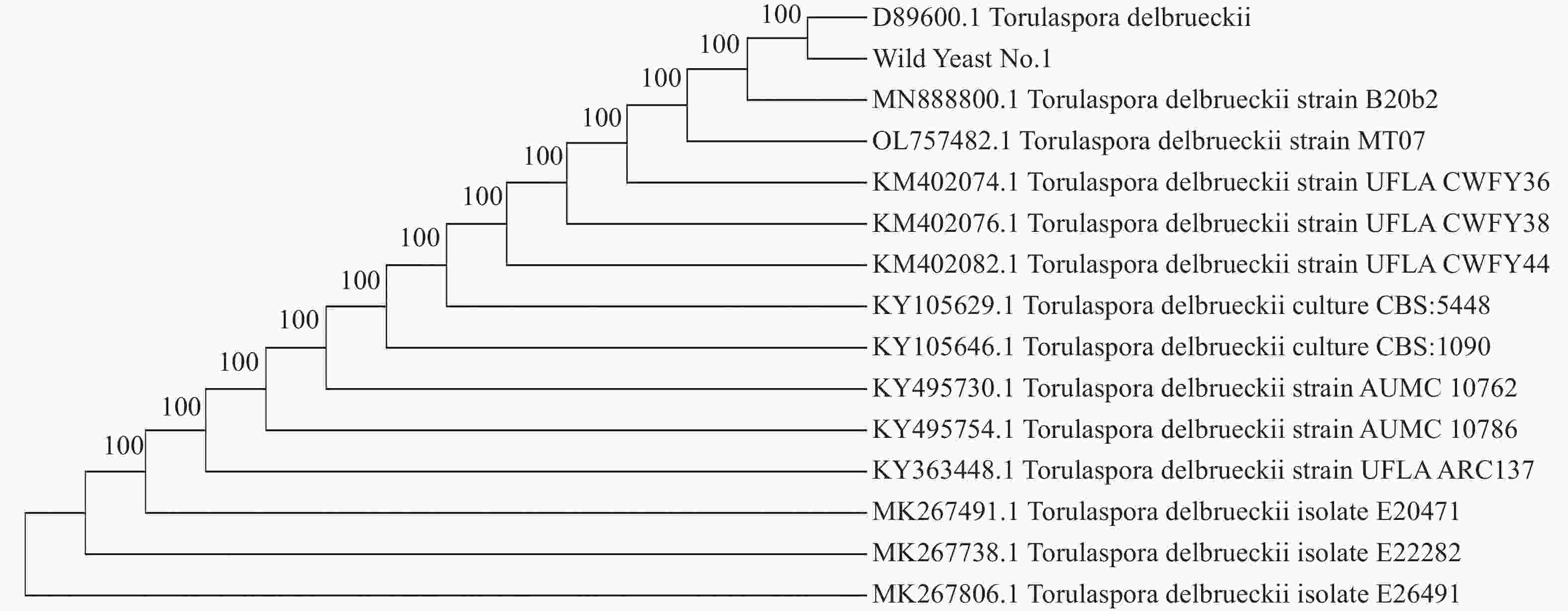
基于18S rDNA测序构建酵母菌株的系统发育树如图3所示,待测菌株Wild Yeast No.1与戴尔有孢圆酵母(Torulaspora delbrueckii)D89600.1聚于同一支,亲缘关系最近,rDNA-ITS序列同源性达到100%。最终鉴定酵母菌株为戴尔有孢圆酵母(Torulaspora delbrueckii)。
-
参照《酵母菌的特征与鉴定手册》[20],对戴尔有孢圆酵母进行脲酶试验检测。在脲酶液体培养基中接种1%(v/v)的戴尔有孢圆酵母菌液,在37 ℃培养箱中放置4 h,期间每隔0.5 h观察培养基颜色是否发生变化。根据接种戴尔有孢圆酵母的脲酶试验用培养基与未接种戴尔有孢圆酵母的空白对照培养基进行比较,其培养液没有呈红色,为阴性。
-
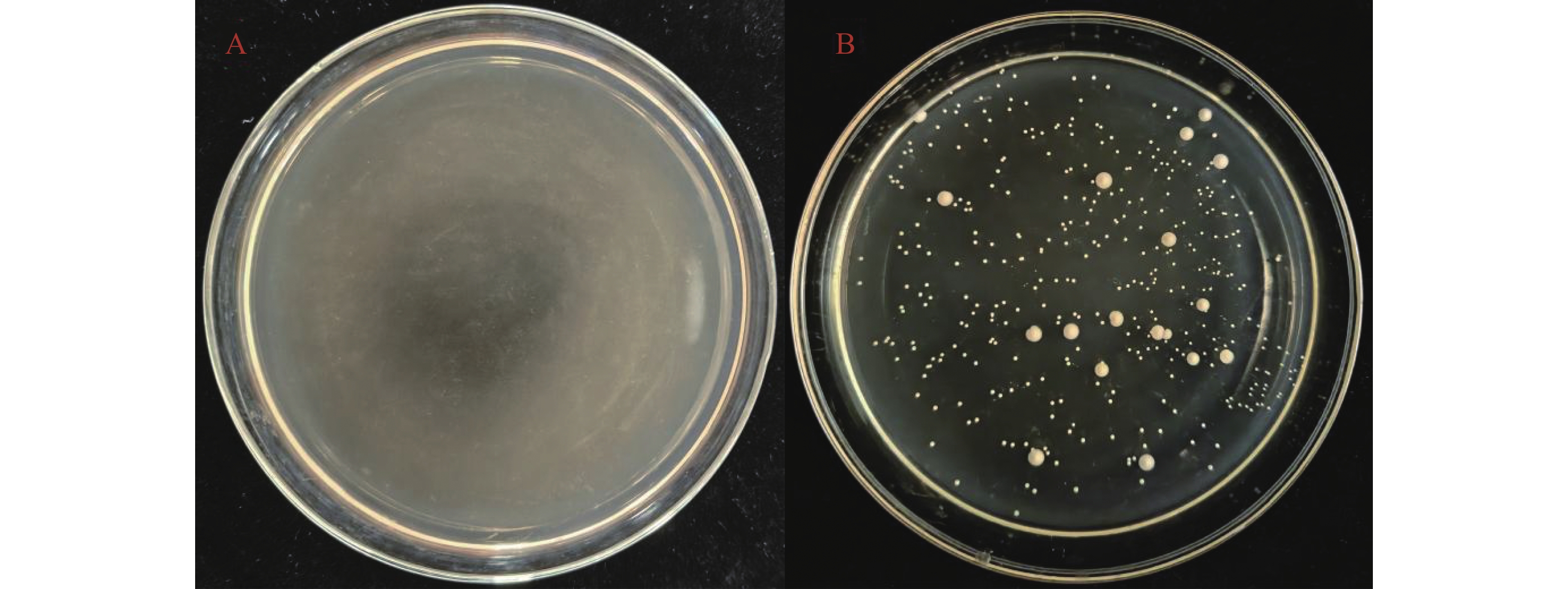
参照《酵母菌的特征与鉴定手册》[20],对戴尔有孢圆酵母进行重氮基蓝B试验检测。将稀释的待测菌液接种到YM培养基上,以不接种的培养基作为空白对照,放入28 ℃培养箱中培养2~3 d。将DBB染色剂倒入培养好的培养基中,在温室放置1~2 min,结果表明,在接种戴尔有孢圆酵母的YM培养基与空白对照培养基进行比较,菌落未变红色,为阴性(图4)。
-
为测定戴尔有孢圆酵母在哈密瓜果酒发酵过程中对发酵体系中糖分的利用情况,进行戴尔有孢圆酵母的糖发酵试验,结果表明,戴尔有孢圆酵母在葡萄糖、乳糖、麦芽糖、蔗糖中均能生长,其中在葡萄糖、麦芽糖、蔗糖生长数量显著较高(表3)。
糖类
Saccharide吸光度
Absorbance生长情况
Growth condition葡萄糖
Glucose1.218±0.067a +++ 乳糖
Lactose0.214±0.102b * 麦芽糖
Maltose1.21±0.071a +++ 蔗糖
Cane sugar1.222±0.023a +++ 注:不同小写字母表示 Ducan 多重比较在 P<0.05 差异显著。*表示微量生长(OD600<0.3);+表示生长(0.3<OD600<0.5);++表示明显生长(0.5<OD600<1,);+++表示大量生长(OD600>1.0)。下同。 Note: Different lowercase letters indicate a significant difference at P<0.05 based on the Ducan multiple comparison.* indicates minimal growth(OD600<0.3); + indicates growth(0.3<OD600<0.5); ++ indicates significant growth(0.5<OD600<1); +++ indicates significant growth(OD600>1.0). Similarly hereinafter. Table 3. Sugar fermentation experiment
-
为测定戴尔有孢圆酵母在哈密瓜果酒发酵过程中对发酵体系中的碳源利用情况,进行戴尔有孢圆酵母的碳源同化试验,结果表明,戴尔有孢圆酵母在葡萄糖、蔗糖、麦芽糖、可溶性淀粉、山梨糖醇中均能生长,其中在葡萄糖中的生长数量显著最高(表4),说明戴尔有孢圆酵对葡萄糖的利用效果最好。
碳源
Carbon source吸光度
Absorbance生长情况
Growth condition葡萄糖
Glucose1.022±0.053a +++ 蔗糖
Cane sugar0.746±0.065c ++ 麦芽糖
Maltose0.866±0.042b ++ 可溶性淀粉
Soluble starch0.247±0.064e * 山梨糖醇
Sorbitol0.454±0.058d + Table 4. Carbon source assimilation experiment
-
为测定戴尔有孢圆酵母在哈密瓜果酒发酵过程中对发酵体系中的氮源利用情况,进行戴尔有孢圆酵母的氮源同化试验,结果表明,戴尔有孢圆酵母在蛋白胨的生长数量显著最高,在硫酸铵、硝酸钾、硝酸钙中的生长量低(表5),说明戴尔有孢圆酵母对蛋白胨的有机氮源利用率高,对无机氮源的利用率较低。
氮源
Nitrogen source吸光度
Absorbance生长情况
Growth condition蛋白胨
Peptone1.156±0.051a +++ 硫酸铵
Ammonium sulfate0.122±0.058ab * 硝酸钾
Potassium nitrate0.081±0.005ab * 硝酸钙
Calcium nitrate0.062±0.014b * Table 5. Nitrogen source assimilation experiment
-
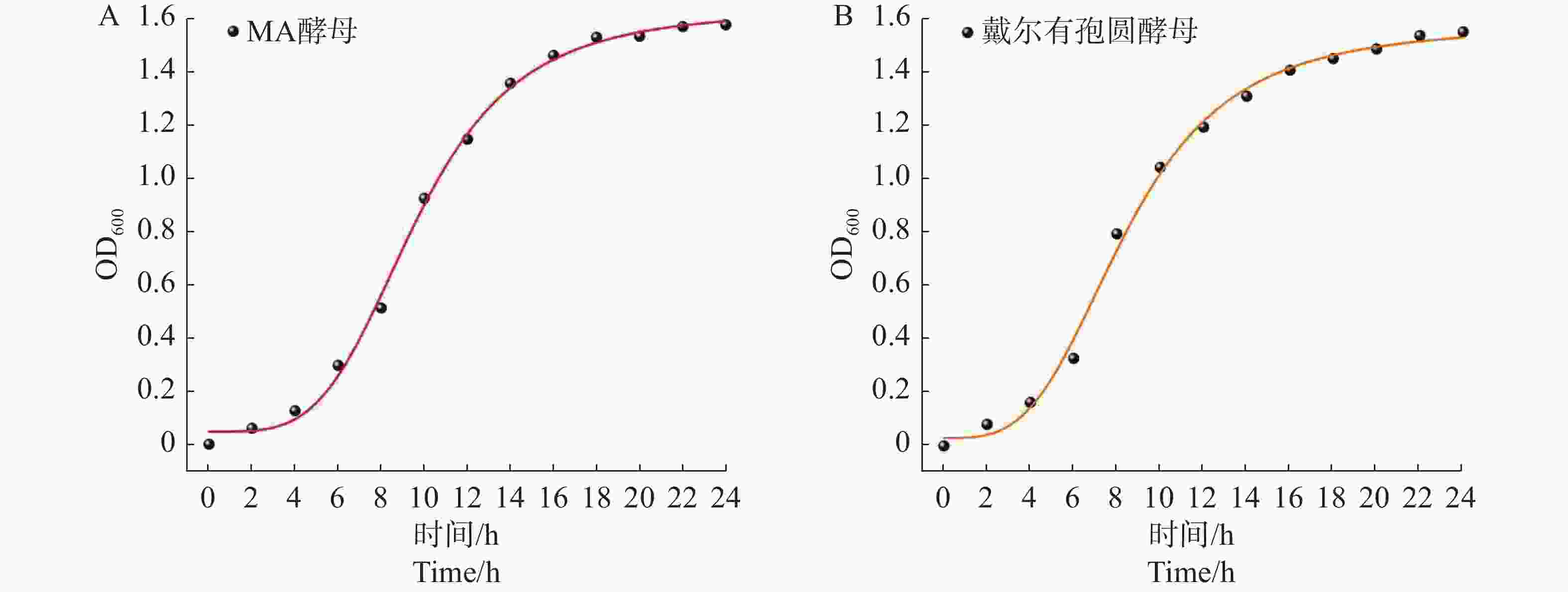
为对酵母菌的生长曲线进行非线性拟合(表6),非线性拟合类型选择Growth,拟合模型选择Logistic。酵母菌生长曲线拟合结果表明,在0~4 h期间,酵母菌的数量均处于缓慢上升阶段;在4~14 h期间,酵母菌的趋于直线快速上升;在14~24 h期间,酵母菌生长速度缓慢上升或逐渐趋于平缓(图5)。
酵母
Yeast拟合方程
Fitting equationR2 MA酵母
MA yeastY=1.633 56+(0.047 94−1.633 56)/[1+(x/9.615 62)]3.974 74 0.997 戴尔有孢圆酵母
Torulaspora delbrueckiiY=1.573 35+(0.030 3-1.573 35)/[1+(x/8.418 43)]3.392 64 0.996 Table 6. Fitting equations for growth curves of yeast strains
-
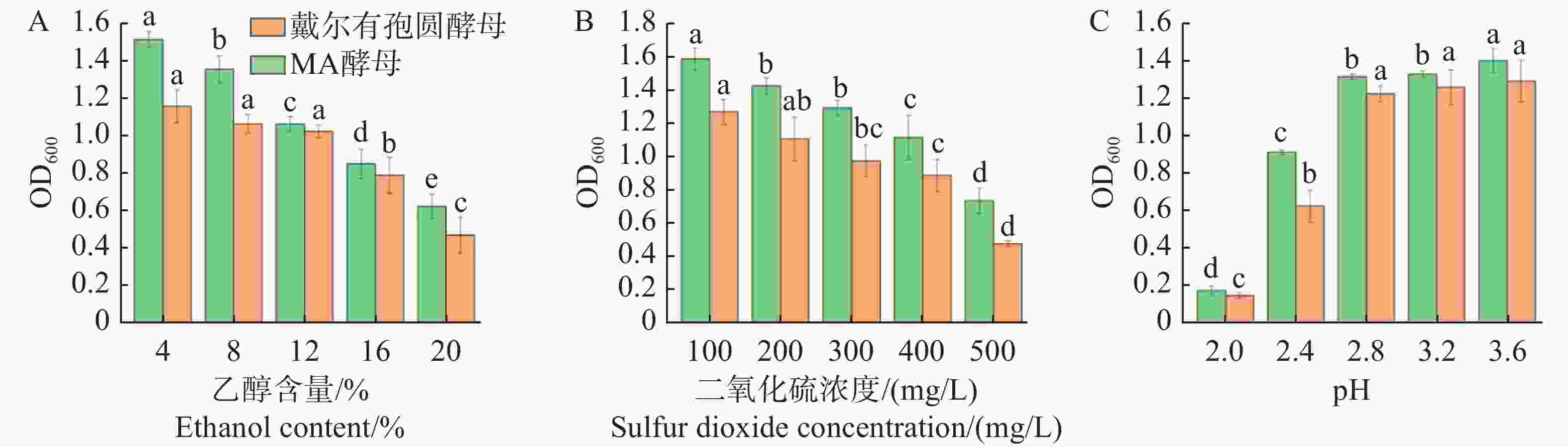
果酒的乙醇含量一般为0~20%,戴尔有孢圆酵母在果酒发酵过程产乙醇环境中的耐受性测定结果表明,戴尔有孢圆酵母在4%~20%的乙醇含量下均能够正常生长,其中在4%的乙醇含量时,酵母生长量达到最高,OD600值为(1.160±0.089);在20%的乙醇含量时,酵母生长量达到最低,OD600值为(0.470±0.097)(图6−A),该酵母能够适应果酒乙醇含量的环境。MA酿酒酵母在4%~20%的乙醇含量之间的OD600值均大于戴尔有孢圆非酿酒酵母,说明该酿酒酵母在乙醇的耐受性方面优于戴尔有孢圆非酿酒酵母。
在加入酵母前一般都会加一些食品级杀菌剂对果汁果肉进行杀菌,而加入的偏重亚硫酸钾会产生二氧化硫杀死杂菌,为避免二氧化硫没有全部排除干净而对之后的酵母产生影响,于是对戴尔有孢圆酵母的二氧化硫耐受性进行研究,结果表明,戴尔有孢圆酵母在100~500 mg·L−1的二氧化硫浓度范围内,酵母都能够正常生长,其中酵母在100 mg·L−1的二氧化硫浓度时,生长量明显最高,OD600值为(1.264±0.075);在500 mg·L−1的二氧化硫浓度时,生长量显著最低,OD600值为(0.470±0.017)(图6−B),虽然果酒酿造时二氧化硫没有全部排除干净,但该酵母并不会因此而不能生长。MA酿酒酵母在100~500 mg·L−1的二氧化硫浓度之间的OD600值均大于戴尔有孢圆非酿酒酵母,说明该酿酒酵母对二氧化硫的耐受性优于戴尔有孢圆非酿酒酵母。
果酒发酵过程中出现低酸环境时,戴尔有孢圆酵母的生长测定结果表明,随着pH值的提高,酵母的生长数量也在不断上升,pH 2.4~3.6,酵母能够正常生长,其中pH 3.6时,酵母生长量最高,OD600值为(1.290±0.112),pH 2.0时,酵母生长量最低,OD600值为(0.138±0.015)(图6−C)所示,该酵母能够适应果酒低pH的环境。MA酿酒酵母在pH 2~3.6时的OD600值均大于戴尔有孢圆非酿酒酵母,说明该酿酒酵母对pH的耐受性优于戴尔有孢圆非酿酒酵母。
通过戴尔有孢圆非酿酒酵母与MA酿酒酵母的耐受性研究,结果表明,MA酿酒酵母在乙醇、二氧化硫、pH耐受性方面均优于戴尔有孢圆非酿酒酵母。酵母的耐受性试验目的主要在于测试野生型戴尔有孢圆非酿酒酵母是否能够在哈密瓜果酒的发酵环境中正常生长,而MA酿酒酵母是经过驯化后培育出来的商业酵母,其耐受性确实优于野生型戴尔有孢圆非酿酒酵母。
-
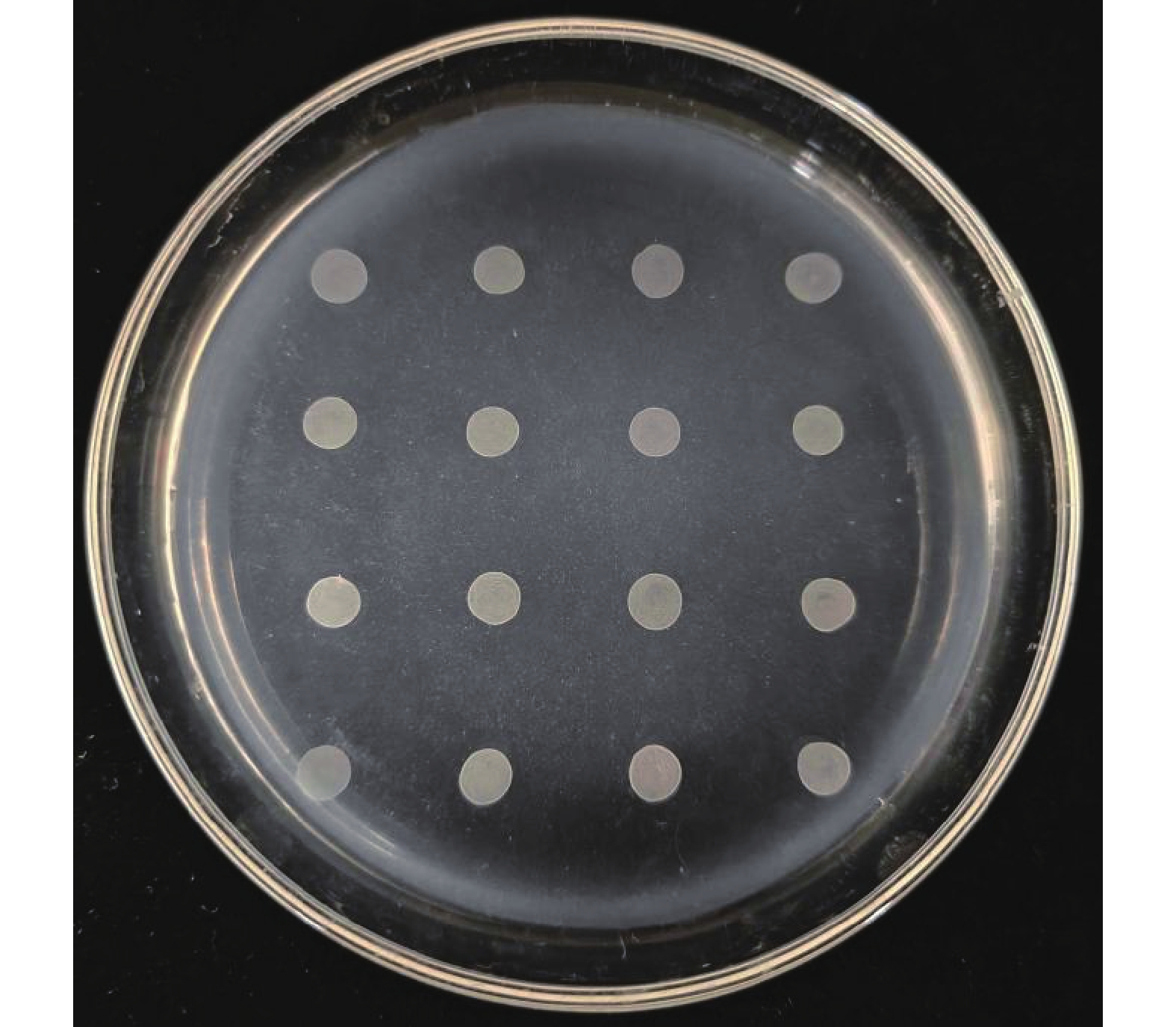
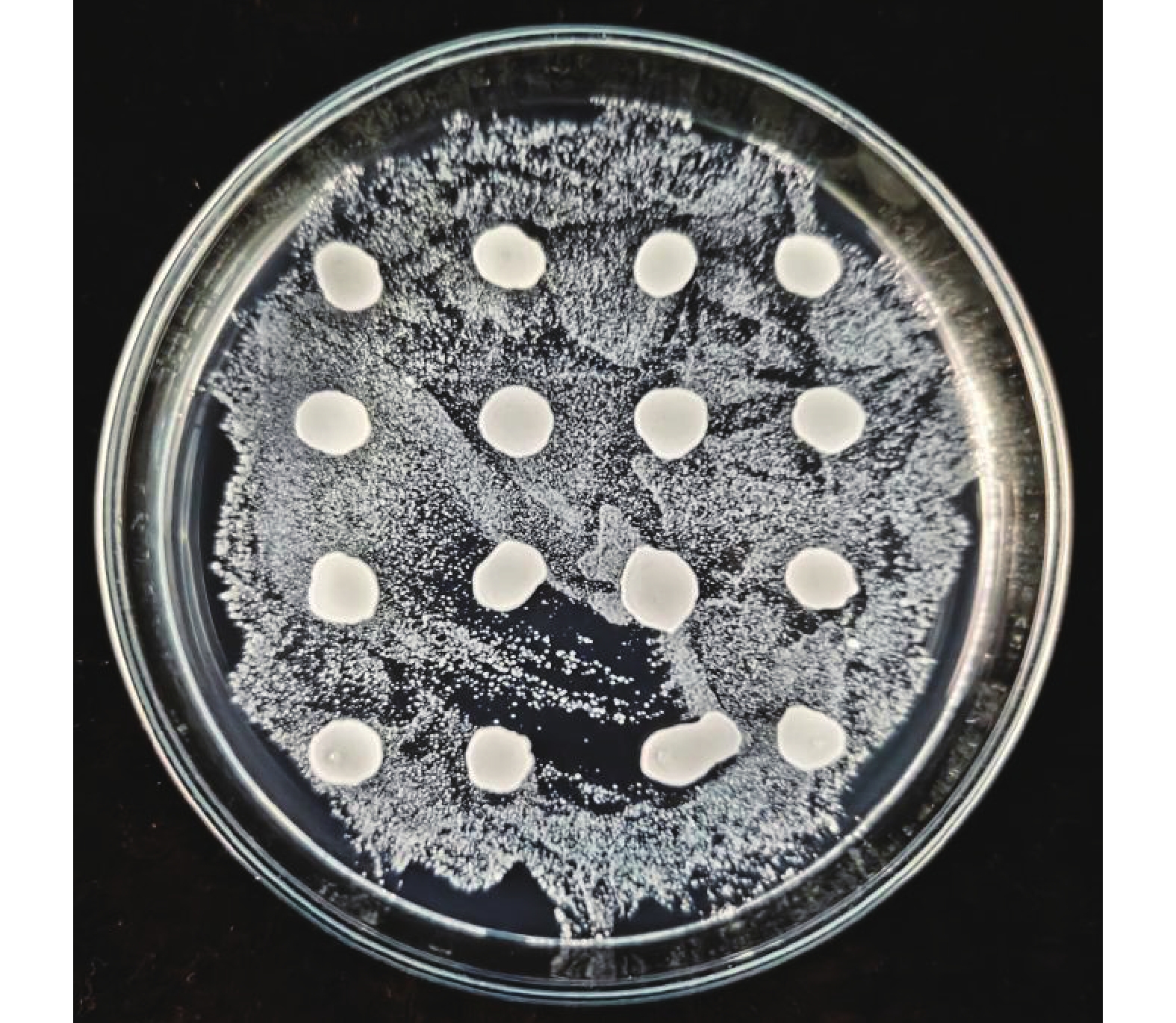
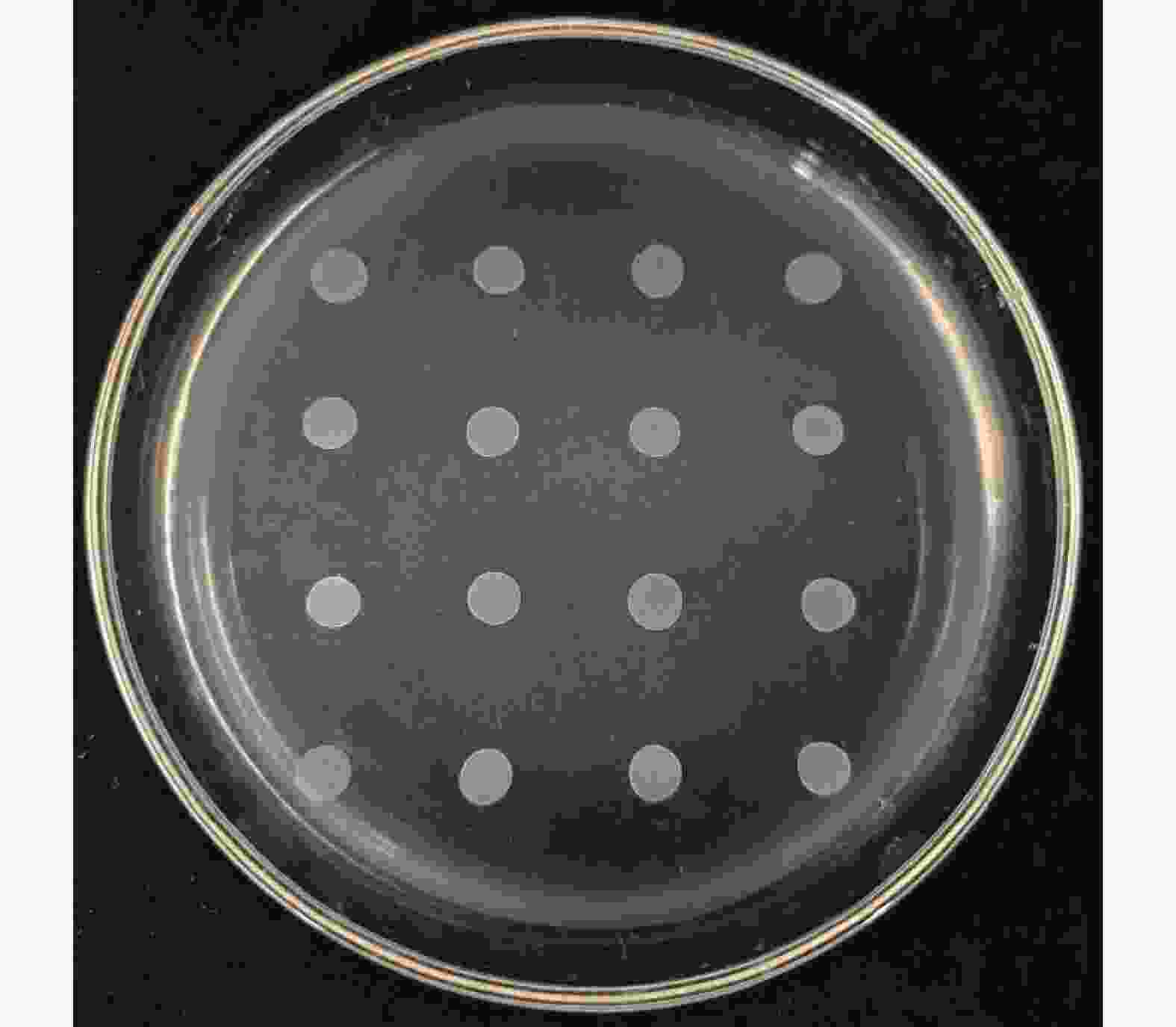
琼脂培养基是一种根据菌落在该培养基上显示的颜色来确定该菌株在硫化氢上产量情况的选择培养基。菌株为黑色表示硫化氢产量高,菌株为褐色表示硫化氢产量一般,菌株为黄棕色表示硫化氢产量低,菌株为白色表示不产生硫化氢[21]。该酵母在BIGGY培养基上的显色如图7所示,该酵母菌落呈白色,即不产生硫化氢,满足果酒发酵的需求。
-
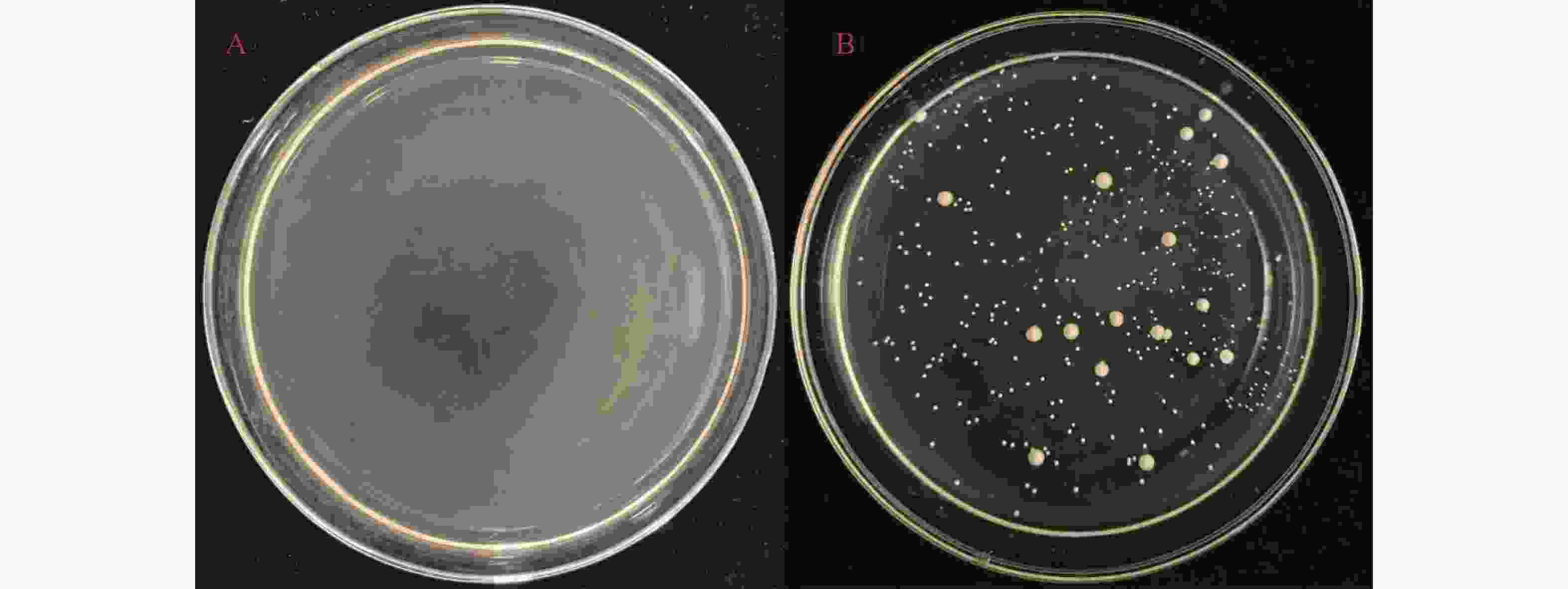
在后续的哈密瓜果酒发酵试验中,一般会将戴尔有孢圆非酿酒酵母与酿酒酵母同时接种发酵,为测定酿酒酵母与戴尔有孢圆酵母之间是否有嗜杀反应,避免接种两种酵母发酵之后出现其中一种酵母全部死亡的现象。在YEPD-MB培养基上涂满酿酒酵母之后,并在其上方点5 μL戴尔有孢圆酵母菌液,点样的区域就是两种酵母混合生长的区域,如果混合生长的区域间出现死菌带和透明抑制圈的现象,就是两种酵母之间产生了嗜杀反应,反之则没有。结果表明,戴尔有孢圆酵母周围没有形成蓝色的死菌带和透明抑制圈(图8),说明该酵母对酿酒酵母没有嗜杀反应。
-
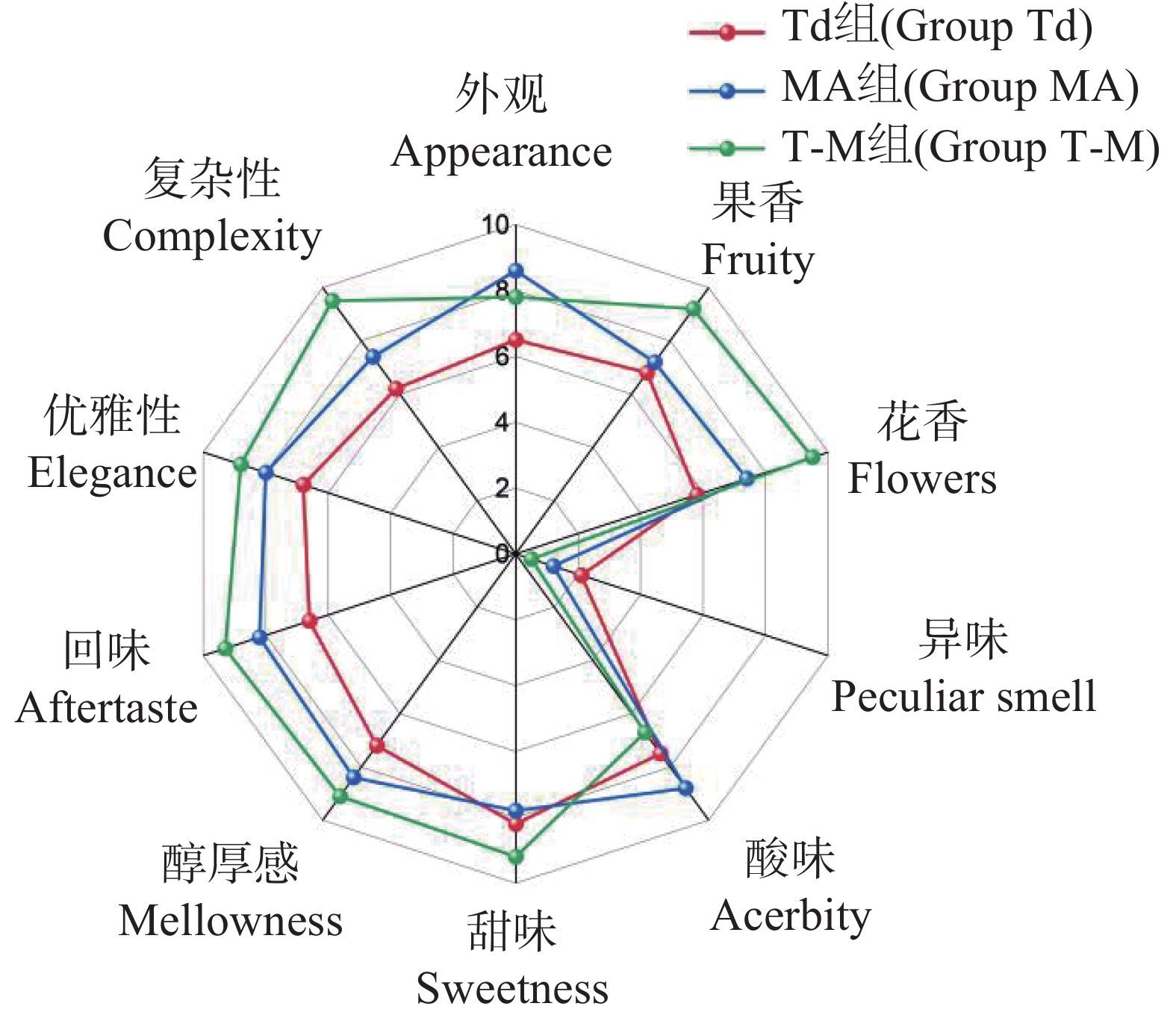
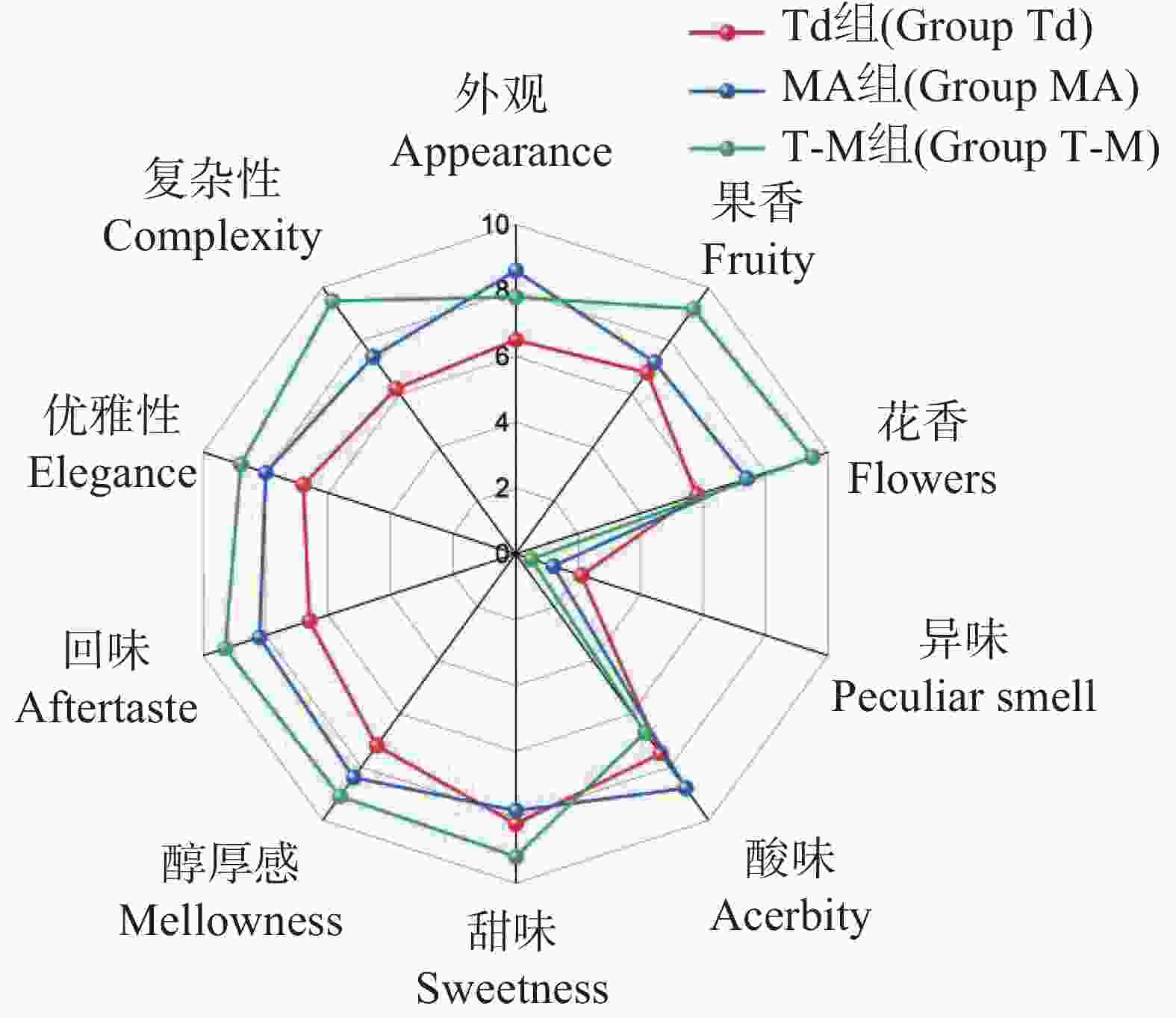
对3种不同处理的哈密瓜酒进行感官评价,结果表明,T-M混合发酵在果香、花香、甜味、醇厚感、回味、优雅性、复杂性的得分最高,同时异味程度最低;MA单独发酵在外观、酸度方面得分较高(图9)。综上所述,T-M混合发酵的酒样综合感官评价最高。戴尔有孢圆非酿酒酵母单独发酵的哈密瓜果酒虽然比MA酿酒酵母发酵的哈密瓜果酒品质差,但两者的混合发酵却能够进一步提高果酒的感官品质,本次试验初步证明戴尔有孢圆酵母能够提高哈密瓜果酒的品质,对于哈密瓜果酒中的发酵物质成分变化会在后续的试验中进行具体分析。
-
目前大多数果酒酿造方式是直接选取商业酿酒酵母进行单独接种发酵,虽然操作简单方便,但是最终果酒单一,没有个性。本次试验旨在从本地哈密瓜表皮上筛选出酿酒酵母,加强本地特色酵母资源的充分开发利用,突出当地哈密瓜酒酿造的地方特色,进而提高哈密瓜酒的品质。因此本次研究从当地的哈密瓜表皮筛选出了1株野生型酵母。
通过对筛选出的野生型酵母进行形态观察、生理生化分析、分子生物学鉴定,结果表明该酵母为戴尔有孢圆酵母(Torulaspora delbrueckii)。Breda等[22]研究发现戴尔有孢圆酵母对葡萄糖、蔗糖、麦芽糖、山梨糖醇有很好的碳源同化效果,与本次试验的结果一致。同时,本次试验验证出戴尔有孢圆酵母对可溶性淀粉的碳源同化效果较差。刘灿珍等[23]研究发现戴尔有孢圆酵母对硫酸铵、天冬氨酸、L-赖氨酸有很好的氮源同化效果,对硝酸钾、亚硝酸钾的氮源同化效果较差。虽然本次试验的结果在对硝酸钾的氮源同化效果一致,但对硫酸铵的氮源同化效果出现差异。戴尔有孢圆酵母对蛋白胨的碳源同化效果较强,对硝酸钙同化效果较差。糖发酵试验可以验证出菌株对不同糖的利用能力[24],目前对戴尔有孢圆酵母的糖发酵研究较少,本次试验研究结果表明戴尔有孢圆酵母能够充分利用葡萄糖、麦芽糖、蔗糖,对乳糖的利用率低。在果酒发酵前期,酵母需要快速将发酵体系中的糖分消耗并转化成乙醇和二氧化碳,戴尔有孢圆酵母对糖分的利用率高,满足后续果酒的发酵需求。
为了测定该酵母是否适应果酒的发酵环境,本次试验对该酵母的耐受性、产氢效果、嗜杀性进行研究。杨婕[25]研究发现戴尔有孢圆酵母在100~400 mg·L−1的二氧化硫浓度中均能够正常生长,对二氧化硫有很好的耐受性,与本次试验的结果一致。同时,本次试验验证出戴尔有孢圆酵母在500 mg·L−1的二氧化硫浓度中,虽然酵母的生长量有显著性下降,但还是能够正常生长。王静尧[26]研究发现戴尔有孢圆酵母在pH 3.5~5.0时能够正常生长,有较好的pH耐受性。同时,本次试验验证出戴尔有孢圆酵母在pH 2.4~3.6,酵母能够正常生长。潘雪婷[27]研究发现戴尔有孢圆酵母在6%~15%的乙醇含量之间正常生长,在18%的乙醇条件下没有生长现象。本次试验验证戴尔有孢圆酵母在4%~20%的乙醇含量中,该酵母均能正常生长,具有较好的乙醇耐受性。杨诗妮[28]研究发现戴尔有孢圆酵母的硫化氢产量测定显示酵母菌显色呈白色,不产生硫化氢,与本次试验的结果一致。为避免戴尔有孢圆酵母对酿酒酵母产生嗜杀反应,杨诗妮等[29]研究发现戴尔有孢圆酵母对酿酒酵母 NX11424没有嗜杀性,表明戴尔有孢圆酵母酵母能够与该酿酒酵母共同生存。本次试验验证出戴尔有孢圆酵母同样对酿酒酵母MA没有嗜杀性。
为了测定戴尔有孢圆酵母是否能够提高哈密瓜酒的风味,本次试验通过设立3组不同酵母接种的处理。周得刚等[30]研究发现戴尔有孢圆酵母与酿酒酵母混合发酵相对于单一酵母发酵的葡萄酒,表现出更强烈的“花香”、“果香”、“平衡感”和“余味”。本次试验结果表明戴尔有孢圆酵母与酿酒酵母 MA混合发酵相对于单一酵母发酵的哈密瓜酒,在综合感官评价得分最高,其中在果香、花香、甜味、醇厚感、回味、优雅性、复杂性的得分最高,同时异味程度最低。
本次试验主要从本地哈密瓜皮上筛选并鉴定出野生型酵母,并测定该酵母是否适合发酵哈密瓜酒,初步发现该酵母不仅能够适应哈密瓜果酒的发酵环境,还可提高哈密瓜酒的口感、风味品质。本地的酵母资源仍有待挖掘,希望能进一步挖掘出更多品种的酵母,为哈密瓜酒提供多样的口感、风味品质。
Screening and characterization of wild type yeast Torulaspora delbrueckii from Cantaloupe
DOI: 10.15886/j.cnki.rdswxb.20240161
- Received Date: 2024-10-23
- Accepted Date: 2025-02-19
- Rev Recd Date: 2024-12-18
-
Key words:
- Torulaspora delbrueckii /
- non-Saccharomyces cerevisiae /
- cantaloupe wines /
- 18S rDNA sequencing /
- flavors
Abstract: Torulaspora delbrueckii is one of non-Saccharomyces yeasts mostly used for research, and is widely used for brewing of various fruit wines. It is co-fermented with Saccharomyces cerevisiae for improving fruit wine flavors. In this experiment, a wild-type yeast strain was selected from the peel of cantaloupe in Fulo Town, Ledong County, Hainan Province. Through phenotypic observation of the strain and constructing a phylogenetic tree based on 18S rDNA sequencing, the strain was identified as T. delbrueckii. Under the fermentation condition of fruit wine, T. delbrueckii grew normally in the range of alcohol content 4−20%, pH value 2.8−3.6 and sulfur dioxide concentration 100−500 mg·L−1, and the growth rate was the highest under the condition of alcohol content 4%, pH value 3.6 and sulfur dioxide concentration 300 mg·L−1. The results show that T. delbrueckii did not produce hydrogen sulfide, had no killing effect on S. cerevisiae, and improved the flavor of cantaloupe fruit wine, which can be used in the production of cantaloupe fruit wine.
| Citation: | CHEN Yixuan, ZHAI Jinling. Screening and characterization of wild type yeast Torulaspora delbrueckii from Cantaloupe[J]. Journal of Tropical Biology. doi: 10.15886/j.cnki.rdswxb.20240161 |







 DownLoad:
DownLoad: