-
主持人:朱国鹏
火龙果是仙人掌科(Cactaceae)量天尺属(Hylocereus)或蛇鞭柱属(Seleniereus)的植物,原产于中美洲热带地区,是热带地区重要的经济作物[1-3]。随着消费升级,人们对火龙果的品质要求越来越高,火龙果新品种的研发也日益重要。火龙果育种中,不同种属、不同倍性材料的杂交是常用方法,对火龙果种质资源及杂交后代进行倍性鉴定是火龙果新品种选育的重要环节。黄黎芳等[4]对18份火龙果种质资源及8份杂交后代的倍性进行鉴定,发现自然界种主要存在二倍体和四倍体,杂交后代中存在三倍体。刘顺枝等[5-6]利用火龙果根尖和气生根对红肉火龙果和白肉火龙果进行核型分析,发现2种火龙果都是二倍体,染色体数目均为2n=2x=22。常规的植物倍性鉴定是采用染色体制片技术和染色体核型分析,火龙果的染色体制片多选择根尖和气生根为材料,但火龙果根多为须根,操作困难;气生根难以催生,获取不易。Soltis等[7]将未复制的配子核基因组中的DNA含量称为1C-value(1C),并根据1C值大小将基因组分成5大类,分别是极小型基因组(1C≤1.34 Gb)、小型基因组(1.35 Gb≤1C≤3.34 Gb)、中型基因组(3.35 Gb≤1C≤13.36 Gb)、大型基因组(13.37 Gb≤1C≤33.42 Gb)、特大型基因组(1C≥33.43 Gb)。流式细胞技术可以快速鉴定植物种质资源的倍性,预估基因组大小[8]。科学家使用流式细胞技术对草莓(Fragaria ananassa)[9]、油茶(Camellia oleifera )[10]、石斛(Dendrobium nobile)[11]、猕猴桃(Actinidia chinensis)[12]等植物进行倍性鉴定,证明流式细胞技术在植物倍性鉴定中的可行性。但流式细胞技术在火龙果方面的研究少有报道。本研究利用茎尖染色体制片技术与流式细胞技术对42份火龙果种质资源进行倍性鉴定以及基因组大小的估测,旨在为火龙果杂交育种亲本材料的选择提供参考。
HTML
-
供试的42份种质资源材料取自海南恩红农业科技有限公司的种质资源圃(表1)。对照材料‘金都一号’的基因组大小为1.4 Gb。
编号Number 品种名称Name 编号Number 品种名称Name 编号Number 品种名称Name 1 澳洲黄龙Aozhouhuanglong 15 红水晶Hongshuijing 29 偷心6号Touxin No.6 2 白肉Bairou 16 黄皮Huangpi 30 陀2Tuo No.2 3 白水晶Baishuijing 17 金都一号Jindu No.1 31 陀红肉小果Tuohongrouxiaoguo 4 粗砂Cusha 18 玫瑰1号Meigui No.1 32 无刺红龙Wucihonglong 5 大红Dahong 19 玫红4号Meihong No.4 33 无刺黄龙Wucihuanglong 6 帝龙Dilong 20 美龙Meilong 34 细致Xizhi 7 富贵红450 Fuguihong450 21 美龙3号Meilong No.3 35 香蜜龙Xiangmilong 8 光明白肉Guangmingbairou 22 蜜宝Mibao 36 小圆果Xiaoyuanguo 9 光明红肉Guangminghongrou 23 蜜玄龙Mixuanlong 37 燕窝果Yanwoguo 10 广西450Guangxi 450 24 蔷薇3号Qiangwei No.3 38 越南白肉Yuenanbairou 11 桂红龙Guihonglong 25 软枝大红Ruanzhidahong 39 紫蜜龙Zimilong 12 红宝龙Hongbaolong 26 石火泉Shihuoquan 40 紫肉Zirou 13 红皮Hongpi 27 双色Shuangse 41 紫肉1号Zirou No.1 14 红肉Hongrou 28 台湾红肉Taiwanhongrou 42 紫肉2号Zirou No.2 Table 1. The name and number of pitaya germplasm resources
-
用Tris-MgCl2解离缓冲液作为处理流式细胞样品的处理液,解离缓冲液所需试剂的配制方法如下。1)1 mol·L-1 Tris-HCl的制备:称取120.11 g Tris,加浓盐酸充分搅拌调节pH至8.0,双蒸水定容至1 000 mL,灭菌,温室保存。2)1 mol·L-1MgCl2的制备:称取1.9 g MgCl2,溶于20 mL双蒸水中,充分搅拌,室温下保存。
将1 mol·L-1 Tris-HCl(200 mmol·L-1),1 mol·L-1 MgCl2(4 mmol·L-1),TritionX-100(0.5%)按含量混合,使用1 mol·L-1的HCl将解离缓冲液调节pH至7.5,用0.22 μm的滤膜进行过滤去除杂菌,放置冰箱4 ℃保存备用。
采用Sysmex公司的CyFlow Ploidy Analyser流式细胞仪进行细胞倍性检测。然后用CyFlow Cube(Sysemex公司)软件获取数据,用FlowJo-V10.6.2软件进行结果分析。
-
(1)取材、预处理:选取健康、幼嫩的火龙果植株茎尖,并利用锋利的刀片去除外围的肉质幼叶,得到火龙果植株的中心茎尖;将解剖得到的火龙果植株茎尖放入0.2%的秋水仙素与0.002 mol·L-1的8-羟基喹啉混合液中,常温下静置2 h。
(2)前低渗:用蒸馏水清洗2~3次后转入0.075 mol·L-1的KCl在常温下分别浸泡1.5、2、2.5 h,以确定适宜的前低渗时间。
(3)前固定:将低渗后的茎尖放入卡诺氏固定液(V无水乙醇∶V冰醋酸= 3∶1)中,置于4 ℃条件下冷藏固定12 h以上。
(4)解离:用蒸馏水清洗2~3次,将清洗去除卡诺氏固定液后的茎尖放入1 mol·L-1的HCl中,在常温下分别解离1、1.5、2 h,确定解离时间。
(5)酶解:将解离后的茎尖用蒸馏水清洗2~3次,并放入2.5%的纤维素酶和果胶酶混合液(m纤维素酶∶m果胶酶=1∶1)中,在常温下分别处理0.5、1、1.5 h,确定酶解的时间;
(6)后低渗:用蒸馏水清洗2~3次后,放入蒸馏水中分别低渗20、30、40 min,以确定后低渗时间。
(7)后固定:将后低渗的茎尖放入卡诺氏固定液中,在4 ℃下冷藏固定30 min,固定结束后如不能及时进行制片使用,则将茎尖漂洗之后放入75%的酒精中保存(4 ℃);
(8)染色、制片、观察:将茎尖置于载玻片上,轻轻切取尖端部位2~3 mm,并用锋利的刀将其尽可能的切碎,之后滴加10%改良苯酚品红颜色液,盖上盖玻片,染色20~40 min。染色结束后,用蒸馏水洗去多余染料,并用滤纸吸去多余液体。压片过程中使用带有橡皮的铅笔轻轻敲击盖玻片,使得茎尖组织和细胞可以均匀的分散在载玻片上,最后使用显微镜进行观察拍照。
-
(1)以已知二倍体材料‘金都一号’为内参,称取约100 mg的火龙果茎组织,去除表面蜡质层,放入预冷的培养皿中,加入预冷的解离缓冲液2 mL,用锋利的刀片竖直快速一次性切碎,整个过程中待测材料需要完全浸没于解离缓冲液中。(2)吸取培养皿中的解离缓冲液,用300目的过滤网过滤到流式细胞仪上机用的试管中。(3)将流式细胞仪的光源波长调节为532 nm,加入100 μL DAPI(4',6-二脒基-2-苯基吲哚)染液对细胞核DNA进行荧光标记,立即使用流式细胞仪进行样品检测,每个样品检测3次重复。(4)利用FlowJo-V10.6.2软件进行结果分析,以已知基因组大小的火龙果‘金都一号’为参照样本,计算待测样品的基因组大小(待测样品基因组大小等于参照样本基因组大小乘以待测样品平均荧光强度除以参照样品平均荧光强度)。
-
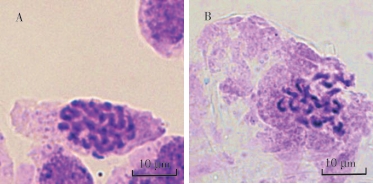
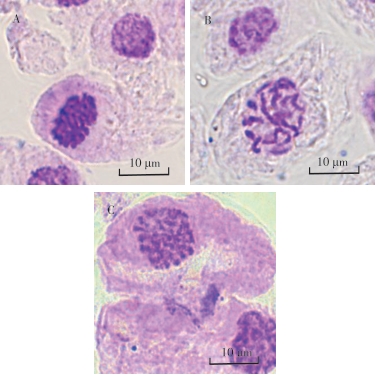
研究发现,染色体周围往往附着比较多的细胞质,妨碍染色体的充分铺展,因此为了促使染色体可以更好的分散,笔者采用前将材料经过0.075 mol·L-1的KCl的处理,来利用细胞内外渗透压的不同,使细胞经过吸收充分膨胀,从而获得染色体分散更加良好的细胞。从图1可以看出,茎尖经过前低渗1.5 h后染色体聚集,不易分散;前低渗2 h后,染色体可以很好的分散;经过前低渗2.5 h的处理后,发现低渗时间过长会导致染色体出现损伤。
-
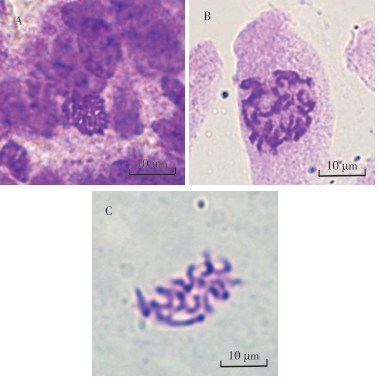
解离的目的是为了更好的使细胞分离,材料软化易于制片以及单细胞的观察。从图2可知,当解离时间为1 h时,火龙果茎尖细胞解离不充分,在进行制片时细胞难以压散,且容易造成气泡残留,难以进行观察。当解离时间为2 h时,细胞易于分散,但由于解离时间过长,造成细胞破裂或者染色体出现断裂的现象。当解离时间为1.5 h时,细胞易于分散,没有出现重叠的现象,且染色体完好,背景清晰,易于观察和计数,适合用于核型分析。
-
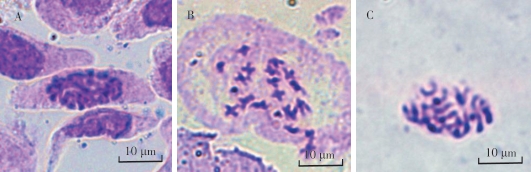
观察中发现,火龙果茎尖存在大量果胶,并且火龙果茎尖中心部位属于木质部,细胞壁较厚不易于破除,因此在试验过程中使用纤维素酶和果胶酶混合液对火龙果茎尖进行处理。如图3所示,在酶解时间为0.5 h时,材料趋于硬化,并且存在果胶的残留,对制片过程造成了一定阻碍,且镜检后发现细胞存在重叠,不易于染色体的观察与计数。当酶解1.5 h时,在材料处理过程中容易在成断裂,从而遗失制片所需要的尖端部位,同时经过制片后观察发现,虽然可以得到单个细胞而且方便观察染色体,但是由于酶解时间过长造成细胞壁溶解消失,无法观测到细胞边界。当酶解时间为1 h时,材料的制备过程中硬度适中不容易断裂,制片时也可以获得分散的细胞,且细胞壁没有破裂的现象,可以更容易分辨出单细胞,适合用于核型分析。
-
后低渗的目的是为了使细胞吸水膨胀,从而使染色体更加的分散,但是为了防止细胞过度吸水,导致细胞涨破,所以仍需要确定后低渗的合适时间。从图4中可以发现,火龙果茎尖经过后低渗20 min,染色体依然存在较为集中,出现缠绕、重叠等现象,对后续的核型分析造成影响。当后低渗时间为40 min时,细胞吸水涨破,容易造成染色体缺失。当后低渗时间为30 min时,染色体分散程度较好,且细胞完整,易于后续的计数与计算,适用于核型分析。
-
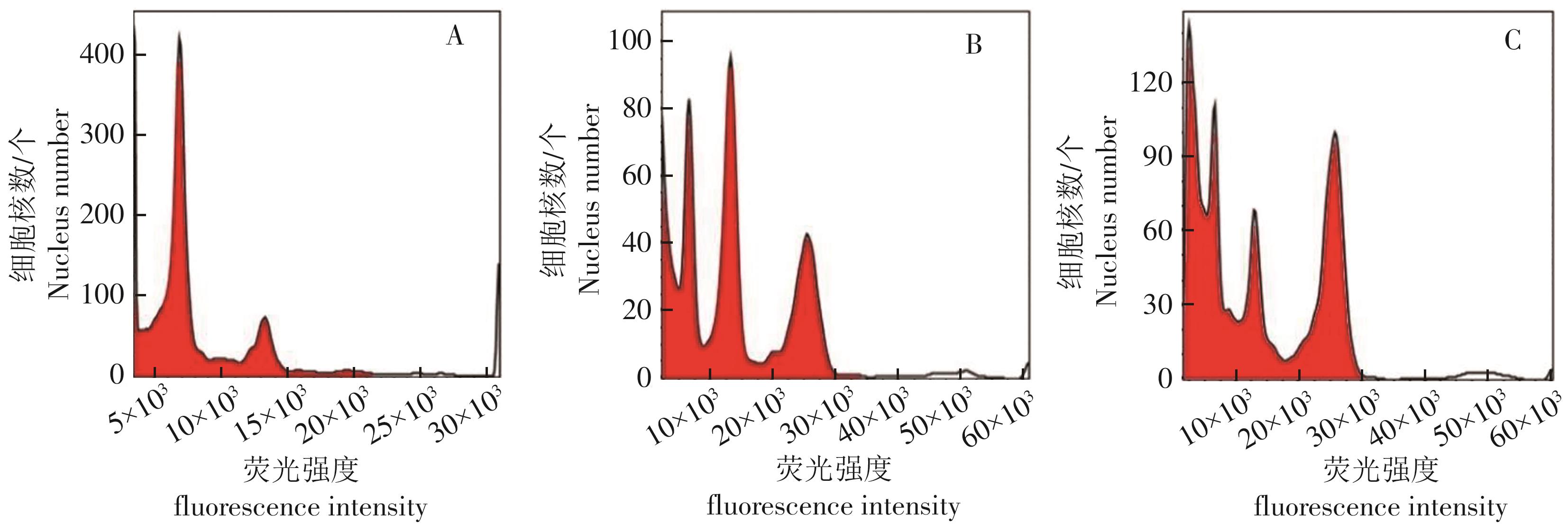
本实验以已经确定的火龙果二倍体材料‘金都一号’为参照品种材料,对其茎尖、幼嫩茎条、老熟茎条进行检测,选取优质的实验材料。从图5可知,茎尖的流式细胞检测有良好的二倍体单峰。而幼嫩茎条与老熟茎条则有3个峰值,且相对于幼嫩茎条,老熟茎条则有更多的八倍体细胞。同时,在检测过程中发现幼嫩茎条和老熟茎条的杂质较多,导致获得有效的细胞核数降低。
幼嫩茎条和老熟茎条相比,老熟茎条的八倍体细胞对应峰值比四倍体细胞对应峰值高,因此在进行倍性鉴定时,老熟茎条容易造成判断错误。幼嫩茎条的四倍体细胞对应的峰值比二倍体细胞对应的峰值高。在火龙果流式细胞技术的检测上,茎尖最适宜作为试验材料,其次是幼嫩茎条,老熟茎条不适合作为火龙果流式细胞检测材料。
-
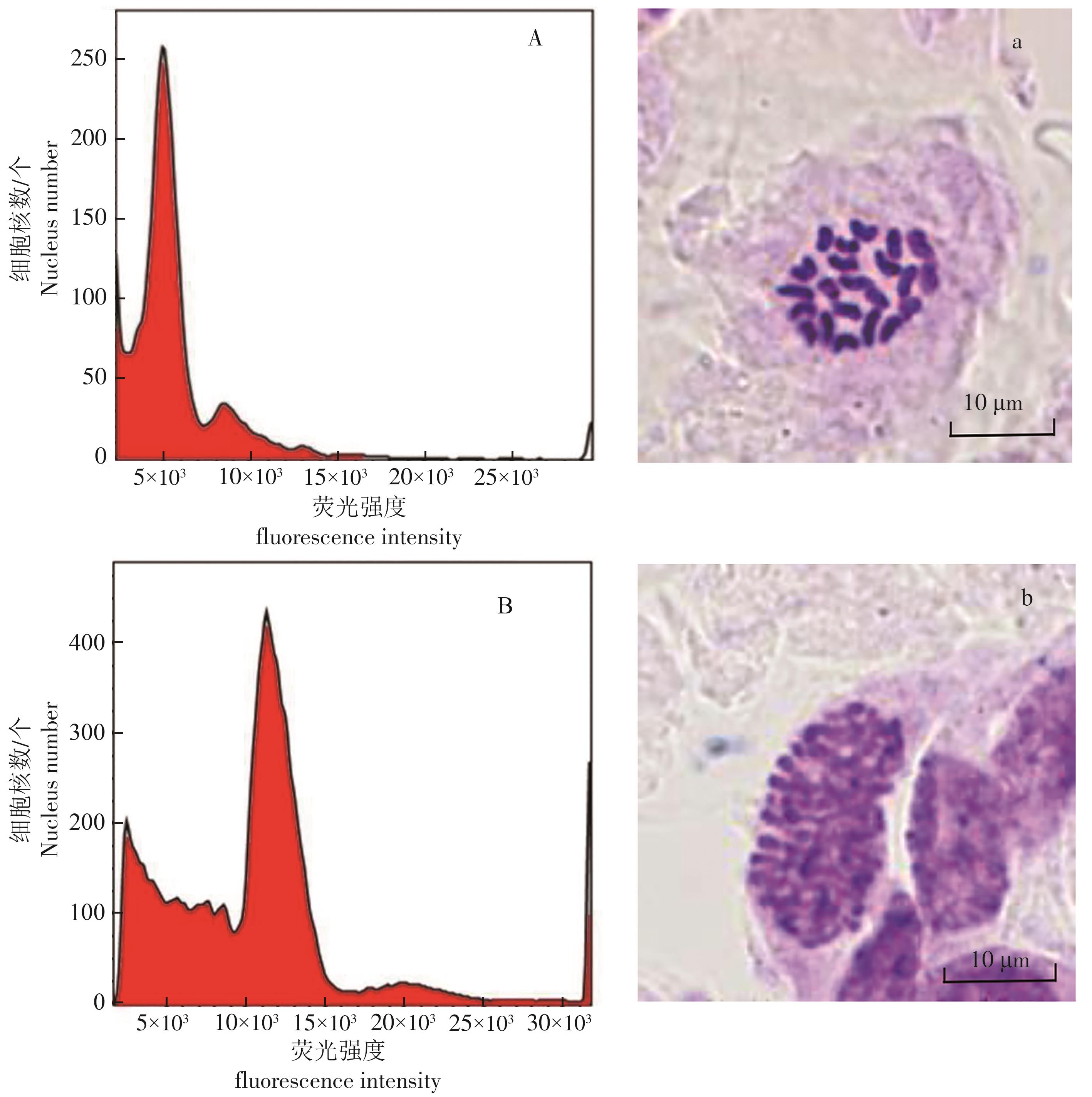
以已知的二倍体‘金都一号’(2n=2x=22)为对照材料,对42份火龙果种质资源进行流式细胞倍性鉴定,测得‘金都一号’染色体的峰值荧光强度为5 121,其具有良好的二倍体单峰;四倍体品种染色体的峰值荧光强度在2倍的二倍体荧光强度处有较好的单峰,且四倍体品种的DNA相对含量也是二倍体含量的2倍(图6)。
经流式细胞检测收集的42份火龙果种质资源的染色体倍性见表2。其中,有41份荧光强度值在4 219~6 612之间,呈二倍体荧光强度(0.82~1.29),为二倍体材料;1份荧光强度值为10 939,是2.14倍的二倍体的荧光强度值,为四倍体材料。四倍体材料为‘燕窝果’。在42份火龙果种质资源材料中并未发现三倍体材料。
品种Variety name 染色体数目/条Chromosome number 峰值荧光强度Peak fluorescence intensity DNA含量/%DNA content/% 预估基因组大小(1C)/GbGenome size/Gb 倍性Ploidy 金都一号Jindu No.1 2n=2x=22 5 121 100.00 1.40 二倍体2X 澳洲黄龙Aozhouhuanglong 2n=2x=22 5 097 99.53 1.39 二倍体2X 白肉Bairou 2n=2x=22 5 313 103.75 1.45 二倍体2X 白水晶Baishuijing 2n=2x=22 6 035 117.85 1.65 二倍体2X 粗砂Cusha 2n=2x=22 5 121 100.00 1.40 二倍体2X 大红Dahong 2n=2x=22 5 205 101.64 1.42 二倍体2X 帝龙Dilong 2n=2x=22 4 712 92.01 1.29 二倍体2X 富贵红450Fuguihong450 2n=2x=22 5 109 99.77 1.40 二倍体2X 光明白肉Guangmingbairou 2n=2x=22 4 941 96.49 1.35 二倍体2X 光明红肉Guangminghongrou 2n=2x=22 4 496 87.80 1.23 二倍体2X 广西450Guangxi 450 2n=2x=22 4 784 93.42 1.31 二倍体2X 桂红龙Guihonglong 2n=2x=22 4 340 84.75 1.19 二倍体2X 红宝龙Hongbaolong 2n=2x=22 5 409 105.62 1.48 二倍体2X 红皮Hongpi 2n=2x=22 6 311 123.24 1.73 二倍体2X 红肉Hongrou 2n=2x=22 5 025 98.13 1.37 二倍体2X 红水晶Hongshuijing 2n=2x=22 4 592 89.67 1.26 二倍体2X 续表2 Tab.2 Continued Table 2. The genome size, ploidy and chromosome number of different pitaya germplasm resources
-
根据植物基因组的1C值大小,将基因组分成5类。以‘金都一号’为对照,对其余41种火龙果基因组大小进行预估,发现预估基因组大小在1.15~2.99 Gb之间(表2),预估基因组的平均大小为1.45 Gb,其中有15份火龙果种质资源的1C≤1.34 Gb,属于极小型基因组;其余27份火龙果种质资源的1C值在1.35 Gb~3.34 Gb之间,属于小型基因组。42份火龙果种质资源的预估基因组大小主要集中在1.35~3.34 Gb之间,其次在1.15~1.34 Gb之间,并未发现其他种类的基因组,其中‘蜜宝’的基因组最小,仅有1.15 Gb;‘燕窝果’的基因组最大,达到了2.99 Gb。两者的预估基因组大小相差2.6倍。
品种Variety name 染色体数目/条Chromosome number 峰值荧光强度Peak fluorescence intensity DNA含量/%DNA content/% 预估基因组大小(1C)/GbGenome size/Gb 倍性Ploidy 黄皮Huangpi 2n=2x=22 4 484 87.56 1.23 二倍体2X 玫瑰1号Meigui No.1 2n=2x=22 5 349 104.45 1.46 二倍体2X 玫红4号Meihong No.4 2n=2x=22 4 520 88.26 1.24 二倍体2X 美龙Meilong 2n=2x=22 5 506 107.52 1.51 二倍体2X 美龙3号Meilong No.3 2n=2x=22 6 107 119.25 1.67 二倍体2X 蜜宝Mibao 2n=2x=22 4 219 82.39 1.15 二倍体2X 蜜玄龙Mixuanlong 2n=2x=22 5 602 109.39 1.53 二倍体2X 蔷薇3号Qiangwei No.3 2n=2x=22 4 496 87.80 1.23 二倍体2X 软枝大红Ruanzhidahong 2n=2x=22 4 941 96.49 1.35 二倍体2X 石火泉Shihuoquan 2n=2x=22 4 748 92.72 1.30 二倍体2X 双色Shuangse 2n=2x=22 5 397 105.39 1.48 二倍体2X 台湾红肉Taiwanhongrou 2n=2x=22 4 832 94.36 1.32 二倍体2X 偷心6号Touxin No.6 2n=2x=22 5 277 103.05 1.44 二倍体2X 陀2Tuo No.2 2n=2x=22 4 905 95.78 1.34 二倍体2X 陀红肉小果Tuohongrouxiaoguo 2n=2x=22 6 503 126.99 1.78 二倍体2X 无刺红龙Wucihonglong 2n=2x=22 5 854 114.31 1.60 二倍体2X 无刺黄龙Wucihuanglong 2n=2x=22 5 446 106.35 1.49 二倍体2X 细致Xizhi 2n=2x=22 6 612 129.12 1.81 二倍体2X 香蜜龙Xiangmilong 2n=2x=22 5 446 106.35 1.49 二倍体2X 小圆果Xiaoyuanguo 2n=2x=22 4 484 87.56 1.23 二倍体2X 燕窝果Yanwoguo 2n=4x=44 10 939 213.61 2.99 四倍体4X 越南白肉Yuenanbairou 2n=2x=22 4 496 87.80 1.23 二倍体2X 紫蜜龙Zimilong 2n=2x=22 6 503 126.99 1.78 二倍体2X 紫肉Zirou 2n=2x=22 5 217 101.87 1.43 二倍体2X 续表2 Tab.2 Continued 品种Variety name 染色体数目/条Chromosome number 峰值荧光强度Peak fluorescence intensity DNA含量/%DNA content/% 预估基因组大小(1C)/GbGenome size/Gb 倍性Ploidy 紫肉2号Zirou No.1 2n=2x=22 5 049 105.62 1.48 二倍体2X 紫色1号Zirou No.2 2n=2x=22 4 340 84.75 1.19 二倍体2X 注: ‘金都一号’为对照。Note: ‘Jindu-1’ was selected as control.
-
在对火龙果染色体制片材料的选择中发现火龙果根系多为须根系,根系较细且木质化严重,不易切割制片;火龙果枝条的气生根相对较粗且质地柔软,方便制片,但火龙果气生根并没有稳定的催生技术,获取不易。本研究为建立方便、快捷、稳定的火龙果制片技术体系,以火龙果茎尖为材料进行火龙果染色体制片。本研究发现,火龙果茎尖染色体制片在前低渗时间为2 h;解离时间为1.5 h;酶解时间为1 h;后低渗时间为30 min时,染色体分散程度较好,背景清晰,没有出现重叠的现象,具有完整的细胞。
流式细胞技术在植物倍性鉴定方面具有操作简单、效率高、结果准确的特点[13]。为了获得准确的倍性鉴定结果,样品的选择是其中的关键。本试验对火龙果流式细胞检测的材料进行筛选比较,发现幼芽茎尖具有较好的二倍体荧光图像。幼嫩茎条与老熟茎条都存才较多的杂峰,且细胞核数显著降低,存在较多的四倍体细胞和八倍体细胞,影响流式细胞检测的准确性。
在种质资源评价中,染色体的倍性鉴定是其中重要的环节,染色体的倍性鉴定对新品种选育及品种资源的科学利用具有重要意义[14]。本研究利用染色体制片技术和流式细胞技术,同时对42份火龙果种质资源进行倍性鉴定,取得一致性的研究结果,其中41份种质资源为二倍体(2n=2x=22)材料,1份四倍体(2n=4x=44)材料,未发现三倍体种质资源。42份火龙果种质资源中仅有1份四倍体材料,预估基因组大小为‘燕窝果’(2.99 Gb)。所有二倍体材料中‘细致’的预估基因组最大,大小为1.81 Gb;‘蜜宝’的预估基因组最小,为1.15 Gb。
随着火龙果产业的发展,火龙果优质新品种的选育显得尤为重要。本研究利用茎尖染色体制片技术和流式细胞技术,对42份火龙果种质资源进行倍性鉴定以及基因组大小研究,既能为培育优质火龙果品种和开展人工授粉杂交、转基因等工作提供参考,也能为火龙果的全基因组测序以及细胞遗传学研究提供依据。




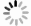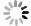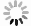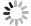







 DownLoad:
DownLoad: