-
主持人:徐 冉
鱼藤(Derris trifoliata)为豆科(Fabaceae)鱼藤属(Derris)植物,为多年生攀援藤本,原产亚洲热带及亚热带地区。在我国主要分布于福建、台湾、广东、广西和海南等地,多生于沿海河岸灌木丛、海边灌木丛或近海岸的红树林中[1-2]。近年来,我国局部地区鱼藤种群增长过快,其攀援至红树林植物的树冠上层,导致大量红树林植物不能正常进行光合作用而枯萎死亡,严重影响了红树林群落的发育,甚至导致红树林生态系统逐渐退化,已成为危害红树林植物的“植物杀手”[3-4]。因此,开展鱼藤的相关研究对于红树林湿地的保护和恢复具有重要的现实意义。目前,鱼藤的研究多集中在鱼藤对红树林危害的评估等方面[3-5],对鱼藤的分布[6-7]、种群特征和个体的生长发育等特性的研究较少[8-9]。有研究表明,不同环境中生长的植物,其形态特征、生物量、光合生理以及抗氧化酶水平等均会发生一定程度的改变,可以直观地反映环境因子对植物生长的影响[10-12]。因此,笔者通过人工控制实验,模拟潮汐环境,研究鱼藤幼苗在不同的水盐环境中的生理生化过程的变化,了解鱼藤的生长和发育特征,探讨鱼藤爆发的原因,旨在为红树林湿地的保护和生态修复过程中鱼藤的防治提供理论和技术支持。
HTML
-
2020年9月在海南东寨港国家级自然保区内,采集鱼藤成熟的种子,以在海南临高县马袅红树林苗圃培育1年的幼苗作为实验苗木(苗高70 cm,基径0.5 cm)。
-
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法,氮蓝四唑在蛋氨酸和核黄素存在条件下,照光后发生光化还原反应而生成蓝色甲腙,蓝色甲腙在560 nm处有最大光吸收,SOD能抑制NBT的光化还原,其抑制强度与酶活性在一定范围内成正比,SOD 总活性(u·g-1)是指单位鲜重含酶单位数,一个酶活单位定义为将 NBT 还原抑制到对照一半时所需酶量[13]。过氧化氢酶(CAT)采用紫外吸收法,H2O2在240 nm波长下有强吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光值(A240)随反应时间增加而降低,根据测量吸光值的变化速度即可测量出过氧化氢酶的活性,以1 min内A240减少0.1的酶量为1个酶活单位(u),单位为 u·g-1·min-1[13]。游离脯氨酸(FFPRO)采用酸性茚三酮法,通过茚三酮与样品内游离脯氨酸反应生成橙色物质,在520 nm波长下的吸光值与空白对照比较,确定样品内游离脯氨酸含量,以单位鲜质量所含脯氨酸量来表示,单位为ug·g-1[13]。丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法,丙二醛在高温及酸性环境中可与2-硫代巴比妥酸(TBA)反应产生红棕色的产物3,5,5′-三甲基恶唑2,4-二酮(三甲川)该物质在532 nm波长下有强吸收,并且在660 nm波长下有较小的光吸收,醛、可溶性糖对此反应有干扰,在450 nm波长下有强吸收,可用双组分分光光度计法加以排除。以单位鲜质量所含丙二醛的摩尔数来表示,单位为µmol·g-1[13]。
-
数据采用Spss20和Excel2010软件进行数据的统计分析,其中方差分析采用单因素方差分析,多重比较使用最小显著差异法(LSD)。
-
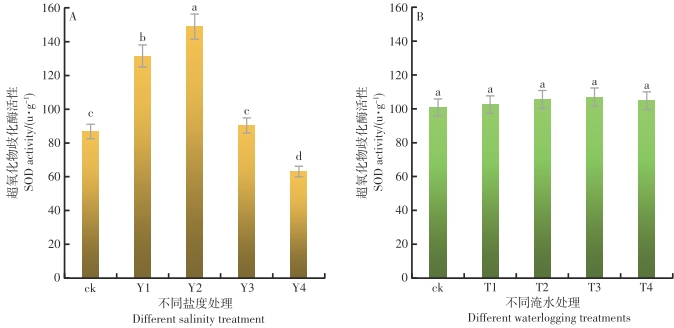
在不同的盐度水平影响下,鱼藤幼苗叶片内的SOD活性差异达到极显著的水平(P<0.01)。从图2-A可以看出,随着盐度的增加,鱼藤幼苗叶片内的SOD活性呈现先升后降的趋势,在Y2盐度环境中,鱼藤幼苗叶片内的SOD活性最大为148.86 u·g-1,Y4盐度环境中鱼藤幼苗叶片内的SOD活性最小为63.08 u·g-1。与对照比较,在Y2盐度环境中鱼藤幼苗叶片内的SOD活性增长为71.6%,而在Y1、Y3和Y4盐度环境中,鱼藤幼苗叶片内的SOD活性增长为51.5%、4.1%和-27.3%,可以看出,在较低盐度环境中鱼藤幼苗通过增加叶片内的SOD活性对抗盐度胁迫,而当盐度增加到一定程度后,鱼藤幼苗叶片内的SOD受到抑制,活性降低,已无法通过SOD缓解体内的盐度胁迫。
在不同的淹水时间影响下,鱼藤幼苗叶片内的SOD活性差异不显著(P>0.05)。从图2-B可以看出,随着淹水时间的增加,鱼藤幼苗叶片内的SOD活性变化趋势不显著。在T3淹水条件下,鱼藤幼苗叶片内的SOD活性较大为106.92 u·g-1,而在ck条件下叶片内的SOD活性较小为100.79 u·g-1。与对照相比较,在淹水T1、T2、T3和T4淹水条件下,鱼藤幼苗叶片内的SOD活性增长率分别为1.7%、4.7%、6.1%和3.9%。可以看出,随着淹水时间的增长,鱼藤幼苗通过提高叶片内的SOD活性的抵御淹水对其造成的胁迫损伤,而当淹水时间每天超过6 h时,鱼藤幼苗叶片内的SOD活性受到抑制,已不能有效的缓解淹水带来的胁迫伤害。
从图3可以看出,在淹水时间和盐度的共同影响下,与对照相比较,鱼藤幼苗在Y2T3的环境中叶片内的SOD活性最高为156.55 u·g-1,变化幅度达到92%,在Y4T4环境中叶片内的SOD活性最低59.26 u·g-1,变化幅度为-27.3%。
-
在不同的盐度水平影响下,鱼藤幼苗叶片内的CAT活性差异达到极显著的水平(P<0.01)。从图4-A可以看出,随着盐度的增加,鱼藤幼苗叶片内的CAT活性呈现先升后降的趋势,在Y2盐度环境中,鱼藤幼苗叶片内的CAT活性最大为958.35 u·g-1·min-1,Y4盐度环境中鱼藤幼苗叶片内的CAT活性最小为316.43 u·g-1·min-1。与对照比较,在盐度Y1、Y2、Y3和Y4的环境中,鱼藤幼苗叶片内的CAT活性增长率分别为41.6%、50%、-6.7%和50.5%,可以看出,随着盐度的增加鱼藤幼苗通过提高叶片内的CAT活性来抵御盐度带来的胁迫伤害,而当盐度增加到一定程度鱼藤幼苗叶片内的CAT活性受到抑制,已不能有效缓解盐度带来的胁迫伤害,因此,可以认为鱼藤幼苗具有一定的耐盐能力。
在不同的淹水时间影响下,鱼藤幼苗叶片内的CAT活性的差异不显著(P>0.05)。从图4-B可以看出,随着淹水时间的增加,鱼藤幼苗叶片内的CAT活性变化的趋势不明显。在T3淹水条件下,鱼藤幼苗叶片内的CAT活性较大为694.15 u·g-1·min-1,而在淹水ck条件下叶片内的CAT活性较小为660.33 u·g-1·min-1,与对照相比较,在淹水T1、T2、T3和T4条件下,鱼藤幼苗叶片内的CAT活性增长率为3.1%、4.1%、5.1%和4.9%。
从图5可以看出,在淹水和盐度的相互影响下,与对照相比较鱼藤幼苗在Y2T4的环境中叶片内的CAT活性最大为984.81 u·g-1·min-1,变化幅度达到67.2%,在Y4T4环境中叶片内的CAT活性最小为293.09 u·g-1·min-1,变化幅度为-50.2%。
-
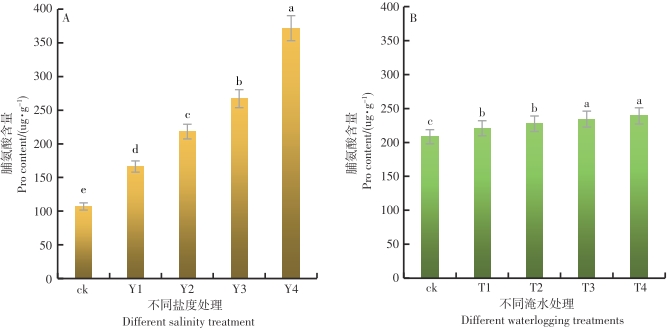
在不同的盐度水平影响下,鱼藤幼苗叶片内的FPRO含量差异达到显著的水平(P<0.05)。从图6-A可以看出,随着盐度的增加,鱼藤幼苗叶片内的FPRO含量呈现逐渐增加的趋势,在Y4盐度环境中,鱼藤幼苗叶片内的FPRO含量最大为371.73 ug·g-1,盐度CK的环境中鱼藤幼苗叶片内的FPRO含量最小为107.02 ug·g-1。与对照比较,在Y1、Y2、Y3和Y4盐度环境中,鱼藤幼苗叶片内的FPRO含量增长率分别为55.4%、103.9%、149.5%和247.4%。由此可以看出,随着盐度的增加鱼藤幼苗通过提高叶片内的FPRO含量来缓解盐度带来的胁迫损伤。
在不同的淹水时间影响下,鱼藤幼苗叶片内的FPRO含量差异显著(P<0.05)。从图6-B可以看出,随着淹水时间的增加,鱼藤幼苗叶片内的FPRO含量逐渐增加,在T4淹水条件下叶片内的FPRO含量最大为239.05 ug·g-1,在ck条件下,鱼藤幼苗叶片内的FPRO含量最小为208.4 ug·g-1。与对照相比较,在T1、T2、T3和T4淹水条件下,鱼藤幼苗叶片内的FPRO含量增长率分别为6%、9.2%、12.5%和14.7%。由此可以看出,随着淹水时间的增加鱼藤幼苗通过提高叶片内的FPRO含量来缓解淹水带来的胁迫伤害。
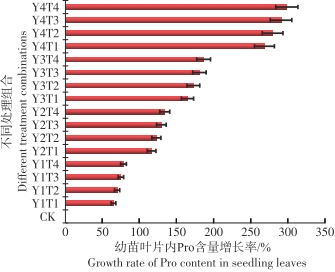
从图7可以看出,在淹水和盐度的共同影响下,与对照相比较鱼藤幼苗在Y4T4的环境中叶片内的FPRO含量最高为393.1 ug·g-1,变化幅度达到298.4%,在Y1T1环境中叶片内的FPRO含量最低为104.58 ug·g-1,变化幅度为64.7%。
-
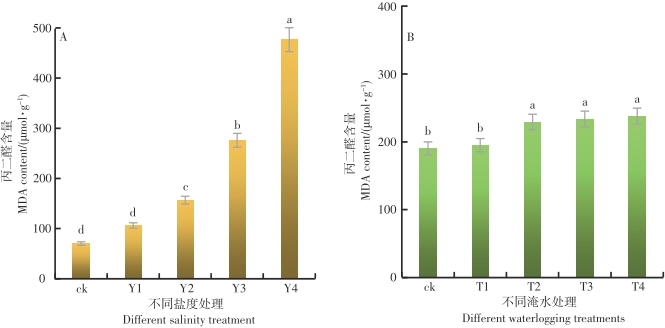
在不同的盐度水平影响下,鱼藤幼苗叶片内的MDA含量差异达到极显著的水平(P<0.01)。从图8-A可以看出,随着盐度的增加,鱼藤幼苗叶片内的MDA含量呈现逐渐增加的趋势,在Y4盐度的环境中,鱼藤幼苗叶片内的MDA含量最大为476.59 μmol·g-1,盐度CK的环境中鱼藤幼苗叶片内的MDA含量最小为75.92 μmol·g-1。与对照比较,在Y1、Y2、Y3和Y4盐度环境中,鱼藤幼苗叶片内的MDA含量增长率分别为51.2%、123%、292.8%和578.3%,可以看出,随着盐度的增加鱼藤幼苗叶片内的MDA含量逐渐增加,这说明鱼藤幼苗受到的盐度胁迫损伤越来越严重。
在不同的淹水时间影响下,鱼藤幼苗叶片内的MDA含量差异达到显著水平(p<0.05)。从图8-B可以看出,随着淹水时间的增加,鱼藤幼苗叶片内的MDA含量逐渐增加。在CK条件下,鱼藤幼苗叶片内的MDA含量最小为70.26 μmol·g-1,而在T4淹水条件下叶片内的MDA含量最大为476.59 μmol·g-1,与对照相比较,在淹水T1、T2、T3和T4条件下,鱼藤幼苗叶片内的MDA含量增长率分别为2.4%、20.3%、22.6%和24.8%。由此可以看出,随着淹水时间的增加鱼藤幼苗叶片内的MDA含量逐渐增加,这说明鱼藤幼苗受到的淹水胁迫损伤越来越严重。
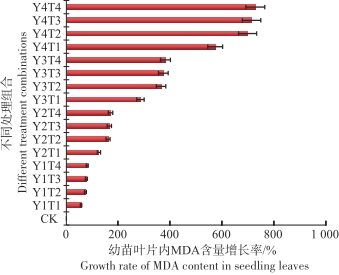
从图9可以看出,在淹水和盐度的共同影响下,与对照相比较鱼藤幼苗在Y4T4的环境中叶片内的MDA含量最高为523.22 μmol·g-1,变化幅度达到727%,在Y1T1环境中叶片内的MDA含量最低为99.04 μmol·g-1,变化幅度为56.5%。
-
植物在受到逆境胁迫时,活性氧自由基过量累积对细胞造成损伤,超氧化物歧化酶SOD是细胞抵御活性氧自由基过量积累的有效手段[14],其通过与细胞内的活性氧自由基发生反应,产生过氧化氢H2O2,缓解细胞膜系统的损伤[15],产生的H2O2则是被过氧化氢酶CAT分解成水和分子氧[16-17]。因此植物抗逆境胁迫的能力常与抗氧化酶活性息息相关[18-19]。但是当胁迫超出物种的耐受范围,随着胁迫程度的加深,抗氧化酶的合成受到抑制,酶活性呈现降低的趋势[20-21]。本研究结果表明,随着盐度的增加,叶片内SOD和CAT活性,均呈现先增加后降低的趋势,均在盐度20的环境中达到峰值。随着淹水时间的增加,叶片内SOD和CAT活性均呈现先增后降的变化趋势,均在淹水时间6 h·d-1的条件下达到峰值。廖宝文研究发现尖瓣海莲(Bruguiera sexangula var. rhynchopetala)和秋茄(Kandelia obovata)幼苗叶片内的SOD随着盐度的增加,均呈现先降后增的趋势,分别在盐度40和30的条件下达到峰值[22]。吕晓波等也在研究中发现,随着盐度的增加,红海榄(Rhizophora stylosa)幼苗的叶片内SOD和CAT活性呈现先增后降的变化趋势,分别在盐度20和30中达到峰值[23]。由上可知,植物通过提高抗氧化酶活性在一定程度上抵御盐胁迫对其叶片细胞膜系统的损伤,不同物种的抗氧化酶的活性变化有所差异。同时也可以看出三种真红树植物幼苗比鱼藤幼苗更耐盐。廖宝文研究中发现,随着淹水时间的增加,尖瓣海莲和秋茄幼苗叶片内的SOD呈现逐渐增加的趋势,分别在淹水时间20 h·d-1和24 h·d-1的条件下达到峰值[22]。Ye等[24]研究表明长时间的淹水促进秋茄叶片的SOD和POD活性显著增高。Chen等[25]研究发现淹水时间超过8 h·d-1秋茄幼苗叶片的SOD和POD活性显著提高。这些研究均表明植物通过提高抗氧化酶活性在一定程度上可以缓解淹水胁迫对其的损伤,但不同物种间体内的抗氧化酶的活性变化有所差异,同时还反映出,部分红树植物幼苗比鱼藤幼苗更耐淹。这就可以解释鱼藤对近陆地端分布的红树植物造成的影响较大,而很难对近海端分布的红树植物造成较大的影响。童康在鱼藤对潮汐淹水胁迫的响应的研究中也有类似的结论,鱼藤的临界淹水时间为4~6 h,超过6 h的淹水会严重影响鱼藤的生长,相比常见红树植物,鱼藤的耐淹水能力较差,主要体现在叶耐淹能力不强。鱼藤能够利用攀援能力提高抗淹水能力。这决定了鱼藤一般分布在中高潮带,尤其是有大量红树植物生长并有一定攀援空间的区域[8]。
-
植物细胞的渗透调节作用是植物适应环境,增强抗逆性的基础,也是植物对盐分和水分胁迫的重要手段之一[26]。游离脯氨酸FPRO可以通过调整细胞的渗透压,保护蛋白质分子结构,维持酶活性,保护细胞免受活性氧的损伤,多数植物在逆境中积累FPRO以降低胁迫损伤[21,27]。本研究发现鱼藤幼苗叶片内FPRO含量随盐度的增加呈现逐渐增加的趋势,在盐度40的条件下达到峰值;随着淹水时间的增加,叶片内的FPRO含量也呈现逐渐增加的趋势,在淹水8 h·d-1的条件下达到峰值,说明随着盐度和淹水胁迫增强,鱼藤幼苗通过积累FPRO,维持细胞的渗透压,保护蛋白质分子,进而维持抗氧化酶活性,来抵御盐度和淹水胁迫对细胞膜系统的损伤。谭芳林等[28]研究发现,水盐胁迫下秋茄幼苗叶片内的FPRO含量随着盐度的增加呈现先升后降的趋势,在盐度21条件下达到峰值,随着淹水时间的增加,呈现先降后增的变化趋势,在淹水8 h·d-1的条件下达到峰值。廖宝文等[29]研究表明,单一的淹水胁迫下,秋茄FPRO含量随淹水时间的延长,呈现先降后增的变化趋势,在24 h·d-1的条件下达到峰值。综上所述,植物幼苗通过提高FPRO含量,抵御水盐胁迫对幼苗造成的胁迫损伤。
-
丙二醛MDA是植物细胞膜质过氧化的产物,其的产生和积累会导致膜脂过氧化加剧,从而破坏植物膜脂。MDA含量在一定程度上反映植物受逆境伤害程度[15,21-22]。本研究发现,随着盐度的升高,淹水时间的增加,鱼藤叶片内的MDA含量均呈现逐渐增加的趋势,在盐度40,淹水8 h·d-1条件下达到峰值,但在盐度影响下MDA含量的增长率高于淹水时间对其的影响。廖宝文的研究表明尖瓣海莲和秋茄幼苗叶片内的MDA含量随着盐度的增加,呈现先降后增的变化趋势,分别在盐度40和30达到峰值[22]。廖宝文等研究发现单一的淹水胁迫下,秋茄MDA含量随淹水时间的延长,呈现先降后升的变化趋势,在24 h·d-1的条件下达到峰值[29]。吕晓波研究发现在单一的盐度影响下随着淹水时间的增加,红海榄幼苗叶片内的MDA含量呈现先升后降再升的变化趋势,在盐度20条件下达到峰值,而在单一淹水时间影响下,随着淹水时间的增加呈现先升后降的变化趋势,在淹水8 h·d-1条件下达到峰值[23]。综上所述,植物幼苗在受到胁迫体内细胞的膜系统受到活性氧损伤,MDA含量增加,其含量可以反映植物受到胁迫的损伤程度。
















 DownLoad:
DownLoad: