-
主持人:徐 冉
木薯 (Manihot esculenta Crantz)别名木蕃薯、树薯,是世界三大薯类作物之一,在食用、饲用和工业等开发利用上均有着较大的价值[1]。木薯的灰分和水分指标与木薯品质密切相关,但在木薯品种选育过程中,利用马弗炉法和烘干法检测其所含灰分和水分的流程较为繁琐[2],效率较低,因此现阶段迫切需要一种高效率、高精度和低成本的方法来检测批量木薯灰分和水分的含量指标。随着近红外光谱技术[near-infrared (NIR) spectroscopy]与化学计量方法的快速发展,近红外光谱技术被广泛应用于农产品品质分析领域,并已成为不可或缺的快速准确的测定方法[3],是工业生产过程中质量控制的首选技术。近红外光谱技术能满足常规方法不能完成的实时监测需求,同时具有无损样品、操作简单、检测快速等特点,在成品检测和在线检测中都有优势[3-5]。研究人员在玉米[6]、小麦[7]等饲料原料中利用近红外光谱技术检测其营养成分和利用近红外光谱技术对三七[8]、玉米[9]、棕榈[10]和橄榄[11-12]果实的含油量进行定量分析。Arslan等[13]采用近红外光谱法对枸杞总黄酮和花青素的化学成分进行了定量分析。Jin等[14]利用可见光和近红外光谱(VIS-NIR)可在30 770~9 300 cm-1范围内对芒草叶片含水量进行预测。Heo等[15]构建了PLS预测模型(R2P=0.95),利用选定波长分别为961.12、1 065.50、1 083.93、1 173.23、1 233.89 nm的HIS系统预测了蒸干紫薯中的水分含量。Rabanera等[16]对波长范围为900~1 700 nm的区段利用HSI系统,测定了花生仁水分含量,并构建了R2P为0.94、RMSEP为1.95%的PLS预测模型。Rahman等[17]在波段1 000~1 550 nm范围内利用HSI技术,开发出一套无损检测番茄中水分含量和可溶性固形物含量的方法。目前国内外基于近红外光谱技术对木薯的研究多集中在表征特征分析等方面,而对其灰分和水分含量进行快速检测模型的研究较少。本研究以海南省海南大学儋州校区农科基地木薯种质资源圃为依托,拟以137份不同木薯种质块根样品为定标和验证材料,进行样品光谱收集,获取木薯有效的近红外光谱信息,并运用各种光谱数据预处理技术和统计方法进行校正、验证,确定各参数的最佳优化设置,初步建立了木薯灰分和水分含量预测模型,以期为进一步建立其他重要品质性状指标模型提供基础,为木薯育种及资源品质改良研究提供高效准确快速的分析方法。
HTML
-
本研究所用的137份木薯种质种植于海南大学儋州校区农科基地木薯种植资源圃(海拔:380 m,109°49′E、19°51′N)。实验地块每年统一连续耕作,2021年4月种植,2022年3月收获,土质为红壤土。实验用的137份木薯块根取自同一地块,生长期同为6个月龄。取好样品后将木薯块根削皮、切段,并在60 ℃烘箱干燥24 h后,用研磨机研磨成粉状,过80目(0.18 mm)筛。粉碎后每个样品采用四分法分为2个重复,装入自封袋干燥避光处保存。
-
布鲁克MPA近红外光谱仪(美国布鲁克公司);DHG-9070A电热鼓风干燥箱(上海一恒科学仪器有限公司);EL204电子分析天平[0.001, 梅特勒有限-托利多仪器(上海)有限公司];300Y多功能粉碎机(中国伯欧五金制品有限公司);RE52AA旋转蒸发仪(上海亚荣生化仪器厂)。
-
采用漫反射扫描(diffuse reflectance scanning)方式扫描样品。扫描样品前将光谱仪开机预热30 min,以保证样品测试的稳定性[15]。在约25 ℃环境下,取适量处理后的木薯样品置于IN311/C旋转台上的IN311-S样品杯(直径50 mm)中,摊平,压实,以空气为空白背景扣除(每扫描1次样品粉末,均要以空气为空白进行背景扣除),用近红外光谱仪采集137份木薯样品NIRS图和CSV.格式的数据矩阵,并对137份样品进行全谱段光谱扫描,光谱范围为12 500~3 600 cm-1,测量通道为Sphere Macrosample Rotating,分辨率为16 cm-1,样品扫描64次,光谱点数为1 154。每个样品扫描3次,取3次的平均光谱。除所需样品信息外,获得的近红外光谱会因混入仪器和测试环境产生的无关信息,导致光谱基线漂移(spectral baseline drift)、散射和噪声等问题[16]。常规是通过多元散射校正(MSC)、一阶导数(1S)、二阶导数(2S)、Savitzky-Golay平滑模式(SG)、标准正态变量(SNV)等方法予以校正 [17-18]。导数处理常用来消除光谱中存在的背景干扰,Savitzky-Golay平滑消除噪声,SNV和MSC主要消除光散射[19]。在近红外光谱中,采用不同的前处理方法会得到不同的模型结果。
-
采用GB5009.3—2016和GB/T5009.4—2016法对木薯灰分和水分含量进行测定。将木薯样品在105 ℃烘箱中烘干过夜,直至达到恒重,以获得水分含量。灰分含量是在550 ℃下焚烧4 h后所得,每个样品重复测定2次。水分含量和灰分含量计算公式如下,
式(1)中,X含水量:样品含水量;M0:称量瓶恒重后的质量;M:样品的质量;M1:称量瓶与样品恒重后的质量。
式(2)中,X灰分含量:样品灰分含量;M1:坩埚和燃烧后残渣的质量;M0:空坩埚的质量;M:样品的质量;W:样品的含水量。
-
采用偏最小二乘回归(PLS)对定量数据进行校正。PLS法是一种基于“精度矩阵(the concentration matrix)包含无用信息,分解精度矩阵,消除精度矩阵中无用信息”的回归方法。通过最小化误差平方和(sum of squares of errors)来确定目标数据的最佳匹配函数,然后用最简单的最小化误差平方和的方法来获得真值。
-
模型A采用交叉验证均方根误差(RMSECV)评价模型的整体校正能力,由式(3)计算。
式(3)中,N:样本数量;P:主成分数量;Y:预测值;X:真实值。
模型B:预测均方根误差(RMSEP)是模型的整体预测能力评价指标,由式(4)计算。
式(4)中,N:样本数量;Y:预测值;X:真实值。
-
不同木薯品种的水分和灰分含量(表1)的对比分析结果表明,在不同品种的淀粉灰分含量中,14号(老板娘2号)含量最低,为1.03%,91号(50)含量最高,为4.26%,参试品种的灰分含量平均值为2.00%。通过对木薯不同品种的水分含量分析得知,49号(南美9号)含量最低,为1.57%,94号(417)含量最高,为8.45%,参试品种的水分含量平均值为4.54%。
编号No. 品种Name 灰分/%Ash/% 水分/%Water/% 编号No. 品种Name 灰分/%Ash/% 水分/%Water/% 1 F2000 2.78 ± 0.04 4.24 ± 0.25 28 SC201 1.98 ± 0.06 2.95 ± 0.33 2 东莞红尾 1.94 ± 0.04 4.19 ± 0.37 29 F202 2.14 ± 0.05 3.60 ± 0.16 3 Q10 1.89 ± 0.00 4.86 ± 0.31 30 F03P 2.34 ± 0.02 4.50 ± 0.35 4 JG1301 2.53 ± 0.03 3.65 ± 0.39 31 COL712 2.06 ± 0.04 4.71 ± 1.39 5 SC9 2.14 ± 0.06 4.81 ± 0.25 32 SC2 1.71 ± 0.01 4.14 ± 0.86 6 MF-元引983 1.19 ± 0.02 3.34 ± 0.81 33 CH20 1.39 ± 0.01 4.87 ± 1.27 7 2B 1.75 ± 0.02 3.58 ± 2.13 34 SC6 2.04 ± 0.06 5.13 ± 1.44 8 老板娘3号 1.68 ± 0.01 5.21 ± 0.07 35 COL715 1.93 ± 0.05 4.95 ± 0.65 9 GR3 2.24 ± 0.01 5.05 ± 0.33 36 T12 2.00 ± 0.02 3.39 ± 0.57 10 ME191 1.18 ± 0.03 5.43 ± 0.28 37 8229 2.07 ± 0.02 4.29 ± 0.78 11 C3 1.29 ± 0.03 3.14 ± 2.52 38 ITBB01 1.97 ± 0.03 3.90 ± 0.30 12 泰国 1.15 ± 0.00 4.73 ± 0.08 39 KU58 2.14 ± 0.05 4.02 ± 0.24 13 云南思茅 1.72 ± 0.00 3.56 ± 0.04 40 ME190 2.26 ± 0.05 3.31 ± 0.05 14 老板娘2号 1.03 ± 0.03 3.22 ± 0.78 41 CM3992 1.97 ± 0.05 4.18 ± 0.66 15 GR911 1.95 ± 0.04 4.46 ± 0.30 42 SC205 1.72 ± 0.00 4.31 ± 0.10 16 KU50 1.83 ± 0.03 3.90 ± 0.47 43 C222 1.74 ± 0.00 5.92 ± 3.29 17 SC124多倍体 1.84 ± 0.06 3.27 ± 0.98 44 SC10 1.64 ± 0.02 3.47 ± 1.24 18 775 1.72 ± 0.00 2.36 ± 1.18 45 F297 2.06 ± 0.02 4.74 ± 0.17 19 Dec-46 1.16 ± 0.03 4.45 ± 0.71 46 水果木薯 1.72 ± 0.01 3.87 ± 0.61 20 SC16 2.03 ± 0.04 4.47 ± 0.52 47 SC124 1.64 ± 0.01 3.20 ± 0.11 21 哥伦比亚18R 2.10 ± 0.05 2.43 ± 0.05 48 SC12 2.16 ± 0.04 4.42 ± 2.23 22 SC4 1.41 ± 0.05 1.89 ± 1.21 49 南美9号 2.25 ± 0.04 1.57 ± 0.42 23 利民 1.73 ± 0.01 5.46 ± 2.86 50 花叶木薯 1.93 ± 0.04 4.21 ± 0.28 24 罗勇80 1.23 ± 0.00 3.30 ± 0.45 51 罗勇90 1.72 ± 0.01 7.07 ± 0.27 25 COL713 1.05 ± 0.02 3.54 ± 0.40 52 宝岛9-5 1.96 ± 0.01 5.78 ± 0.01 26 SC5 1.12 ± 0.03 4.47 ± 0.26 53 E1340 1.52 ± 0.01 6.08 ± 0.74 27 GR6 1.91 ± 0.04 4.16 ± 1.00 54 ME189 1.39 ± 0.01 4.78 ± 0.55 续表1 Tab.1 Continued Table 1. Water and ash contents of cassava Germplasm Resources
编号No. 品种Name 灰分/%Ash/% 水分/%Water/% 编号No. 品种Name 灰分/%Ash/% 水分/%Water/% 55 NZ188 1.84 ± 0.06 5.76 ± 0.43 92 196 3.67 ± 0.33 4.04 ± 0.11 56 琼中1号 1.63 ± 0.04 4.71 ± 0.21 93 571 4.24 ± 0.19 3.86 ± 0.16 57 泰国种 1.57 ± 0.02 5.82 ± 0.00 94 417 3.05 ± 0.07 8.45 ± 0.21 58 新选048 1.65 ± 0.01 4.22 ± 1.94 95 ZM8229 4.12 ± 0.16 4.38 ± 0.21 59 H660 1.54 ± 0.05 5.3 ± 0.39 96 521 3.88 ± 0.00 4.17 ± 0.08 60 SC8辐射 2.41 ± 0.02 3.55 ± 2.64 97 SC8013 3.06 ± 0.08 3.33 ± 0.15 61 NZ199 1.23 ± 0.03 4.01 ± 1.69 98 274 3.27 ± 0.07 4.52 ± 0.07 62 ME187 1.89 ± 0.02 6.27 ± 0.29 99 428 4.20 ± 0.04 3.51 ± 0.05 63 276 1.78 ± 0.03 3.86 ± 1.00 100 6068 3.00 ± 0.05 6.42 ± 0.22 64 18R 2.09 ± 0.03 4.85 ± 0.11 101 MB 3.69 ± 0.14 3.61 ± 0.14 65 COC173 2.11 ± 0.06 3.49 ± 2.23 102 T3B1 2.35 ± 0.06 6.1 ± 0.04 66 C9 1.39 ± 0.01 5.22 ± 0.51 103 T2B 1.46 ± 0.03 6.24 ± 0.00 67 M-SC124 1.77 ± 0.06 5.64 ± 0.01 104 T1A1 2.63 ± 0.04 5.20 ± 0.21 68 MF556 1.25 ± 0.01 3.1 ± 2.34 105 T4C1 2.42 ± 0.03 5.47 ± 0.14 69 老板娘1号 1.16 ± 0.03 6.39 ± 1.2 106 T2A1 1.43 ± 0.03 6.01 ± 0.05 70 MF81 1.57 ± 0.04 4.91 ± 0.04 107 T3A1 1.98 ± 0.05 5.08 ± 0.07 71 F539 1.65 ± 0.01 4.95 ± 0.46 108 T4B1 1.32 ± 0.02 5.59 ± 0.07 72 M-GR911 1.65 ± 0.04 3.35 ± 1.16 109 T1C1 1.92 ± 0.05 5.01 ± 0.17 73 GR891 1.97 ± 0.03 4.24 ± 0.13 110 T4A1 1.26 ± 0.03 5.32 ± 0.35 74 MF648 1.41 ± 0.02 4.19 ± 0.75 111 T3C1 3.36 ± 0.04 5.35 ± 0.14 75 MF671 1.29 ± 0.02 5.10 ± 0.30 112 T2C1 2.66 ± 0.05 4.76 ± 0.28 76 SC7 2.92 ± 0.04 4.98 ± 0.50 113 T1B 1.96 ± 0.04 5.18 ± 0.04 77 M 糯米 1.49 ± 0.04 4.55 ± 0.52 114 1 崖州扁豆左6 2.36 ± 0.03 5.46 ± 0.21 78 C576 1.84 ± 0.03 4.34 ± 1.47 115 1 撒播黑豆右3 3.08 ± 0.02 4.33 ± 0.07 79 C1030 1.56 ± 0.05 7.70 ± 0.90 116 1 柱花草左 7 2.67 ± 0.01 3.72 ± 0.14 80 MF532 1.99 ± 0.03 4.29 ± 0.93 117 1 崖州扁豆左5 2.73 ± 0.09 4.22 ± 0.28 81 SC8 1.64 ± 0.03 4.50 ± 0.63 118 1 花生左6 2.29 ± 0.06 4.53 ± 0.32 82 MF359 1.19 ± 0.01 6.13 ± 1.75 119 1 花生右1 3.26 ± 0.01 4.36 ± 0.24 83 M-FC10 1.67 ± 0.01 3.50 ± 0.69 120 1 对照2右3 1.99 ± 0.05 2.41 ± 0.08 84 MSC5 1.07 ± 0.02 3.94 ± 0.93 121 1 崖州扁豆右4 1.99 ± 0.02 3.61 ± 0.08 85 E407 1.77 ± 0.00 3.61 ± 0.96 122 1 柱花草右3 1.85 ± 0.03 3.25 ± 0.13 86 MF181 1.12 ± 0.02 4.02 ± 1.17 123 1 崖州扁豆右6 1.20 ± 0.02 3.16 ± 0.11 87 M-SC4 1.41 ± 0.01 2.47 ± 0.01 124 1 油菜花3左1 2.72 ± 0.05 3.37 ± 0.23 88 OOO 1.25 ± 0.01 3.96 ± 0.42 125 1左撒崖州扁豆 1.78 ± 0.03 4.24 ± 0.09 89 SC11 1.79 ± 0.00 5.68 ± 0.02 126 1黑豆撒左4 2.59 ± 0.08 3.59 ± 0.35 90 F274 2.26 ± 0.02 4.10 ± 1.68 127 1花生左4 2.48 ± 0.01 3.17 ± 0.20 91 50 4.26 ± 0.07 4.07 ± 0.07 128 1对照左1 2.04 ± 0.06 3.61 ± 0.23 续表1 Tab.1 Continued 编号No. 品种Name 灰分/%Ash/% 水分/%Water/% 编号No. 品种Name 灰分/%Ash/% 水分/%Water/% 129 1崖州扁豆撒右2 2.61 ± 0.07 2.56 ± 0.40 134 1 油菜间作撒右1 2.26 ± 0.06 6.35 ± 0.13 130 1柱花草2右2 2.40 ± 0.02 6.44 ± 0.28 135 1柱花草1左2 2.20 ± 0.02 7.63 ± 0.10 131 1柱花草右5 1.90 ± 0.03 6.39 ± 0.08 136 1右8对照 1.06 ± 0.02 7.14 ± 0.09 132 1撒播柱花草右4 2.29 ± 0.01 6.49 ± 0.07 137 1对照左8 1.07 ± 0.01 8.15 ± 0.11 133 1花生右7 1.17 ± 0.04 7.56 ± 0.57 注: 崖州扁豆、柱花草、花生、油菜花分别代表与木薯SC9品种间作的不同植物种类。Note: Macrotyloma uniflorum ‘Yazhou’,stylosanthes, peanut and rape flower represent different plant species intercropping with cassava SC9 variety respectively
-
在TQ Analyst 9.0分析软件中,采用偏最小二乘法(PLS)对137份木薯样品进行光谱离群值剔除(Spectrum Qutlier)分析,未发现存在影响定量模型建立的异常样本[20],同时根据软件优化选择测定灰分和水分2个指标的校正集与验证集,保证将最小和最大含量值的样本划入校正集中,具体划分见表2。
成分Component 校正集Correction set 验证集Validation set 样本量sample size 范围Range 样本量sample size 范围Range 灰分/%Ash/% 117 1.030~4.260 20 1.150~4.200 水分/%Water/% 117 1.570~8.450 20 2.470~7.140 Table 2. Sample information of correction set and verification set
-
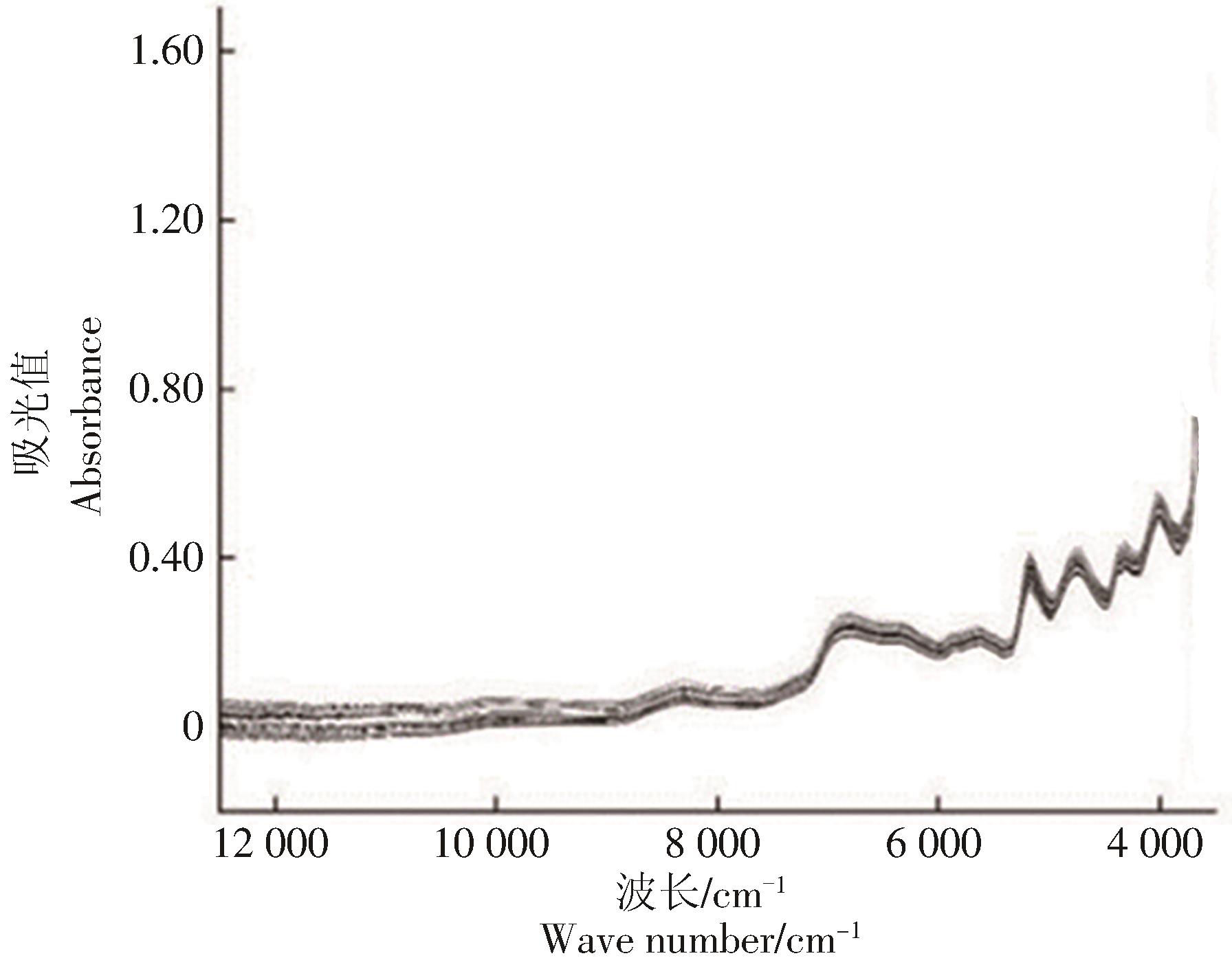
对木薯样品光谱数据在测定波长范围内进行总体方差计算,以每一波长点的方差值[D(X)]对波长作图(图2),观察光谱数据变异性大小[21]。由图2可见,在6 184.92~4 309.97 cm-1和3 750.18~3 594.66 cm-1波段内曲线波动明显,数据变异性强,可见在此区间内的信息量丰富。以此波段为特征区间,考察全光谱波段(用a表示)与此特征区间(用b表示)的建模效果。
为了将全光谱波段与模型优化预测波段进行比较,确定最佳建模波段,分别考察了全光谱波段和光谱波段特征区间(5 800~4 300cm-1和4 000~3 600 cm-1)的建模效果(表3)。检测MSC、1S、2S、SG和SNV 5种预处理方法对定量建模影响,以校正模型标准差(RMSEC)、预测均方根误差(RMSEP)、交叉验证均方差(RMSECV)和相关系数(R)作为模型的评价指标,结果表明,对于水分和灰分,经 MSC+2S+SG预处理后,在选择b波长区间分别建立模型时,R值最大,RMSEC、RMSEP以及RMSECV接近于0。这说明经MSC+2S+SG预处理后,选择b为建模区间得到的模型预测结果更准确[22]。
指标Index 预处理Pretreatment 区间Section 相关系数R 校正标准差RMSEC 预测标准差RMSEP 交叉标准差RMSECV 灰分Ash Constant(原始) a 0.742 8 0.457 0 0.636 0 0.514 0 b 0.759 8 0.444 0 0.591 0 0.498 0 MSC a 0.769 4 0.436 0 0.403 0 0.509 0 b 0.774 4 0.432 0 0.675 0 0.575 0 SNV a 0.770 8 0.435 0 0.404 0 0.518 0 b 0.729 4 0.467 0 0.633 0 0.579 0 MSC+1S+SG a 0.826 39 0.384 0 0.636 0 0.515 0 b 0.904 0 0.292 0 0.521 0 0.535 0 SNV+1S+SG a 0.828 8 0.382 0 0.628 0 0.513 0 b 0.906 2 0.289 0 0.554 0 0.495 0 MSC+2S+SG a 0.873 5 0.332 0 0.820 0 0.590 0 b 0.944 9 0.223 0 0.210 0 0.398 0 SNV+2S+SG a 0.876 0 0.329 0 0.810 0 0.623 0 b 0.925 7 0.270 00 0.247 0 0.495 0 水分Water Constant(原始) a 0.788 8 0.784 0 1.280 0 1.440 0 b 0.693 9 0.919 0 1.300 0 1.440 0 MSC a 0.778 0 0.801 0 1.340 0 1.280 0 b 0.685 5 0.929 0 1.280 0 1.420 0 SNV a 0.784 1 0.792 0 1.380 0 1.440 0 b 0.696 2 0.916 0 1.400 0 1.470 0 MSC+1S+SG a 0.841 4 0.689 0 1.450 0 1.500 0 b 0.820 7 0.729 0 1.220 0 1.530 0 SNV+1S+SG a 0.844 8 0.683 0 1.450 0 1.480 0 b 0.884 7 0.595 0 1.370 0 1.640 0 MSC+2S+SG a 0.863 5 0.643 0 1.710 0 1.620 0 b 0.926 4 0.480 0 1.460 0 1.540 0 SNV+2S+SG a 0.862 8 0.645 0 1.710 0 1.620 0 b 0.892 6 0.575 0 1.340 0 1.590 0 注: 区间a:全光谱波段;区间b:光谱波段特征区间(5 800~4 300 cm-1和4 000~3 600 cm-1)。Note: Interval a: full spectrum band; Interval b: spectral band characteristic interval (5 800~4 300 cm-1 and 4 000~3 600 cm-1)Table 3. Investigation results of different pretreatment and modeling intervals
-
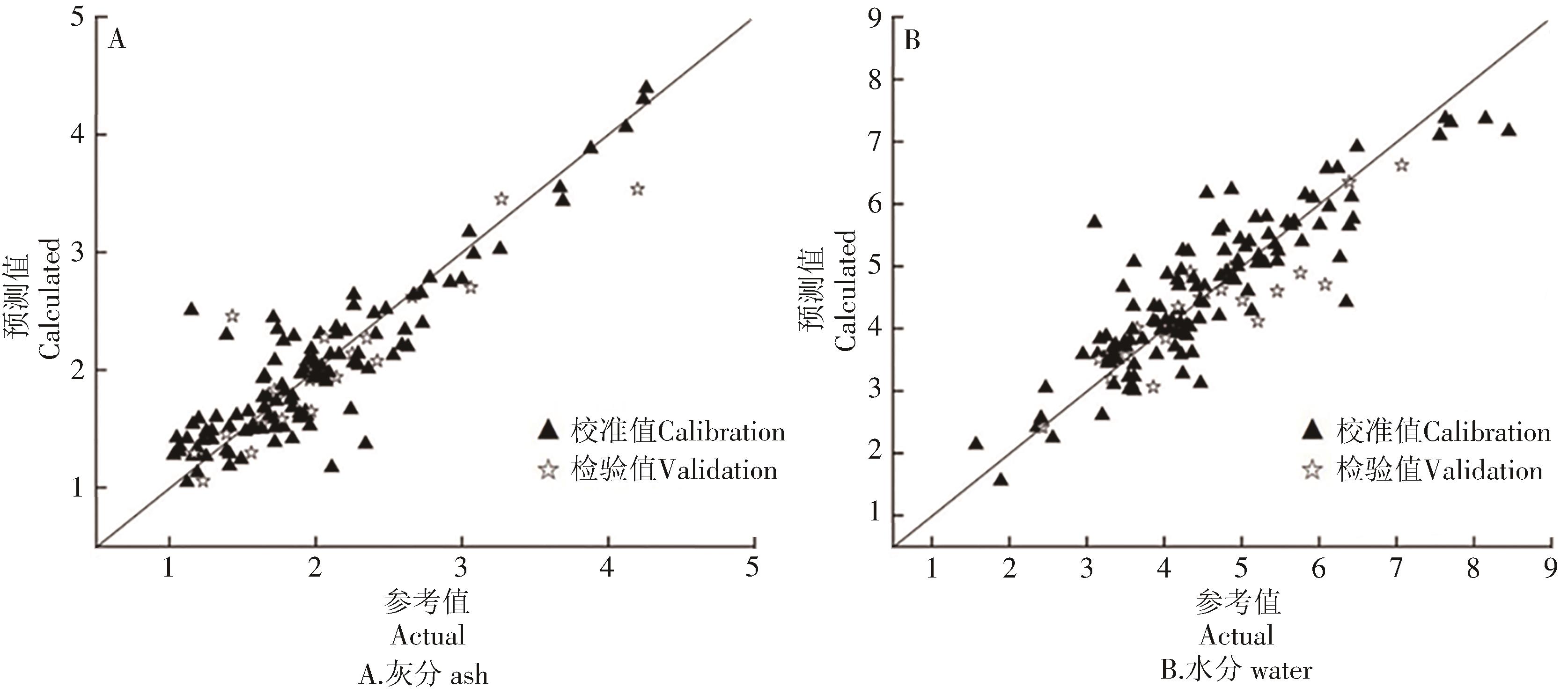
根据上述最佳光谱预处理法和最优建模区间,采用PLS建立灰分和水分的近红外定量分析模型。最优定量模型均为通过MSC+2S+SG处理,以5 800~4 300 cm-1和4 000~3 600 cm-1为建模区间建立而成。通过RMSECV对主因子数作图获得最佳主因子数分别为14、16;模型相关系数(R)分别为0.944 9、0.926 4;RMSEC依次为0.223 0、0.480 0;RMSEP依次为0.210 0、1.460;RMSECV依次为0.398 0和1.540。R值均接近于1,表明预测值与参考值间存在良好的相关性(图3)。
-
为进一步研究灰分与水分2种优化模型的可预测性,分析偏最小二乘法拟合得到验证集指标值与真实值的拟合程度,在95%置信区间内进行配对t检验,分别检验最优模型的拟合值,验证定量模型可靠性,可在实际检测中实时反馈木薯品质。选用未参与建模的20份木薯种质资源对该模型进行外部验证,预测值与真实值进行差异性分析,(P>0.05),P值分别为0.464、0.459,说明差异无显著性。由此表明,实验建立的预测模型可实现对不同产地木薯的灰分和水分的快速无损检测。
-
由于化学成分在不同波长处吸收强度差异,不同波长段所蕴藏的信息差异明显,选择合理波长范围和预处理方法可有效地提高模型性能。近红外光谱(NIRS)与多变量分析相结合已被用于测定木薯块根中的类胡萝卜素、纤维素、氰化物、干物质、淀粉、总糖和总氮含量等多种营养成分[23-25],但对灰分和水分含量的测定模型构建仍然有待研究,本研究结果可以对其进行补充完善。李荣[26]在对波长5 296~12 000 cm-1内益智水分和灰分含量进行NIRS定量分析模型构建后发现,MSC+2S+SG和SNV+2S分别为益智水分和灰分建模的最佳预处理方法,这与本实验结果相类似[27-29]。定标模型建好后,检测木薯样品中的水分、灰分的含量仅需光谱扫描和软件分析2步即可完成。此外,利用近红外方法进行分析测定,所得结果较为准确,且稳定性较高,可以有效减少样品的损耗,具有较好的应用前景[30-33]。
本研究采集的木薯样品均来自同一产地,所测灰分和水分含量分布范围广,具有一定的代表性,可用于分析模型的建立。考虑到木薯产地分布广泛,种属较多,定量分析模型在实际应用过程中需补充新的样品对模型进行完善,以扩大模型的适应性。
-
本研究建立了新型的近红外光谱分析新方法,能够成功用于快速检测木薯水分、灰分的含量。结果显示,水分和灰分的最优定量模型均为通过MSC+2S+SG处理,以5 800~4 300 cm-1和4 000~3 600 cm-1为建模区间建立而成。预测值与真实值之间无显著差异,由此表明2种方法之间不存在明显系统误差。









 DownLoad:
DownLoad: