-
植物原生质体是植物细胞壁以内的原生质部分。因为原生质体没有细胞壁,所以可以直接进行杂交,很容易就克服了远缘杂交不亲和障碍;同时由于原生质体没有细胞壁的保护,避免了核酸酶对外源DNA的破坏,易于摄取细胞器、蛋白等外源大分子,为植物遗传转化提供了一条新的途径。因此原生质体被认为是细胞生理学、发育生物学、细胞生物学以及细胞遗传学研究的理想材料[1]。本文介绍了原生质体的分离方法:机械分离法和酶解法。酶解法更适合大多数植物。对比了四种原生质体转化的方法,分析了它们的优缺点。不同的植物可以采用不同的转化方法。以期为建立植物原生质体分离及瞬时转化体系提供参考,为原生质体系统更广泛地应用于多种植物提供帮助。
-
原生质体的数量、大小和活力受植物材料的影响较大。可以用于原生质体分离的材料有很多,比如:叶、根、胚状体、花瓣等。绝大多数原生质体分离的原材料是植物幼嫩叶片,它们数量多,取材简单方便,在适宜的条件下可以获得大量活性高的原生质体[2]。植物叶肉原生质体已从烟草(Nicotiana tabacum L.)[3]、拟南芥(Arabidopsis thaliana(L.)Heynh.)[4]、玉米(Zea mays L.)[5]、水稻(Oryza sativa L.)[6]等植物中成功分离,但是有些植物也只有幼嫩叶片才能分离出原生质体。比如:在橡胶树原生质体分离研究中,发现只有古铜期和变色期能分离出高质量的原生质体[7];对于棉花而言,叶片一旦达到充分伸展程度,分离原生质体就十分困难,所以必须选取刚展平的棉花真叶为材料[8]。除了叶片之外,其他的植物组织也可以作为原生质体分离的材料,如玫瑰(Rosa spp.)[9]和石斛(Dendrobium nobile Lindl.)[10]的花瓣、根细胞和胚状体等。部分植物原生质体的分离材料、数量、活性如表1所示。
分离材料 分离原生质体数量 原生质体活性 植物种类 叶片 (4.3±1.6)×106/g 90%以上 烟草(Nicotiana tabacum L.)[13] 叶片 6.7×105/mL 90%以上 拟南芥(Arabidopsis thaliana(L.)Heynh.)[14] 叶片 5.6×105/mL 96% 玉米(Zea mays L.)[14] 叶片 19.7×107/g 97.6% 橡胶(Hevea Brasiliensis Muell. Arg)[7] 叶片 4.46×105/g 金花茶(Camellia petelotii(Merr.)Sealy)[15] 叶片 6.4×105/mL 78.0% 百合(Lilium brownii var. viridulum Baker)[16] 真叶 8.1×106/mL 96% 棉花(Gossypium spp)[8] 幼叶 4.5×106/g 90%以上 小麦(Triticum aestivum L.)[17] 组培苗叶片 2.04×106/g 90%以上 马铃薯(Solanum tuberosum L.)[18] 幼嫩叶片 2.90×106/g 88.1% 矮牵牛(Petunia hybrida(Hook.)E. Vilm.)[19] 叶片 87.1×106/g 80. 53% 菜豆(Phaseolus vulgaris L.)[20] 叶片 1.21×106/g 85% 松叶猪毛菜(Salsola laricifolia Turcz. ex Litv.)[21] 叶片 1.09×106/mL 90% 梨(Pyrus spp)[22] 叶片 1.17×106~
5.71×106 g81.19%~
90.69%连翘(Forsythia suspensa(Thunb.)Vahl)[23] 叶肉 5.62×106/g 87.13% 舞春花(Calibrachoa elegans(Miers)Stehmann & Semir)[24] 叶片 9.05×105/mL 91.7% 白桦(Betula platyphylla Sukaczev)[25] 叶片 2.1×104/mL 93.1% 油麦菜
(Lactuca sativa var longifoliaf. Lam)[26]花粉 3.8×105/mL 27.3% 酸枣(Ziziphus jujuba var. spinosa(Bunge)Hu ex H.F.Chow.)[27] 花瓣 1.5×106/mL 78% 玫瑰(Rosa spp.) [9] 花瓣 2.0×106/mL 90%以上 石斛(Dendrobium nobile Lindl.)[10] 花瓣 2.96×106/g 77.5% 茉莉花(Jasminum sambac(L.)Aiton)[28] 花药愈伤组织 7.2×105/g 穿心莲(Andrographis paniculata(Burm. f.)Wall. ex Nees in Wallich)[29] 愈伤组织 4.02×106/mL 90%以上 大豆(Glycine max(L.)Merr.)[30] 愈伤组织 6.44×105/g 59.6% 三七(Panax notoginseng(Burkill)F. H. Chen ex C. H. Chow)[31] 叶片及胚轴部分 3.0×106/g 66.9% 光果甘草
(Glycyrrhiza glabra L.)[32]叶片 4.09×106/g 83.12% 葡萄( Vitis vinifera L.)[33] 愈伤组织 6.05×106/g 84.13% 葡萄 叶片 4.25×105/g 82.79% 萱草(Hemerocallis fulva(L.)L.)[34] 花瓣 4.33×105/g 82.53% 萱草 叶片 6.0×106/g 96% 水稻(Oryza sativa L.)[35] 幼颈 1.68×107/g 96% 水稻 花苞 9.1×107/mL 92% 槟榔(Areca catechu L.)[12] 叶片 7.3×106/mL 88% 槟榔 胚状体 5.0×106/mL 89% 槟榔 叶片 8.2×106/g 72.74% 花椒(Zanthoxylum bungeanum Maxim.)[36] 愈伤组织 3.1×106/g 59.15% 花椒 悬浮细胞 5.4×106/g 63.92% 花椒 同种植物的不同部位分离出的原生质体数量、活性也不相同。比如本氏烟草和烟草K326的根细胞作为实验材料分离原生质体,本氏烟草根尖原生质体比烟草K326原生质体的活性高、碎片少。同样裂解条件下,获得的K326和本氏烟草的根尖原生质体数量相当,均达到105数量级[11] ;曹春艳等采用酶解法分别以槟榔(Areca catechu L.)嫩花苞、嫩叶片、胚状体为实验材料,对影响其原生质体产率、活力的因素进行了研究, 结果表明:槟榔花苞在酶解4 h时的产量和活力最高,产量为9.1×107个·mL−1,活力为92%[12]。
-
原生质体的分离方法主要有机械分离法、酶解分离法。原生质体的机械分离法是借助于利器如刀或机械磨损等措施使细胞壁破损,促使原生质体释放的方法,即将叶肉细胞、愈伤组织和液体悬浮培养细胞置于高渗的糖溶液中,使之发生质壁分离,原生质体收缩成球形,然后用剪刀剪碎组织,就可切开细胞壁获得少量完整的原生质体。
酶解法分离原生质体是一个常用的技术,其原理是使用纤维素酶、半纤维素酶、离析酶和果胶酶去除细胞壁,得到原生质体。果胶酶和离析酶主要分解细胞之间的果胶,促使细胞彼此分离。在原生质体分离时,常将纤维素酶和果胶酶混合使用,利用果胶酶分解果胶质,再在纤维素酶的继续作用下把细胞壁分解而释放出原生质体。笔者对两种分离方法的优缺点进行了比较,从表2可以看出,酶解分离法更适合植物原生质体的分离,具有广适性。
优/缺点 机械分离法 酶解分离法 优点 细胞不会受到酶的伤害,有利于开展生理生化研究。 (1)酶解分离法可以获得大量原生质体。(2)几乎可以从所有植物的组织器官中分离得到原生质体。(3)酶解时仅发生轻微的渗透收缩,不必发生质壁分离,对活细胞的损伤较轻。 缺点 (1)一般只有在薄壁组织排列松散、细胞间接触点很少时,用机械法分离叶肉细胞才能取得成功,如洋葱球茎鳞片、萝卜根、菜根组织等。(2)机械法分离游离细胞其产量低,不易获得大量活性细胞,所以一般不用这种方法。 酶会影响原生质体的活力。 -
酶解分离方法获得的原生质体数量多,完整性好,具有广适性。目前,主要利用此方法分离植物的原生质体,比如:拟南芥可以分离出3.0×107个·g−1原生质体[37]、玉米原生质体数为1.5×106个·g−1 [38]、水稻原生质体数为1.0×107个·g−1 [39]、美国榆(Ulmus americana L.)原生质体数为2×106个·mL−1 [40]。酶解法分离原生质体的主要影响因素是植物材料的预处理和酶解条件(酶的种类、渗透压、酶解时间、温度光照)。
-
植物组织的预处理通过增加酶进入植物细胞壁的途径来增加分离活原生质体的数量。这可以通过组织的物理破坏或酶溶液的真空渗透处理来实现。提取甘蓝(Brassica oleracea var. capitata Linnaeus)的原生质体时,将15 g的甘蓝叶切成约1~2 mm的小碎块,增加酶解液和甘蓝叶的接触面积,使酶更好地进入植物细胞壁。从而获得高质量的原生质体[41]。分离玉米叶片原生质体时,采用抽真空的方式让酶解液渗透到玉米叶片中。在压力最高0.1 MPa时抽真空40~50 min得到呈圆球状的玉米原生质体,此时原生质体数量较多且杂质很少[42]。
-
酶解液的组成对分离原生质体至关重要。植物细胞壁的主要成分是纤维素和果胶,所以在分离植物原生质体时,一般使用的是纤维素类酶和果胶类酶。由于不同植物或不同组织的细胞壁中纤维素和果胶含量存在差异,所以一般分离原生质体时选用的酶种类和含量也有很大差异,并且也会根据试验材料的不同性质添加离析酶、半纤维素酶、崩溃酶等[43]。同种植物的不同部位在分离原生质体时使用的酶解液的种类和浓度也不同,比如烟草叶肉细胞在含1%纤维素酶、0.5%离析酶中得到产量及活力均较高的原生质体,而烟草根细胞最佳酶解液组合为1.5%纤维酶+1.5%果胶酶[44]。
-
由于原生质体不具有细胞壁,外界较低的渗透压会导致原生质体的破裂、死亡,为保证分离出原生质体的活性以及质膜的稳定,需要向酶液里加入一定量的渗透压稳定剂,常用的渗透压稳定剂有甘露醇、葡萄糖、山梨糖醇等,浓度范围一般在0.3~1.0 mol·L−1之间,其特点是不会被细胞吸收和利用[45]。不同的植物原生质体所需的渗透压也不同,比如:穿心莲花药愈伤组织原生质体以0.6 mol·L−1甘露醇为渗透压稳定剂[29],梨(Pyrus spp)叶片原生质体以0.5 mol·L−1甘露醇为渗透压稳定剂[22]。
-
原生质体酶解的时间通常为2~18 h。酶解的持续时间需要足够长,以释放足够数量的原生质体,但也不能过长,以免由于细胞损伤或酶解溶液中缺乏营养和生长调节剂而降低生存能力。例如:以甜樱桃(Prunus avium L.)果肉悬浮细胞为分离材料时,最佳酶解时间是18 h[46];拟南芥的叶片只需要3 h就可以分离出大量且活性强的原生质体[47]。
-
温度对原生质体产量和活力也起着重要作用,一般情况下室温的原生质体活力最高。为了将温度产生的影响减到最小,分离原生质体时的温度优先使用接近于原料生长或后续培养原生质体的温度。在光或暗条件下进行酶解也会影响原生质体分离,一般情况下选择暗条件,这可以避免在含有叶绿体的细胞中产生自由基和光抑制。但是也发现在光照条件下酶解消化效果比在黑暗中更好的例子,如:在天竺葵叶片原生质体分离中,在光照条件下酶解,原生质体产量和活力都显著增加,而在黑暗中酶解时,释放的大多数原生质体破裂[48]。
-
根据不同细胞的类型及 DNA 转化方式,目前已经建立了多种原生质体的基因瞬时表达体系,主要包括农杆菌介导法、聚乙二醇介导法(PEG)、电击法和显微注射法等。
农杆菌介导转化:将目的基因插入农杆菌的Ti质粒上的T-DNA上,T-DNA可转移到受体细胞并且整合到受体细胞的DNA上[49]。
PEG介导转化:PEG能够粘合细胞干扰细胞膜磷脂双分子层并破坏细胞表面电位稳定,进而协助质粒或者T-DNA导入细胞内部 [50]。
电击法:在一定电压的刺激下将外源DNA分子导入原生质体的一种方法。植物细胞膜在非常短暂的高电压脉冲刺激后,会短暂地出现一些小孔通道,而外源 DNA分子则可以迅速通过这个通道进入到原生质体中 [51]。
显微注射法:在显微镜下直接将DNA分子注射入原生质体并进行表达的方法[52]。
笔者对4种转化方法进行了比较(表3),目前最常用的植物原生质体转化法是PEG介导法和电击法。
优/缺点 农杆菌介导法 PEG介导法 电击法 显微注射法 优点 (1)农杆菌Ti质粒转化系统操作比较容易,需要的仪器设备简单,易于推广。(2)是利用天然的遗传转化系统,成功率高,效果好。(3)T-DNA区可插入高达50kb大小的外源DNA片段。 操作简单、高效、成本低,所以是应用最广的一种方法。 电穿孔几乎对任何类型的细胞都有效,现在是细菌和某些动物细胞系遗传转化的首选方法。 可准确导入外源基因,转化频率高,不需载体,直接获得纯系,实验时间短。 缺点 农杆菌介导法大多数需经过组织培养阶段,操作复杂,周期长,再生植物难度大。 (1)该方法涉及许多步骤和关键试剂,每个步骤都需要优化,试剂的质量需要严格检验。(2)聚乙二醇的有效浓度范围较窄,对细胞具有毒性。 对原生质体的活性要求高,在电击过程中有相当一部分原生质体被电击致死,处在边缘或活性不强的原生质体很可能被电击致死。 (1)设备精密而昂贵、操作技术需要长时间的练习。(2)每次只能注射有限的细胞。 -
植物原生质体的转化方法主要是PEG介导法和电击法。关于PEG介导法转化效率和细胞存活率,需要考虑的主要因素是植物种类、PEG浓度、转染时间、DNA浓度和原生质体数量[53]。植物的种类会影响原生质体的转化效率,不同品种的植物对原生质体的转化效率影响不大。相同条件的PEG转化方法对玉米、小麦、水稻原生质体进行转化,转化率各不相同。玉米的转化率为 76.86%,小麦的转化率为 55.79%,水稻的转化率较高,达到 81.17%[54]。以不同品种的牵牛花分离出的大量活性高的原生质体为瞬时转化做基础的研究结果表明,2.5×105 个•mL-1原生质体,40% PEG,10 µg质粒和15 min的转染时间,都可以获得高达80%的转染效率 [55]。PEG的浓度也是影响原生质体瞬时表达的因素之一,不同植物的原生质体转化需要的PEG浓度各不相同。Wu等[56]在研究木薯原生质体瞬时转化体系时,分别将15%、20%、25%、30%的PEG4000加入到原生质体和质粒的混合液中(200 µL 1×107 个·mL−1原生质体和15 μg pA7-GFP)中,在室温下分别静置5、10、15、20 min后,加入3倍体积的W5溶液,离心2次(920 r·min−1离心 2 min)。WI溶液(4 mmol·L−1 MES, 9%甘露醇,20 mmol·L−1 KCl, pH 5.8)重悬,在室温下黑暗处理过夜表达,第2天用激光共聚焦镜检查看转化效率,结果表明当PEG4000浓度为25%,转染时间为10 min时,表达效率最高可达到70.8% [56]。质粒的数量和浓度会影响转化效率,对于棉花(Gossypium spp)而言,分别用8、12、16、20 μg质粒进行原生质体转化效率的测试;当使用16 μg质粒转化时,转化效率最高(35%~45%)。与质粒浓度相比,转化时间对转化效率的影响较小,为了防止原生质体破裂,转化时间一般在12~18 h [57]。
因为有许多因素(脉冲电压、脉冲长度、脉冲数、细胞数、DNA浓度和电穿孔缓冲液)会影响原生质体的转染效率和细胞的存活,所以电穿孔法没有PEG介导法应用广泛,但在有些植物的原生质体转化中电穿孔法比PEG介导法更有效。对甘蓝原生质体进行转化时,用电穿孔法转化效率为3.4%,而用PEG介导法的转化效率是1.8%;电穿孔转化效率几乎是PEG介导法的2倍[58]。电穿孔法必须在脉冲电压、脉冲长度、脉冲数、细胞数、DNA浓度都适宜的条件下才能达到最佳转化效率,比如:对龙胆胚胎细胞悬浮衍生原生质体培养的影响。超过1 kV·cm−1的高电场电压显著降低了原生质体的存活和分裂;1个脉冲比2个脉冲的原生质体活力高9倍;在5 ms原生质体失去活性,40 μs又不能使原生质体分裂,只有在20 μs脉冲的原生质体活性和分裂率最高,分别为70%和44.5%[59]。大多数植物用PEG法转化可以达到高转化率,比如:矮牵牛叶原生质体转化效率可以达到90%[60],小麦叶原生质体和水稻原生质体可以达到80%[61]。
-
原生质体没有细胞壁所以可以同时被几种DNA结构高效转染,而且瞬时表达实验一般在2 d内就可以完成[62],不需要无菌操作,所以操作起来更加简单方便。组织器官切片观察操作复杂、结果不清晰,而原生质体细胞可以直接用显微镜观察结果更加直观,因此原生质体已被广泛应用于基因表达分析[63]、启动子活性检测[64]、蛋白-蛋白互作[65]、亚细胞定位[66]、基因编辑等方面[67]。
-
原生质体在分子生物学中的应用广泛,尤其是在亚细胞定位和植物蛋白质互作中。为了准确地了解蛋白质的功能,需要用亚细胞定位来判断蛋白质发挥功能的场所。用烟草或洋葱做亚细胞定位的过程复杂,成功率低,费时费力,成本较高,而原生质体瞬时转化是高效检测蛋白质亚细胞定位的方法;该方法仅需要瞬时转化1个质粒即可检测蛋白质亚细胞定位;该方法简单、便捷、高效、节约成本。原生质体进行瞬时表达时间短,不需要无菌操作,因此广泛用于蛋白质互作实验,并且可完成高通量快速检测。烟草叶片原生质体的瞬时表达系统可以在一周内完成基因表达、亚细胞定位和测试许多蛋白质的功能[68]。仝亚楠等[69]通过反复试验确立了苋菜原生质体分离制备和瞬时转化体系,并利用该体系确定了一个苋菜甜菜红素合成调控相关的MYB转录因子定位在细胞核中。Mg2+转运蛋白基因在菠萝原生质体中的共定位分析与烟草瞬时表达系统的结果一致,证实了原生质体分离方法可以用于亚细胞定位的研究[70]。Huo等 [71]将WOX1基因克隆到pJIT166-GFP基因中产生WOX1-GFP克隆产物,并将其转染到百合的原生质体中,发现LhWOX1-GFP在细胞核中产生绿色荧光。
以玉米胚乳细胞建立的胚乳原生质体瞬时转化系统,可用于亚细胞定位、双分子荧光互补等[72]。Jia等[73]在运用豆类根细胞原生质体转化系统研究亚细胞定位时,克隆了2个共生相关基因,SYMRK是一种在质膜上表达的共生受体样激酶;ERN1则是在细胞核中表达,用激光共聚焦镜检时观察到相应的部位有绿色荧光。以蝴蝶兰(Phalaenopsis aphrodite Rchb. f.)为实验材料建立的原生质体分离及瞬时表达系统,被成功应用于亚细胞定位和蛋白质之间相互作用 [74]。原生质体瞬时表达系统是蛋白质之间相互作用的可靠工具,也是多种信号转导途径中维持蛋白质稳定性的基础 [75]。还可以使用多个载体同时转化原生质体,并且成功地表达了BiFC载体,用于检测蛋白互作以及用于大豆原生质体中细胞器和亚细胞定位的多种荧光蛋白[76]。
-
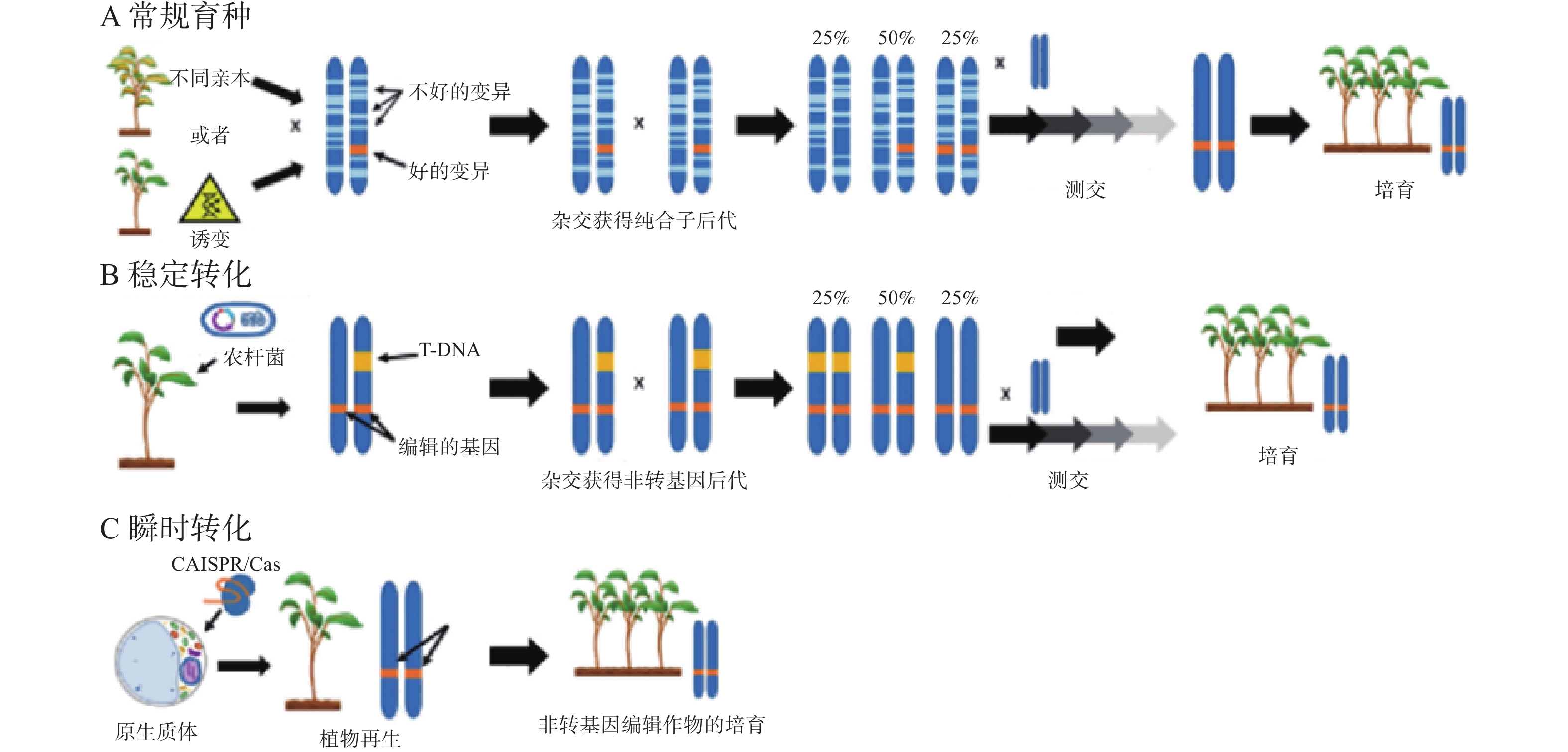
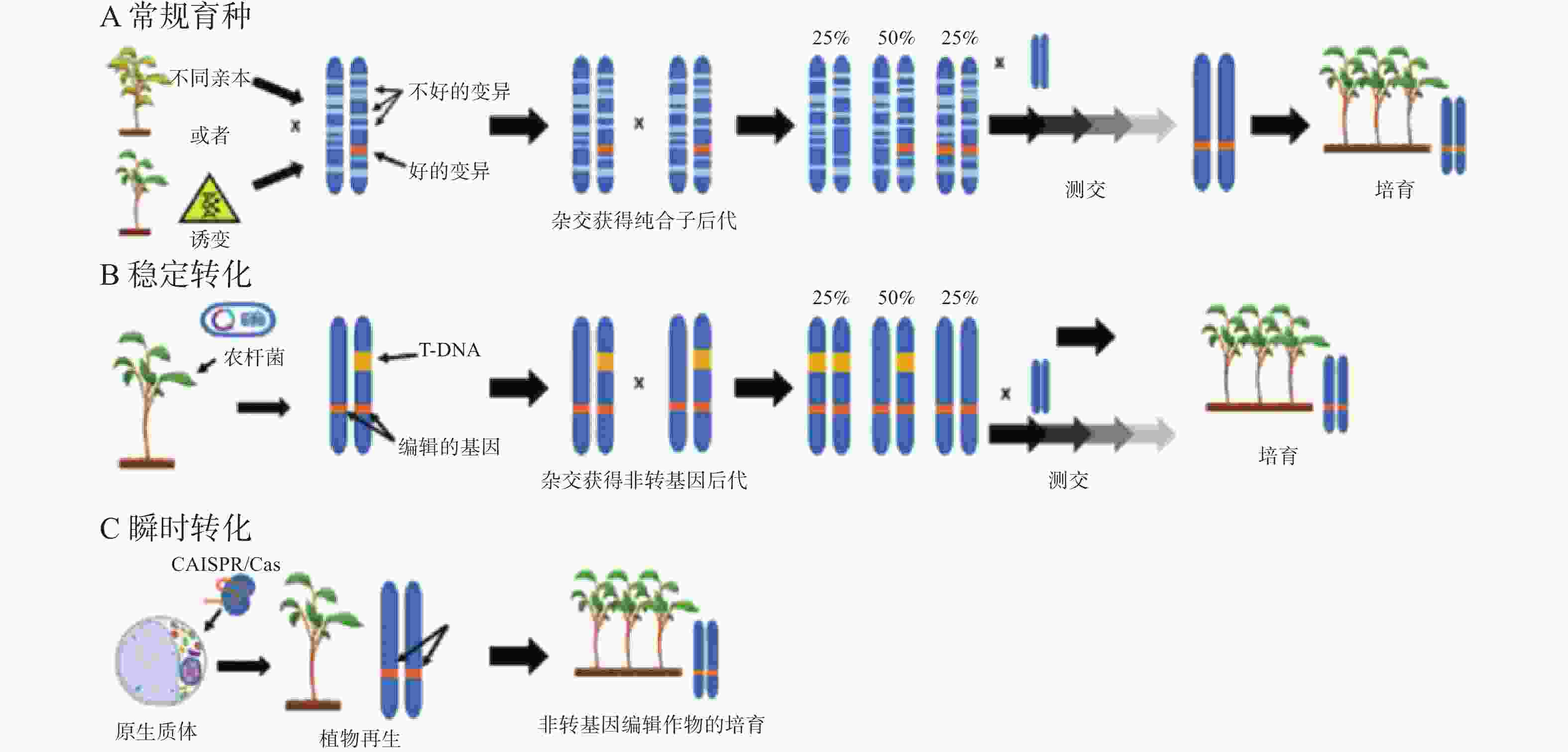
通过常规育种方法选育优良作物品种,需要经过几代的杂交才能筛选出亲本植株的特性,过程十分漫长、耗时较长(图1-A)。另一个方法是将诱变群体的新性状导入作物,修改作物基因的方法则比传统育种方法节省几年时间[77]。目前高效修改作物基因的方法是将转基因CRISPR/Cas9构建体插入宿主基因组,然后自交获得无转基因后代(图1-B)。而原生质体的瞬时转化系统只需要克隆1代就可以获得所需的遗传结果,因为原生质体可以直接进行基因编辑,避免了外源DNA整合到宿主基因组中(图1-C)。
基因编辑一直是分子生物学研究的一个长期挑战,特别是对于拥有复杂基因组的植物。BBM转录因子的瞬时表达促进了原生质体衍生愈伤组织的再生,促进了四倍体马铃薯(Solanum tuberosum L.)植物的基因编辑,并为多倍体生物的复杂遗传操作开辟了道路[78]。瞬时表达系统诱导胡萝卜基因组中的靶向突变,易生成大量无转基因、基因编辑的胡萝卜(Daucus carota var. sativa Hoffm.) [79]。Poddar等[80]用体外组装的Cas9gRNA核糖核蛋白转染S/M0、S1和M1的原生质体与不同分离方法的原生质体进行比较,还转染了水稻幼苗分离出的原生质体,结果表明,通过NGS鉴定和量化Cas9切割位点的编辑,S/M0原生质体和幼苗来源的原生质体的编辑率相似,表明原生质体瞬时转化系统可用于基因组编辑的研究。Hyden等[81]通过原生质体瞬时表达系统证明在两种ANGUSTIFOLIA特异性gRNA的靶区间观察到了基因大量缺失,说明使用CRISPR/Cas9可以在柳树中实现多重基因编辑。这是首次通过CRISPR/Cas9诱导突变将基因编辑技术应用于柳树。小麦原生质体中应用CRISPR/Cas9基因编辑系统[82],通过小麦原生质体RNA和Cas2蛋白的瞬时表达,实现了TaDREB2和TaERF3的靶向基因组编辑;通过限制性内切酶消化测定、T7核酸内切酶测定和测序证实了小麦原生质体诱变的有效性。此外,还分析了设计的sgRNA的几个脱靶区域,并通过扩增子测序证实了基因组编辑的特异性;结果表明,小麦原生质体上易于建立CRISPR/Cas9基因组编辑系统,并且它在小麦基因组的靶向操作中具有巨大的潜力,可以用于作物改良。
-
单细胞RNA测序是在单个细胞水平上进行测序,解决了用组织样本无法获得不同细胞间的异质性信息或样本量太少无法进行常规测序的难题。单细胞RNA测序开创了一个以细胞为基础的转录组分析的新时代,为研究细胞之间的转录异质性提供了重要的途径。建立一种简单而有效的原生质体制备方案,是应用单细胞RNA测序的前提。近年来,已在拟南芥根细胞[83]、花生(Arachis hypogaea L.)的叶片[84]、水稻的根细胞[85]中成功应用单细胞RNA测序。相对传统的RNA表达分析技术,单细胞RNA测序具有更高的灵敏度和更宽的动态范围,可以更准确地检测出在原细胞培养体系中不可以或很难被检测出的mRNA表达水平,甚至可以很好地结合RNA结构和功能信息,为不同类型的研究带来新的思路。Chen等[86]应用了优化的原生质体分离方案和单细胞RNA测序来绘制高度木质化的杨树茎单细胞转录组图谱,为研究树木中维管细胞的功能和进化开辟了新的途径。单细胞RNA测序是探索特定细胞发育和分化的工具。带有盾状腺毛(PGTs)的细叶荆芥叶片(PGTs可以分泌和储存生物活性精油)可以分离出33254个原生质体;通过单细胞RNA测序数据的综合分析,表明PGTs对细叶荆芥有特异性;研究结果为探索植物细胞发育和分化,特别是腺毛的起始和发育提供了基础和方向[87]。
-
原生质体广泛用于基因表达和调控,特别是亚细胞定位、蛋白质相互作用、蛋白质和DNA互作及基因编辑技术,尽管如此,在植物原生质体研究的许多方面仍有一些障碍需要解决。比如原生质体瞬时转化试验周期短,需要多次试验来增加试验的可靠性;植物原生质体表型不能维持太长时间;在利用原生质体瞬时转化培育新品种时,从原生质体细胞分化成愈伤组织花费的时间周期太长。随着原生质体分离方法和基因工程技术的不断完善,原生质体瞬时表达系统将以其独有的优势在植物分子生物学研究中得到更加广泛的应用。
Isolation of plant protoplast and its application in transient transformation
DOI: 10.15886/j.cnki.rdswxb.20230026
- Received Date: 2023-03-02
- Rev Recd Date: 2023-05-17
- Available Online: 2023-12-14
- Publish Date: 2024-03-25
-
Key words:
- protoplast /
- enzymatic hydrolysis /
- transient transformation
Abstract: The cell wall was removed from plant cells, and the cytoplasm wrapped by a single cell membrane is called protoplast. It has been widely used in protein subcellular localization, gene expression analysis, protein-protein interaction and gene editing among others. The factors influencing plant protoplasts isolation by enzymatic method, the effects of electroporation and PEG-mediated methods on the transient transformation efficiency of protoplasts and their application in transient transformation were summarized in this review. Plant species, different PEG concentrations, transfection time, DNA concentration, and number of protoplasts were found to affect the PEG-mediated transient transformation efficiency of protoplasts. The electroporation had an optimum transformation efficiency of protoplasts only under the adequate conditions of pulse voltage, pulse duration, pulse number, cell number, and DNA concentration. This review might provide reference for establishment of more plant protoplast isolation systems and transient transformation systems for plant protoplasts.
| Citation: | MA Chaoyue, PENG Shiqing, GUO Dong, ZHU Jiahong, WANG Ying. Isolation of plant protoplast and its application in transient transformation[J]. Journal of Tropical Biology, 2024, 15(2): 241-250. doi: 10.15886/j.cnki.rdswxb.20230026 |






 DownLoad:
DownLoad: