-
酚类是重要的次生代谢产物,广泛分布于水果、蔬菜与谷物种子里。龙爪藜豆(Mucuna Pruriens)在我国主要分布于广西、贵州等地区,仅广西的巴马瑶族自治县种植面积就已达1 333.3 hm2,其种子俗称猫豆,既是当地民众喜爱的食品,也是提取酚类化合物左旋多巴(L-DOPA,1,图1)的主要原料[1]。热带海洋生物沙堡虫(Phragmatopoma californica)分泌含L-DOPA的生物黏胶,用于在水中黏附砂石建造防御性堡垒[2]。L-DOPA是治疗帕金森病最重要的药物,被称作“黄金标准”[3],还被用于治疗肝昏迷。在科研上,L-DOPA被广泛用于生物黏胶[4]、表面涂层[5-6]、功能材料[7]和抗帕金森病前药等前沿领域[8-9]。L-DOPA侧链含有一个儿茶酚基团,容易发生氧化交联反应,因此在化学修饰L-DOPA的过程中,引入了多种儿茶酚保护方式,如缩醛/酮,烷氧羰基、硅醚、烷醚、羧酸酯和硼酸酯[10-13]。由于薄层色谱法(TLC)具有操作简单、检测用时短、价格低廉等优点,已成为目前应用最广的分析技术之一,为此还开发了大量适用于TLC的显色剂,例如碘蒸汽,茚三酮,溴酚蓝[14]。在水溶液中,酚类物质可以与FeCl3发生颜色反应,因条件不同可以显示多种多样的颜色,不利于分析判断酚类的结构与类型。2008年,Liu等[10]在制备缩丙酮保护的L-DOPA衍生物(7)时指出:在TLC 硅胶板上化合物7与FeCl3在室温下不显色而加热条件下显色,但该文章没有给出显色的原因与适用范围。本研究选择了30余种代表性的酚类化合物(图1),拟测试它们与FeCl3在硅胶板上的颜色反应,结合苯酚与儿茶酚在水溶液中的颜色反应与在可见光区域的吸收谱,阐明自由的与保护的酚类物质在TLC硅胶板上显色的化学机制,优化检测条件并推广可检测儿茶酚保护基的范围,旨在为多酚类天然产物及其衍生物提供一种准确、简捷与价廉的鉴别方法。
-
六水合三氯化铁、氯化亚铁、氯化铜、六水合三氯化铝、L-DOPA(1)、苯酚(2)、对苯二酚(3)、间苯二酚(4)、儿茶酚(5)、多巴胺、连苯三酚(6)、3,4-(亚甲二氧)肉桂酸(11)、水杨酸(17)、乙酰水杨酸(18)、丹皮酚(19)、麦芽酚(20)、桑黄素(21)、2-(3,4-二甲氧基苯基)乙胺(26)、3,4,5-三甲氧基苯甲酸甲酯(27)、1,2,4-苯三酚乙酸酯(28)、(Z)-3-己烯基-3-硼酸儿茶酚酯(32)与丁香酚(33)等化合物购自阿拉丁试剂(上海)有限公司或上海泰坦科技股份有限公司。缩酮保护的L-DOPA与多巴胺衍生物,叔丁氧羰基(Boc)、9-芴基甲氧基羰基(Fmoc)、三甲基硅烷基(TMS)与叔丁基二苯基硅烷基(TBDPS)保护的儿茶酚等衍生物为实验室根据文献合成[13, 15-16]。台式三用紫外线分析仪ZF-1,GF254型硅胶板购自青岛海洋化工有限公司。
-
配制120 mmol·L−1苯酚水溶液(记为X)、20 mmol·L−1 FeCl3水溶液(记为Y)和pH调节溶液:1 mmol·L−1与0.1 mmol·L−1 HCl溶液、0.1 mmol·L−1与0.01 mmol·L−1 NaOH溶液。配制待测液:取一支15 mL的离心管,准确加入2.5 mL溶液X与2.5 mL溶液Y;另取一定量pH调节溶液,以蒸馏水调体积到3.0 mL;二者相混合,得一系列pH不同,但苯酚与FeCl3浓度(37.5/6.25 mmol·L−1)不变的待测液。采用类似方法,配制了2个系列的pH不同,但儿茶酚与FeCl3浓度不变的待测液:0.75/0.25 mmol·L−1(记为1倍浓度)和1.5/0.50 mmol·L−1(记为2倍浓度)。不添加pH调节溶液,直接混合儿茶酚与FeCl3的水溶液,配制了1、2、4、6、8、10和20.8倍浓度的儿茶酚-FeCl3溶液。记录溶液颜色,然后,用分光光度计测量其在380~800 nm区域的吸收谱。
硅胶粉对显色反应的影响:取苯酚-FeCl3(37.5/6.25 mmol·L−1, pH 2.38, a)、儿茶酚-FeCl3(0.75/0.25 mmol·L−1,pH 4.85, b)与(0.75/0.25 mmol·L−1, pH 6.15, c)3种溶液和蒸馏水(对照),添加GF254硅胶粉(0.1 g·mL−1),涡旋5 min后离心,观察颜色并测量水相pH。
-
配制金属氯化物检测液:称取六水合三氯化铁(1.62 g,6 mmol·L−1 )溶于100 mL乙醇中,得60 mmol·L−1 FeCl3检测液;采用类似方法,分别制得FeCl2、CuCl2和AlCl3检测液,浓度均为60 mmol·L−1。
配制六浓度梯度酚类样品液:称取待测酚类化合物,溶于合适溶剂中,得样品液A(50 mmol·L−1);取0.50 mL样品液A,添加1.00 mL溶剂稀释,得样品液B(17 mmol·L−1);采用类似方法,制得浓度等比递减(公比1/3)的样品液C(5.6 mmol·L−1)、D(1.8 mmol·L−1)和E(0.62 mmol·L−1);以纯溶剂为对照液F(0 mmol·L−1)。
制备6浓度梯度样品点:采用模板在TLC GF254硅胶板上画6个大小一样的圆(直径3.9 mm,面积12 mm2),从左至右依次记为A至F。用毛细管(内径0.3 mm)移取0.7 µL样品液A(液柱高10 mm)点在A圆内,形成样品点A(单位面积载样量0.002 9 mol/m2);采用类似方法,吸取等量样品液B、C、D、E和对照液F,制得载样量等比递减的样品点B、C、D、E和对照点F。
TLC硅胶板上的显色方法:用喷瓶均匀喷FeCl3检测液到TLC板上,室温晾干,观察显色情况并拍照;如需烤板,将上述TLC板放入110 ℃烘箱中加热5 min。采用类似方法测试酚类物质与FeCl2、CuCl2和AlCl3的颜色反应。鉴别4种酚类化合物的方法:以50 mmol·L−1酚类样品液在TLC板上点样,在二氯甲烷(DCM)/甲醇(5%)混合液中展开,依次采用紫外光(254 nm)照、室温下喷FeCl3和110 ℃烤板5 min的方式进行检测。
-
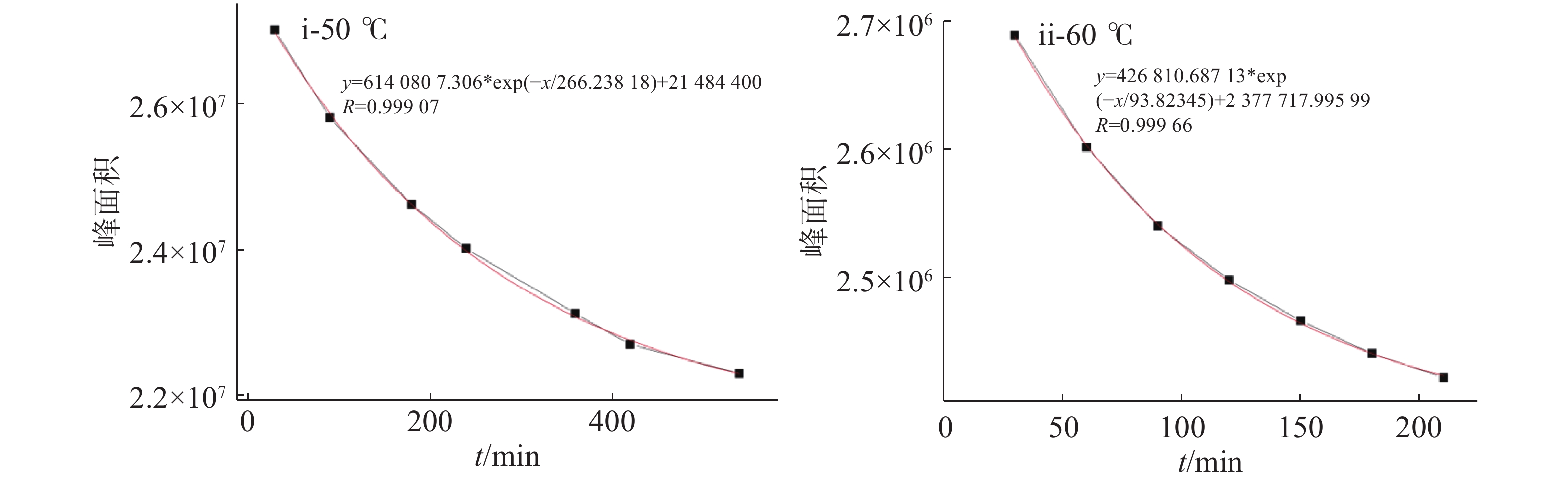
取50 mL单口烧瓶,加入六水合三氯化铁(0.16 g,0.60 mmol·L−1 )、9.50 mL无水乙醇与0.50 mL蒸馏水;在油浴中预热到设定温度(50、60或70 ℃)后,加入缩丙酮化合物10(0.20 g),搅拌并计时。每隔约20 min取1.00 mL混合溶液,快速冷却终止反应;旋蒸去除溶剂,加水与DCM各5.0 mL并振荡;取有机相3.0 mL,用无水Na2SO4干燥;取1.00 mL上层清液,去除溶剂后,加1.00 mL乙腈提取;采用HPLC分析化合物10的剩余量,以准一级降解动力学曲线对其峰面积进行拟合。
-
苯酚-FeCl3(37.5/6.25 mmol·L−1)水溶液在pH 1.78~2.41间显紫色(图2-i,表1-i);pH降低时,混合液颜色极淡;pH升高时,显棕色。儿茶酚与FeCl3的1倍浓度水溶液(图2-ii,表1-ii)在pH 4.00~5.53间显青色,在pH 6.15~ 8.99间显蓝黑色;2倍浓度水溶液在更低的pH即可显色(图2-iii,表1-iii),在pH 3.2时显青色,在pH 5.52显蓝黑色;在相同pH时,2倍浓度的颜色比1倍浓度的深很多。等比升高儿茶酚与FeCl3的浓度对混合液的pH与颜色有显著影响(图2-iv,表1-iv):浓度升高,混合液pH降低,颜色加深。添加硅胶粉严重影响酚类与FeCl3在水中的显色反应:测试的a、b、c 3种溶液的颜色都消失了;经测量上层清液的pH值向对照液的pH(5.9)偏移。
酚类 颜色与浓度和pH的关系 苯酚(i) pH 0.32 0.7 1.13 1.27 1.48 1.78 1.98 2.38 2.41 2.43 2.46~2.61 颜色 极淡紫 极淡紫 淡紫 淡紫 淡紫 紫色 紫色 深紫 棕色 棕色 棕色 儿茶酚(ii) pH 0.67 1.35 3.4 4.01 4.85 5.23 5.53 6.15 7.59 8.99 10.94~11.78 颜色 极淡紫 极淡紫 极淡青 青色 青色 青色 深青 深蓝 深蓝 深蓝 棕红 儿茶酚(iii) pH 0.66 3.2 3.91 4.9 5.22 5.52 5.89 6.1 6.92 7.3 9.25~10.38 颜色 极淡紫 青色 青色 青黑 青黑 蓝黑 蓝黑 蓝黑 蓝黑 蓝黑 深棕红 儿茶酚(iv) 浓度mmol·L−1 0.75 1.5 3.0 6.0 7.5 15.6 pH 颜色 3.40 极淡青 3.32 青色 3.04 青色 2.66 青黑 2.57 青黑 2.22 青黑 -
在pH 4.85时,儿茶酚与FeCl3的1倍浓度水溶液在434 nm与719 nm处有吸收峰,表明主产物为单儿茶酚配位络合物(mono-coordinated complex, MCC)(图3-i);当pH提高到6.15时,吸收谱在583 nm出现了新吸收峰,表明主产物为双儿茶酚配位络合物(bi-coordinated complex, BCC)。在相同pH下,2倍浓度溶液的吸光度比1倍浓度的大很多,如在pH 4.9,2倍浓度溶液在719 nm处的吸光度约是1倍浓度的3倍(图3-ii);当pH提高到10.38时,2倍浓度溶液的吸收谱在471 nm出现了新吸收峰,表明产生了三儿茶酚配位络合物(tri-coordinated complex, TCC)。
-
未保护的酚类物质与FeCl3在TLC硅胶板上的显色结果很不相同。苯酚、对苯二酚与间苯二酚的点样点均为无色,喷FeCl3检测液并晾干后,转为淡黄色,与背景色一致(图4-i);儿茶酚与连苯三酚样品点在喷FeCl3后立刻呈青黑色,室温下晾干转为蓝黑色。水杨酸17、丹皮酚19和麦芽酚20在TLC板上的点样点为无色(图4-ii),喷FeCl3后显紫红色(图4-iii);桑黄素21为黄色粉末,点样点也为黄色,在室温下喷FeCl3后转为棕黑色。
3种酚类化合物与FeCl3、FeCl2、CuCl2和AlCl3在TLC板上的显色结果:苯酚在110 ℃或室温与4种氯化物都不显色(图4-iv~图4-vii)。儿茶酚在室温与Fe2+显浅灰色,与Cu2+显棕黑色,与Al3+不显色。缩丙酮9在室温与4种金属氯化物都不显色,但在110 ℃烤板5 min后,显色结果不同:喷过FeCl3或FeCl2的,显蓝黑色;喷过CuCl2或AlCl3的,不显色;先喷AlCl3,接着烤板(110 ℃),再加喷FeCl3,样品点显蓝黑色(图4-vii,末尾TLC板)。
保护的儿茶酚衍生物与FeCl3的颜色反应可分成三类(图4-viii~图4-ix):(1)在室温不显色,在110℃烤板5 min后显蓝黑色,如缩丙酮保护的多巴胺与多巴衍生物10、13、14和16,Boc保护的多巴胺23;当检测分子量较大结构较复杂的儿茶酚衍生物时,如三肽15,显色反应变得困难,在110 ℃时显色很淡,升温至140 ℃,才显较深颜色;(2)在室温与在110 ℃烤板5 min的条件下都不显色,如亚甲基缩醛(缩甲醛)保护的儿茶酚11与12,Fmoc保护的儿茶酚22,TBDPS保护的多巴胺25,甲醚保护的多巴胺26与邻苯三酚27,乙酰基(Ac)保护的28,特戊酰基(Piv)保护的29和苯甲酰基(Bz)保护的30;(3)在室温晾板过程中逐渐显蓝黑色,如TMS保护的儿茶酚24,硼酸酯保护的儿茶酚31与32。单保护的丁香酚33和乙酰水杨酸18在室温下不显色,在110 ℃时仅高浓度样品点显色。
显色深浅与样品浓度的关系:儿茶酚在浓度为50 mmol·L−1时(A点)显色非常深;降至17 mmol·L−1时(B点),显色适中;降至5.6 mmol·L−1时(C点),颜色较淡;降至1.8 mmol·L−1时(D点),颜色极淡,难以观察;低至0.62 mmol·L−1时(E点),不显色。保护的儿茶酚显示的颜色比同浓度未保护的略浅,例如10和23,在5.6 mmol·L−1时(C点)显色非常淡,不方便观察。
酚类化合物2、5、10与25的简单区分实验结果(图4-x):紫外光照下,4种酚类物质都显黑色;喷FeCl3后,儿茶酚样品点呈蓝黑色而苯酚不显色;在110 ℃烤板5 min后,缩丙酮保护的儿茶酚10转为蓝黑色而TBDPS保护的儿茶酚25依旧不显色。
-
在室温,未观测到缩丙酮化合物10在稀FeCl3乙醇溶液(60 mmol·L−1)中发生分解;当温度升高到50 ℃时,检测到缩丙酮发生了显著分解。采用一级降解曲线拟合缩丙酮化合物10的剩余量(HPLC峰面积)与时间(min)的关系(R2 > 0.99)并经计算得到:在50、60和70 ℃,缩丙酮10的分解半衰期分别为266(图5-i)、93.8(图5-ii)和78.8 min;当分解温度接近乙醇沸点时,溶剂挥发严重,剩余缩丙酮10的测量值偏高,导致半衰期计算值偏大。
-
酚类与FeCl3在水溶液中的显色反应是一种可逆络合反应,受到酚类络合能力、浓度与溶液pH的影响。苯酚与FeCl3需在较高浓度(37.5 mmol·L−1)与较窄的pH范围才能显示清晰的紫色;儿茶酚在低浓度(0.75 mmol·L−1,苯酚的1/50)即能显示清晰的颜色,具体颜色与主要络合产物存在形式有关并受到pH与溶液浓度的影响:在低pH主要以MCC与BCC形式存在,显青黑色或蓝黑色;在高pH(>9)以TCC形式存在,显棕红色[17-20];同比增加儿茶酚与FeCl3浓度可以促进多配位络合物的生成。
-
GF254硅胶表面与孔隙中有大量的硅羟基与平衡离子,具有一定的pH(本实验采用的硅胶板5.9)缓冲能力;硅胶的硅羟基对Fe3+有络合作用,其生成常数LogK应接近于原硅酸的8.9(表2);随着溶剂的挥发,硅胶上加载的样品液被逐渐浓缩并被吸附到硅胶表面。实验发现,往苯酚或儿茶酚与FeCl3的水溶液中添加少量硅胶粉,溶液的颜色消失;这证明硅胶对酚类的显色反应有显著性影响。因此,与水溶液中的显色反应不同,酚类与FeCl3在TLC板上的颜色反应受到硅胶特殊理化性质的影响:一个弱酸性的pH缓冲环境、一个硅羟基参与的竞争络合环境和一个样品液被浓缩的吸附环境。
苯酚 氢氧根 原硅酸 儿茶酚 水杨酸 Fe3+ 7.8 11.8 34.4Te 8.9 20.2 34.7B 43.8T 16.3 28.5B 35.3T Fe2+ NA 4.5 10.0T NA 8 13.5B 6.6 11.2B Cu2+ NA 6.3 12.8B NA 13 24.9B 10.6 18.5B Al3+ NA 9 33Te NA 16.3 29.3B 37.6T 12.9 23.2B 29.8T 注:所有数据来自文献[21];上标B、T、Te分别代表二配位、三配位、四配位络合物。 苯酚对Fe3+的络合能力只有硅羟基的1/10(表2)并且苯酚点样液被限制在较低浓度,因此在大量硅羟基存在下,苯酚不能有效结合Fe3+并形成紫色的六配位络合物;另外,苯酚载样量很少,不足以改变硅胶板的低pH大环境,因此苯酚与FeCl3在TLC板上不显色。其他只含孤立酚羟基的化合物,如对苯二酚和邻苯二酚它们对Fe3+的络合能力与苯酚相似,在TLC板上也不显色。
儿茶酚对Fe3+的络合能力是硅羟基的一千亿倍(表2),远高于大多数配体[22],因此儿茶酚不受硅羟基竞争络合的影响。喷FeCl3后,儿茶酚样品点显青黑色,表明主要络合产物为MCC;晾干后,转为蓝黑色,表明生成了较多的BCC。三配位络合物TCC颜色偏棕红,其形成所需的pH与配体浓度都很高。因此,儿茶酚显示的颜色主要来源于MCC和BC而与TCC无关。同样原因,其他络合能力强的螯合型配体,如邻苯三酚6和水杨酸17(表2),也能与FeCl3在硅胶板上发生显色反应。在测试的4种金属离子中,Fe3+与儿茶酚的络合能力最强,受硅羟基的干扰最小;生成的络合物呈现特征性蓝黑色,方便判断;FeCl3是一种较强的路易斯酸,可以选择性分解对酸不稳定的保护基;因此,FeCl3成为在TLC硅胶板上通过颜色反应来区分儿茶酚保护基类型的最佳试剂。
-
保护的儿茶酚类化合物由于不能与Fe3+形成络合物,因此在硅胶板上不与FeCl3发生颜色反应。以缩丙酮保护的多巴胺10和Boc保护的多巴胺23为例,二者的样品点从A到E在室温下喷FeCl3检测液后都不显色。在110℃烤板5 min后,样品10与23的A与B点显示清晰的蓝黑色,与儿茶酚在晾干的硅胶板上显示的颜色一致,只是略淡,暗示样品10与23的A与B点可能含有BCC型络合产物。
缩丙酮10在FeCl3乙醇溶液中的分解实验揭示了上述显色反应的化学机制。在室温,缩丙酮基本不被稀FeCl3溶液分解,而保护状态的儿茶酚不能与Fe3+形成有颜色的络合物,因此样品点不显色;随着温度升高,缩丙酮分解加快,在60℃时半衰期只有93.8 min,在110 ℃时,其分解半衰期应更短;烤板5 min后,样品点内应已生成大量脱保护的儿茶酚基,后者与Fe3+络合形成了BCC型产物,所以显蓝黑色。由于总有部分缩丙酮未被分解,因此缩丙酮样品点的颜色,比同浓度的儿茶酚样品点的颜色,略淡一些。酚类浓度梯度与显色深浅的关系表明:儿茶酚在50 mmol·L−1时显色已很深,继续增加浓度会引起样品过载或改变硅胶限定的反应条件;另外,虽然儿茶酚在5.6 mmol·L−1时的显色可辨,但保护的儿茶酚在该浓度显色较淡,而在17 mmol·L−1时显色明显;综合考虑,最佳酚类检测浓度范围介于10至50 mmol·L−1。
缩甲醛、Fmoc、TBDPS、甲基(醚)、Piv或Bz等对强酸稳定的保护基,在室温和110 ℃烤板5 min条件下,不被FeCl3分解或分解极少,因此这些保护基保护的儿茶酚衍生物在TLC硅胶板上不显色。TMS和硼酸酯等对酸非常敏感的保护基,在室温即可被稀FeCl3溶液脱保护,引起自由儿茶酚基的含量逐渐升高,因此不需要烤板,在TLC板晾干过程中即渐渐呈现蓝黑色。另外,只有一个酚羟基被保护的儿茶酚,如丁香酚33,邻位自由羟基可以促进FeCl3对单保护基的分解,导致单保护酚类化合物的稳定性比全保护的差;在烤板条件下,丁香酚高浓度样品点可以产生足够多的自由儿茶酚基,从而与Fe3+络合并显色。对乙酰水杨酸18,由于邻位活泼羧基的影响,也具有类似丁香酚的显色现象。
综上所述,TLC硅胶板提供了一个与水相不同的特殊反应环境,由于儿茶酚等螯合型配体对Fe3+的络合能力远大于硅羟基与单酚羟基的,因此在硅胶板上苯酚等含孤立酚羟基的化合物不能与FeCl3 发生颜色反应,而儿茶酚等络合能力强的化合物则可以;儿茶酚与FeCl3显示的颜色来自一配位和二配位络合物,与三配位络合物无关。保护的儿茶酚不能直接与FeCl3络合而在硅胶板上显色,但是对酸不稳定型保护基保护的儿茶酚,因FeCl3检测液同时具有选择性脱保护的特性,在室温或烤板条件下,也能发生颜色反应;对强酸稳定型保护基保护的儿茶酚,两种条件下都不显色。本研究开发的在TLC硅胶板上的颜色反应能够快速、准确地检测出保护的与未保护的儿茶酚类物质,可用于监控儿茶酚类化合物的反应进程,特别是L-DOPA的衍生物,促进多酚类天然产物、抗帕金森病前药与功能材料等研究领域的发展。
Identification of catechols and their protecting groups usin gcolor reactions
DOI: 10.15886/j.cnki.rdswxb.20220091
- Received Date: 2022-10-28
- Accepted Date: 2023-04-01
- Rev Recd Date: 2023-03-28
- Available Online: 2023-12-07
- Publish Date: 2024-03-25
-
Key words:
- catechol /
- protecting group /
- ferric chloride /
- silica-gel plate /
- color reaction
Abstract: To explore a simple analytical method for identifying catechols and the types of their protecting groups, the colors of phenol and catechol with FeCl3 in aqueous solutions and their visible absorption spectra were compared, and over thirty phenolic substances were tested for color developments with FeCl3 on TLC silica-gel plates. Color-developing effectiveness between phenols and four metal chlorides were evaluated to establish a correlation between catechol concentrations and shades of spot colors. The kinetics of acetonide decomposition in dilute FeCl3 ethanol solution were analyzed. The experiments demonstrated that phenols with weak binding abilities did not develop colors with FeCl3 on TLC silica-gel plates while phenols with strong chelating abilities such as catechol did. The greenish/bluish black color on the spots of catechol samples arose from the mono- and bi-coordinated Fe(Ⅲ) complexes, not from the tri-coordinated ones. Since FeCl3 is a strong Lewis acid and can selectively cleave phenol protections, catechols protected by various types of protecting groups showed different color changes. Catechols protected by weak-acid labile protecting groups exhibited slow color development at room temperature; those protected by strong-acid labile protecting groups displayed no color at room temperature but bluish-black after heated on the silica-gel plate at 110℃ for 5 min; those protected by strong-acid stable protecting groups showed no color change under both conditions. The results also indicated that FeCl3 was the best color-developing agent among the four metal chlorides in testing phenols, with the optimum concentration of the phenols ranging from 10 to 50 mmol·L−1.
| Citation: | MENG Mingmin, XU Pengshu, LI Ruwen, HU Bihuang, LIU Zhongqiang. Identification of catechols and their protecting groups usin gcolor reactions[J]. Journal of Tropical Biology, 2024, 15(2): 232-240. doi: 10.15886/j.cnki.rdswxb.20220091 |












 DownLoad:
DownLoad: