-
外体(exosomes)是由细胞产生的直径在30~100 nm的小囊泡状结构[1]。外体表面和内部可以携带多种物质,在细胞与细胞间以及各种蛋白质、脂类和核酸的细胞间扮演运输工的角色[2]。目前,普遍用于标记外体结构的蛋白标记物包括CD63、CD81 和 TSG101等[2-3]。几乎所有的细胞均可分泌外体并且广泛存在于各类体液中[4],随体循环在体内流动作用于邻近的或者远距离的受体细胞。研究发现包括活化的B淋巴细胞、树突状细胞以及巨噬细胞在内的抗原呈递细胞所分泌的外体都具有活化和调节免疫应答的功能[5]。这些抗原呈递细胞分泌的外体携带 MHC-I、MHC-II 和CD86 等诱导性共刺激分子(ICOS),并具有激活T细胞增殖的能力[6]。据此,有望利用抗原呈递细胞分泌的外体作为多肽抗原的天然载体,制备成外体疫苗,激活机体产生针对该多肽的特异性免疫反应。
疫苗接种是预防与控制家禽疫病的重要手段。禽冠状病毒—鸡传染性支气管炎病毒(Infectious bronchins virus, IBV) ,是全球鸡呼吸道疾病的主要病原体之一,给养鸡业带来严重的经济损失[7-9]。由于IBV血清型复杂多样、抗体交叉保护力低,所以弱毒疫苗的使用无法有效控制感染并加剧病毒变异[10-11]。在防控此类传染性疾病时,动物群体免疫亚单位疫苗等非复制性、无致病力的疫苗能够在一定程度上提高疫苗接种的安全性[12],但是亚单位疫苗免疫原性差,难以激活细胞免疫,因此不适用于初次免疫,其免疫效果还受免疫佐剂、免疫次数的明显影响[13]。如果利用抗原呈递细胞源外体激活细胞免疫的优势,在鸡APC细胞的外体中装载IBV病毒亚单位抗原,则可能有效提高多肽抗原的免疫原性。有研究报道了LPS刺激鸡巨噬细胞系HD11细胞分泌的外体可作为佐剂增强细胞免疫反应[14]。此外,由于树突状细胞难以在体外稳定传代,而鸡巨噬细胞已有可稳定传代的细胞系,并且B淋巴细胞的体外活化复杂于巨噬细胞。利用巨噬细胞的永生化细胞系开展外体疫苗的研发可能具有更好的应用性。
基于上述背景,本研究以鸡巨噬细胞系HD11源外体作为研究对象,以IBV病毒中可诱导机体产生中和抗体的S1蛋白为模式抗原,构建装载抗原的重组外体,并进一步对外体中S1蛋白的表达进行鉴定,以明确是否成功构建装载抗原的重组外体。携带抗原的重组HD11源外体将作为重要的生物学材料,用于后续巨噬细胞源外体载体疫苗研发以及相应免疫应答机制的研究。
-
慢病毒包装组分Lenti-Mix购于厦门生命互联科技有限公司。慢病毒表达载体pCDH-CMV-MCS-EF1- copGFP-T2A-puro购于厦门生命互联科技有限公司。HEK293T细胞和鸡源巨噬细胞HD11细胞系购于上海冠导生物工程有限公司。25 cm2悬浮细胞培养瓶购于NEST。DMEM/HIGH GLUCOSE培养基购于HyClone。Tissue RNA提取试剂盒购于天根生化科技有限公司。胎牛血清(FBS)购于Gibco®。Exosome-depleted FBS购于SBI。MEM Nonessential Amino Acid Solution购于北京索莱宝(Solarbio)科技有限公司。青霉素-链霉素 (10 000 U·mL−1)购于Solarbio。0.45 μmol·L−1滤器购于biosharp。Centrifuge Tubes购于Beckman Coulter。增强型RIPA裂解液购于博士德生物。SDS loading buffer购于Biotopped。SDS-聚丙烯酰胺凝胶电泳试剂盒、聚偏二氟乙烯(PVDF)膜、脱脂奶粉、IBV标准阳性血清购于IDEXX。Tubulin抗体购于博士德生物。Rabbit monoclonal to CD63(Abcam)、Rabbit monoclonal to TSG101购于Abcam。Western Antibody Dilution Buffer购于Cwbio IT Group。辣根酶标记山羊抗小鼠IgG购于鼎国生物技术有限公司。辣根酶标记山羊抗兔IgG购于鼎国生物技术有限公司。辣根酶标记山羊抗鸡IgG购于鼎国生物技术有限公司。ECL发光试剂购于博士德生物。
-
超净工作台(SW-CJ-2D)购于苏州净化。高速离心机(Centrifuge 5418 R)购于艾本德中国有限公司。电泳仪(DYY-6C)购于北京六一生物科技有限公司。凝胶成像仪(ChampChemi 500 Plus)购于浙江柏奥生物科技有限公司。荧光定量PCR仪(Q2000B)购于杭州朗基科学仪器有限公司。超速离心机(Optima L-100XP)购于Beckman Coulter。纳米流式分析(Flow NanoAnalyzer)购于厦门福流公司。纳米颗粒浓度分析(S/N 17-310)购于ZetaVIEW。
-
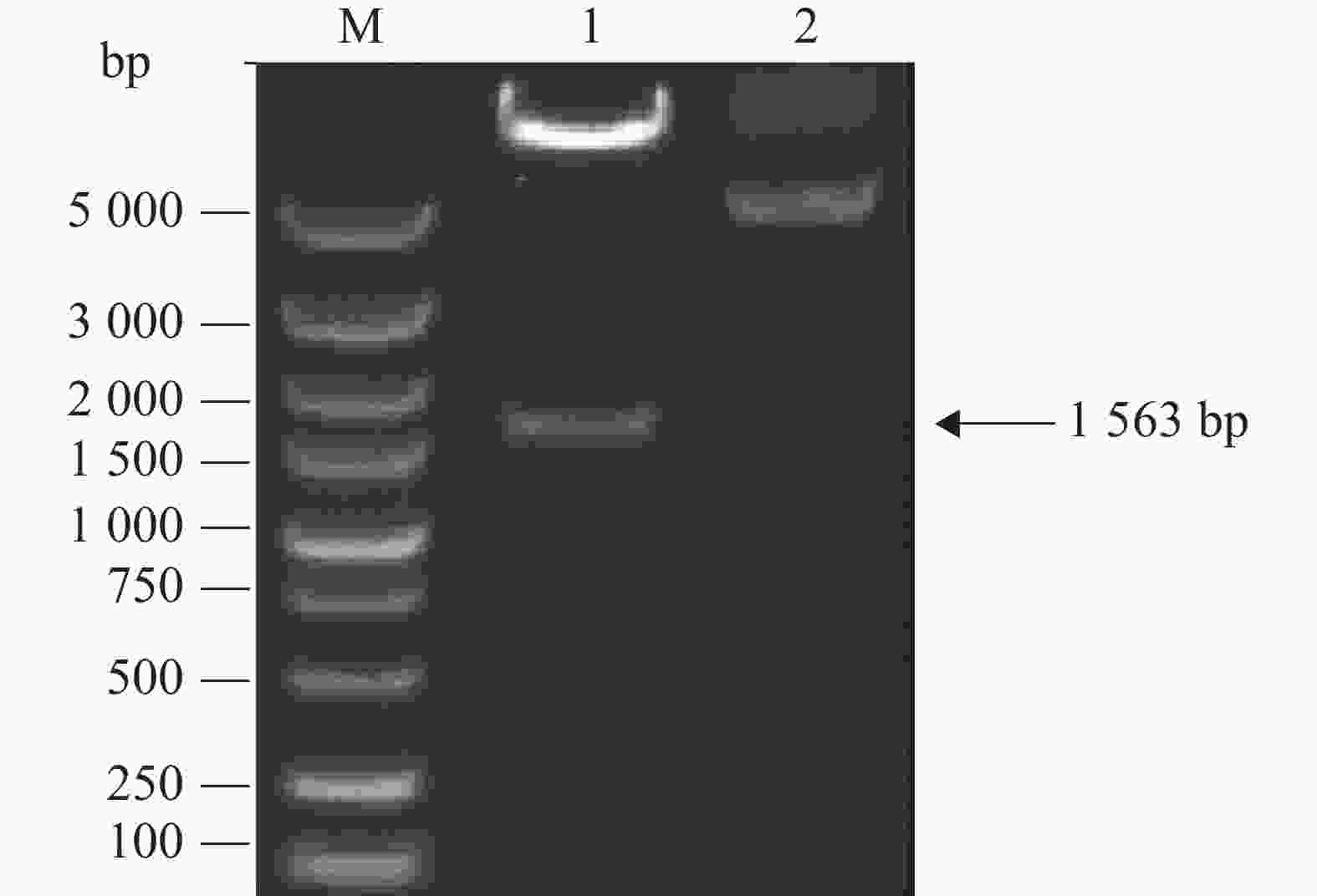
根据NCBI数据库中IBV M41 S1基因序列(Genebank ID:AY561711)全基因合成不含信号肽(N端1~19位氨基酸)的S1基因,根据慢病毒表达载体pCDH-CMV-MCS-EF1-copGFP-T2A-puro中多克隆位点选择限制性酶切位点XbaІ和BamHІ,同时插入起始密码子和终止密码子,设计上游引物5′-TCTAGA(XbaІ)GCCACCATGTTGTATGACAGTAGTTCTT-3 ′和下游引物5′-GGATCC(BamHІ)TTATGTTCCATTAGTGATT-3′,以合成的S1基因为模板进行PCR反应,扩增产物全长为1 563 bp。全基因与引物合成于生工生物工程(上海)有限公司。
-
将目的基因S1通过限制性酶切位点构建到具有非组成型表达绿色荧光标签蛋白的慢病毒表达载体pCDH-CMV-MCS-EF1-copGFP-T2A-puro中,得到表达S1基因的慢病毒表达载体 pCDH-CMV-S1-MCS-EF1-copGFP-T2A-puro。将重组慢病毒表达载体进行双酶切鉴定,并将阳性克隆送至生工生物工程(上海)有限公司进行测序分析。
-
将重组质粒pCDH-CMV-S1-EF1-copGFP-T2A-Puro和空载质粒pCDH-CMV-EF1-copGFP-T2A-Puro分别与Lenti-Mix混匀后配制成Lenti-Mix-DNA转染体系,转染HEK293T细胞,包装重组慢病毒Lenti-S1和空载慢病毒Lenti。包装72 h后收集慢病毒上清,经过离心去除细胞,并用0.45 µmol·L−1孔径过滤器过滤细胞碎片后,添加5 mL慢病毒浓缩液,混匀后4 ℃过夜处理,再经过低温高速离心浓缩慢病毒颗粒,最后用1 mL DMEM重悬慢病毒颗粒得到病毒液。用梯度稀释法(10−1到10−5)稀释病毒液,感染HEK293T细胞72 h 后,在倒置荧光显微镜下观察并计数绿色荧光细胞数。病毒滴度 ( TU·mL−1) =绿色荧光细胞数量×病毒液稀释倍数/病毒液体积。
-
将1.5中得到的病毒液(已计算好病毒滴度)感染HD11细胞,48 h后提取细胞总RNA进行qPCR检测S1基因的RNA表达水平。为了实现IBV S1蛋白在HD11细胞中的稳定表达用于后期大量提取重组外体,本研究使用慢病毒表达系统相应的筛选标记为GFP和嘌呤霉素抗性,以此可筛选出可稳定表达外源基因的重组细胞HD11-S1。用本研究构建的重组慢病毒Lenti-S1感染HD11细胞。感染48 h后进行完全换液,向培养基中添加嘌呤霉素(2.5 μg·mL−1),间隔2 d换液,实时观察绿色荧光蛋白GFP的表达情况,直到所有细胞均为GFP阳性细胞,筛选停止,即获得稳定表达细胞系。
-
将稳定表达细胞系进行扩大培养,待细胞密度至 70%~80%后,把培养基换成含2% 无外体胎牛血清DMEM/HIGH GLUCOSE培养基进行培养,作用24 h后收集细胞培养上清。通过差速离心方式进行外体的提取。具体步骤:(1)将上清于4 ℃、3 000 r·min−1离心30 min后将上清液移至新的离心管中,于12 000 r·min−1、4 ℃条件下,离心45 min以去除较大的囊泡;(2)经0.45 μm滤膜过滤,收集过滤液得到的上清液;(3)将上清于4 ℃,120 000 r·min−1条件下离心70 min,得到外体沉淀[15];(4)弃去上清,用10 mL预冷的1×PBS重悬后再次在4℃,120 000 r·min−1条件下,超速离心70 min,得到外体。将外体用150 μL预冷的1×PBS重悬,取20 μL以便后续电镜与粒径分析,剩余外体于−80 ℃保存。
-
将1.3.5得到的外体取出10 μL滴加于铜网上沉淀1 min后用滤纸吸去浮液。磷钨酸10 μL滴加于铜网上沉淀1 min后用滤纸吸去浮液。常温干燥5分钟后100 kv进行电镜检测成像,获得透射电镜成像结果。
-
取10 μL外体样本于25 ℃水浴解冻,用10 μLPBS进行稀释(v∶v=1∶1),直接用于粒径大小检测和纳米颗粒浓度分析,剩余外体于−80 ℃下保存。
-
通过Western Blot鉴定获得重组外体中的S1蛋白以及外体标志蛋白的表达。将离心收集的外体(或微囊泡体)沉淀用RIPA裂解液(含蛋白酶抑制剂与磷酸酶抑制剂)作用后,向样品中加入5×SDS loading buffer上样缓冲液,100 ℃条件下热变性10 min使蛋白充分变性。蛋白变性后,将其加到10%的聚丙烯酰胺凝胶中进行电泳分离。将聚丙烯酰胺凝胶转移(400 mA,1 h)到聚偏二氟乙烯(PVDF)膜,用5%脱脂奶粉(TBST稀释)室温封闭1 h或4 ℃过夜孵育。然后将膜与兔IgG初级抗体(抗体稀释液稀释)室温孵育1 h或4 ℃过夜孵育,用于CD63和TSG101鉴定,洗脱一抗后进行对应二抗IgG(5%脱脂奶粉TBST稀释)室温孵育30 min,洗脱后用ECL发光试剂对条带进行化学发光检测。
-
利用全基因合成技术,将S1基因克隆到具有非组成型表达绿色荧光标签蛋白的慢病毒表达载体pCDH-CMV-MCS-EF1-copGFP-T2A-puro中,获得重组表达载体pCDH-CMV-S1-MCS-EF1-copGFP-T2A-puro。通过双酶切鉴定(图1)可见特异性目的条带,片段大小与预期相符,且测序结果正确,即用于重组慢病毒包装的表达载体构建成功。
-
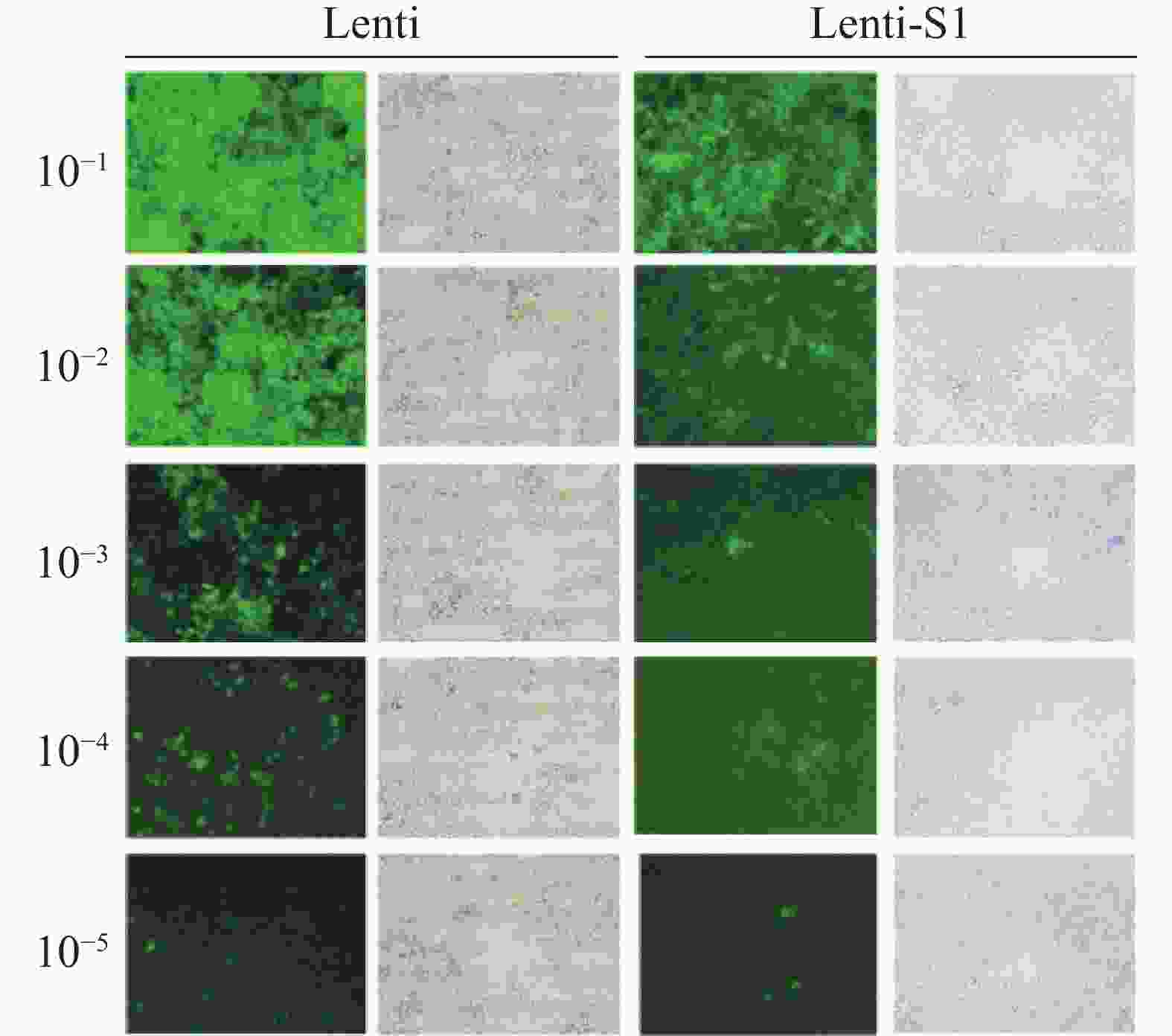
将重组慢病毒Lenti-S1和空载体慢病毒Lenti分别感染HEK293T细胞72 h后,在40倍目镜视野下的观察结果(图2) 显示细胞表面、间隙均无细菌颗粒或丝状异物,无任何细菌、真菌污染现象。测定Lenti-S1病毒滴度为3×108 (TU·mL−1),空载体病毒滴度为5×108 (TU·mL−1)。
-
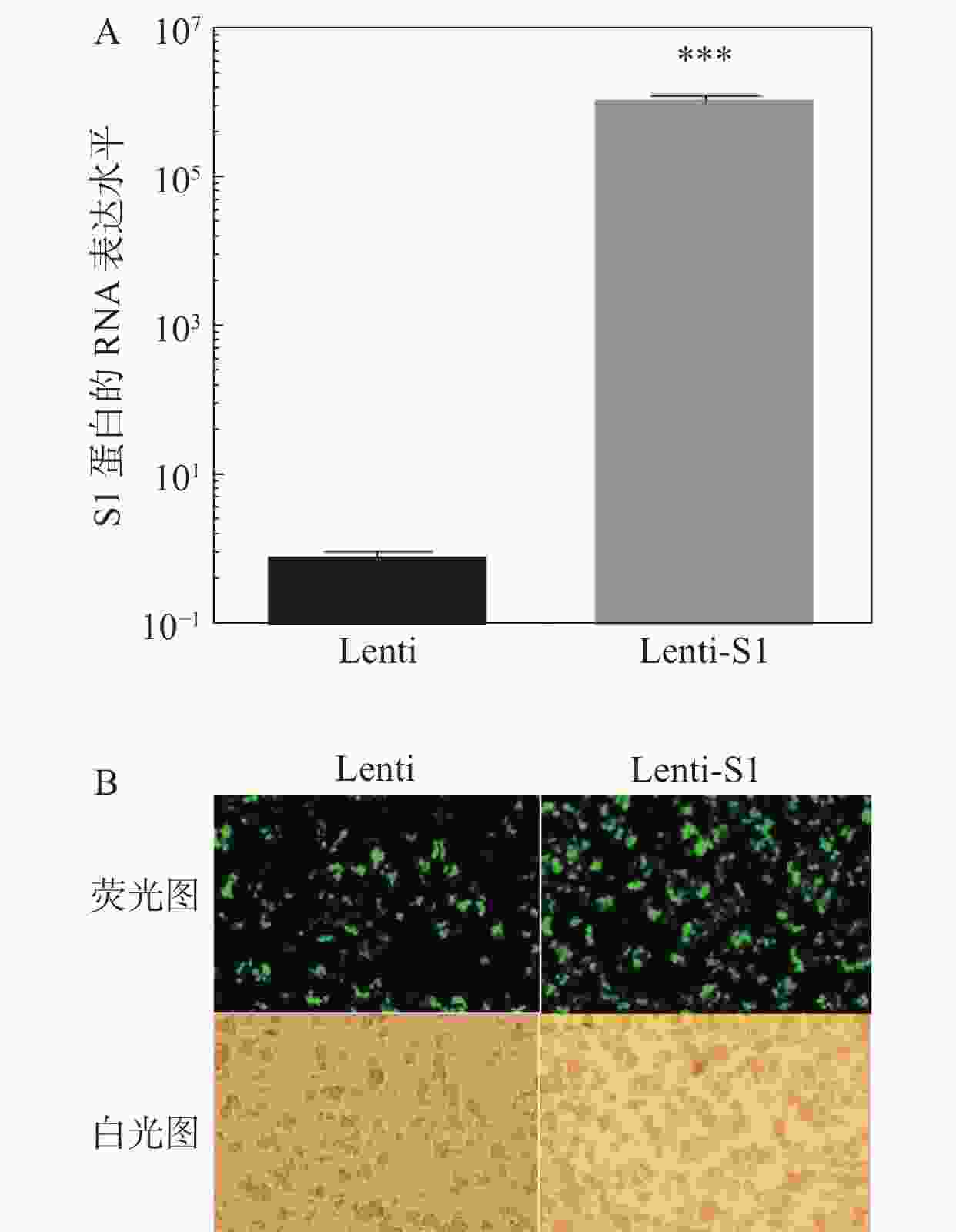
将慢病毒Lenti、Lenti-S1以5×109 TU·mL−1滴度分别感染HD11细胞,12 h后换液。感染48 h后,提取细胞总RNA进行qPCR检测S1基因的RNA表达水平(图3)。如图3-A所示在重组慢病毒Lenti-S1的HD11细胞中可检测到S1基因的表达。由于慢病毒载体表达非融合型的EGFP荧光蛋白和嘌呤霉素抗性基因,因此可通过流式细胞术筛选表达绿色荧光蛋白的阳性细胞或利用嘌呤霉素加压筛选出被慢病毒改造的重组HD11细胞系。应用抗生素嘌呤霉素(2.5 μg·mL−1)加压筛选后,采用荧光显微镜观察EGFP荧光蛋白表达。如图3-B所示,细胞均发出绿色荧光,即获得经慢病毒改造后的稳定细胞系。笔者将表达S1蛋白的HD11细胞系命名为HD11-S1。
-
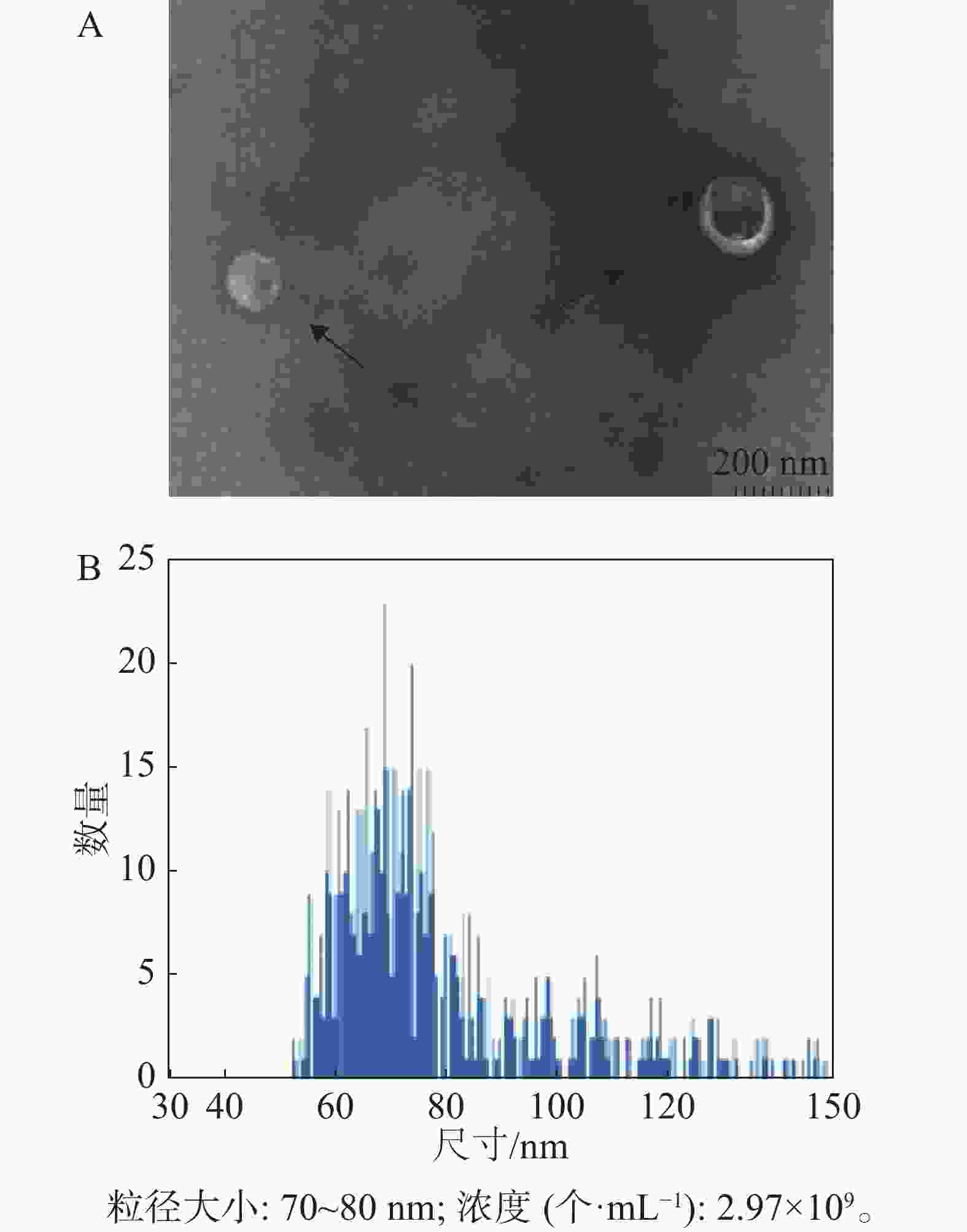
经过嘌呤霉素筛选后的稳定重组细胞系HD11-S1扩大培养,使用超速离心分离方法分离HD11细胞外体。如图4所示,其形态符合外体在透射电镜中的结构特点,即一侧凹陷的半球型;测定外体的粒径范围为70~80 nm,符合外体粒径的30~150 nm范围。
-
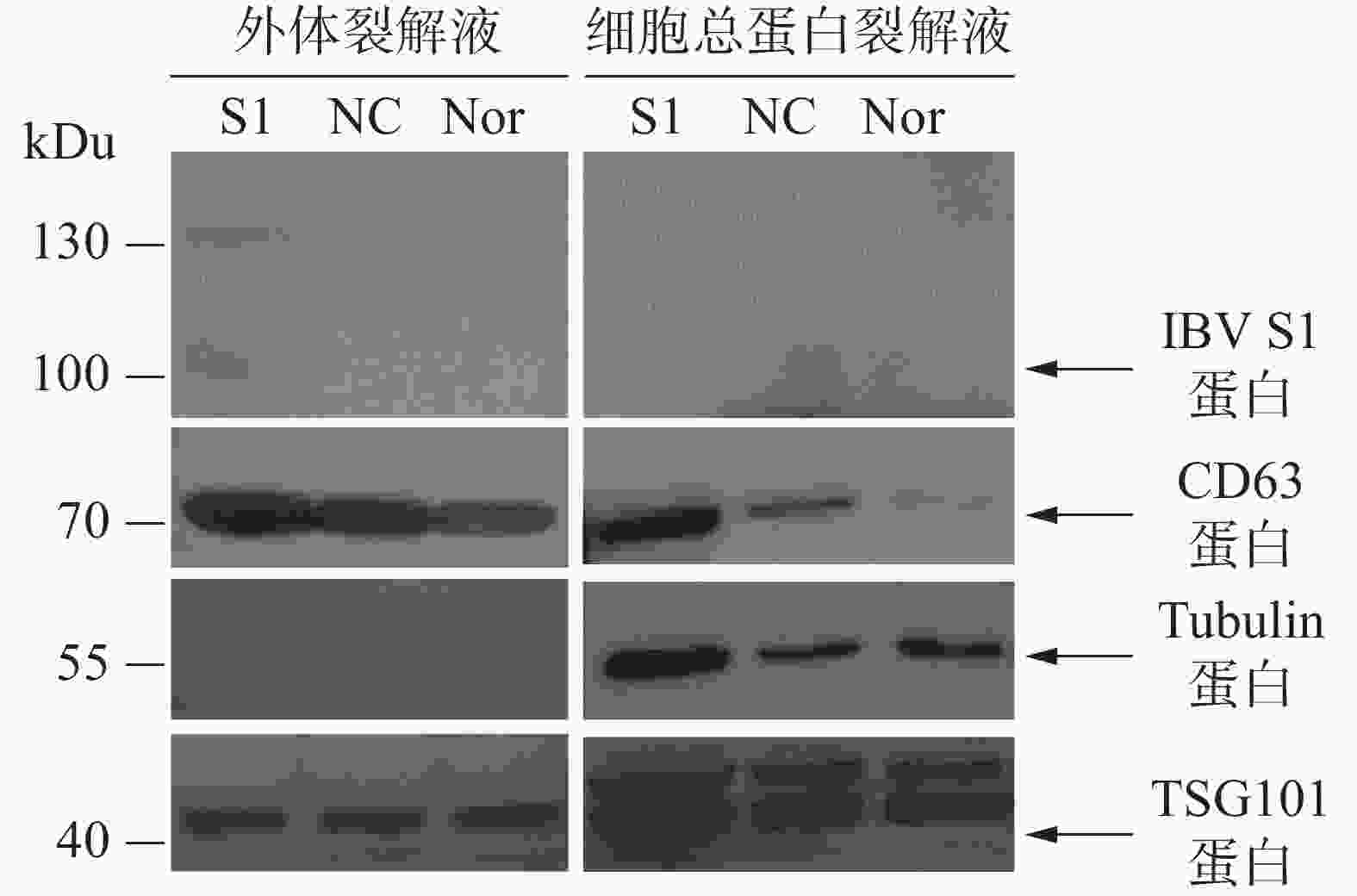
通过Western blot进行外体蛋白标志物检测。从图5可知,所制备的外体样本中CD63、TSG101呈高表达且未检测到Tubulin蛋白,符合外体的蛋白标志物分布特点。通过IBV标准阳性血清检测细胞或外体中载入抗原S1蛋白的结果表明,HD11-S1细胞与HD11正常细胞(Nor)以及感染慢病毒空载体HD11细胞(NC)的细胞总蛋白裂解液中均未能直接检测到抗原S1蛋白的表达,但在HD11-S1细胞分泌的外体有S1蛋白的表达。S1蛋白分子量大小约60 kDu,由于S1蛋白存在糖基化修饰位点,糖基化S1蛋白大小预测值为98 kDu,与检测到的主带大小一致。此外,由于一抗使用的是IBV阳性血清,属于多克隆抗体,因此可检测到130 kDu的蛋白可能是S1蛋白的多聚物或者糖基化程度更高的结构。
-
抗原呈递细胞(APC)源外体的膜组分中包括了主要组织相容性复合体(MHC-I和 MHC-II)、诱导性共刺激分子 B7 等。因此,当 APC 经抗原致敏后,其分泌的外体同样携带了抗原肽-MHC 复合体,可直接供给相应的 CD4+T 和 CD8+ T 淋巴细胞识别。并且,这些外体可被巨噬细胞、树突状细胞等 APC 本身摄取而发生交叉抗原呈递[16]。目前,有多种方法可制备装载抗原的APC源外体。例如,从病原感染动物的骨髓、外周血或脾脏分离APC进行体外培养,从培养液中分离与纯化外体;也可从动物体内分离APC后在体外培养的条件下,用病原感染或抗原致敏细胞再从培养液中分离得到外体。
为了探究装载病毒蛋白的外体功能,需要分离纯化得到无病毒颗粒残留的外体。由于病毒的粒径大小范围与外体接近,因此采用上述2种方法均需通过免疫磁珠法分离外体去除残留的病毒。然而免疫磁珠法分离提取外体产量低且成本高昂,但缺少适用于家禽细胞外体提取的商品化免疫磁珠方法。有数据证实在病毒感染细胞分泌的外体中能检测到病毒蛋白或病毒粒子。例如,禽白血病病毒ALV-J亚型感染的细胞分泌的外体中可检测到病毒gag和env蛋白[17],从而促进病毒介导的免疫抑制,或者在禽网状内皮增生病毒感染的精子分泌的外体中也可检测到病毒蛋白的存在[18];在新型冠状病毒感染的宿主体液循环中的外体中也可检测到SARS-CoV-2的S蛋白表达[19],而IBV与SARS同属冠状病毒科,病毒组成与结构相似。据此笔者推测,在细胞中表达的IBV病毒S蛋白也可被装载入外体中。本研究选择采用慢病毒过表达系统以达到在抗原呈递细胞系HD11中表达IBV病毒S1蛋白的目的,由于慢病毒包装系统所产生的假病毒属于复制缺陷型病毒,重组慢病毒仅保留感染细胞以及在细胞中表达携带外源基因的能力,但不会在宿主细胞中复制,所以,采用该方法可避免在外体提取过程中混入病毒,同时满足模拟病毒感染抗原呈递细胞以及实现病毒蛋白在细胞中的表达。
巨噬细胞通过吞噬作用清除其环境中的病原体,在先天性和适应性免疫反应中发挥重要的功能,而巨噬细胞中的蛋白酶体是巨噬细胞完成内源性抗原呈递和调控下游免疫应答和炎症反应的重要部分[20]。在本研究构建的重组HD11细胞中检测到了mRNA的表达,但用IBV阳性血清进行蛋白免疫分析时未检测到S1蛋白水平的表达。笔者认为可能在细胞中表达的S1蛋白被免疫蛋白酶体识别而被剪切成短肽,因此在Western Blot中无法检测到目的蛋白大小的条带。由此推测在外体形成的过程中,可以保护载入外体的病毒蛋白,免受巨噬细胞蛋白酶体通路的降解。这可能是病毒蛋白逃逸免疫识别的一种方式,值得进一步研究。
本研究利用透射电镜观察到的形态符合外体在透射电镜中的结构特点(图4-A)。同时,用纳米流式检测技术测定外体的粒径范围为70~80 nm,符合外体粒径的30~150 nm范围(图4-B)。用蛋白免疫印迹方法,从重组外体纯化产物中可检测到病毒蛋白S1以及外体标志蛋白CD63,TSG101的表达,同时并未检测到细胞骨架蛋白Tubulin的表达,从而排除细胞组分残留的影响。此外,在重组外体中检测到S1蛋白分子量大小在100 kDu左右(图5),大于预测分子量56 kDu。这是由于S1蛋白中有17个糖基化位点(Asn-X-Ser/Thr,X可为脯氨酸的任一氨基酸),经完全糖基化后的分子量为98 kDu[21]。而根据已有报道,通过原核或者真核表达载体所表达的重组IBV S1蛋白的分子量均小于98 kDu[22-24]。综上所述,本研究成功纯化到携带IBV S1抗原的HD11源外体,并且该外体中表达的S1抗原具有高度糖基化修饰,与病毒感染过程中S1蛋白的天然构象接近。本研究结果可为今后应用鸡源巨噬细胞分泌的外体作为抗原载体的相关禽病疫苗研发提供重要的参考数据。
Construction of exosomes of recombinant HD 11 cells harboring the IBV S1 protein
-
摘要: 为了给禽类巨噬细胞源外体在免疫应答的功能研究和家禽外体载体疫苗的研发奠定基础,本研究以鸡传染性支气管炎病毒(Infectious bronchins virus, IBV)S1蛋白作为模式抗原,通过慢病毒表达系统技术实现在HD11细胞中稳定表达S1蛋白,再利用超速离心从细胞培养物上清中分离纯化得到外体。蛋白免疫印分析、电镜与粒径分析检测等结果表明,在该重组HD11细胞分泌的外体中可检测到稳定的S1蛋白表达,显示成功构建了装载IBV S1蛋白的重组外体。Abstract: The exosomes of antigen presenting cells (Antigen presenting cell, APC) participate in the immune response process, and can activate the adaptive immune response after carrying the antigen. As a kind of antigen-presenting cells, the related functions of poultry macrophage-derived exosomes are still unknown. The S1 protein of chicken infectious bronchitis virus (IBV) was used as the model antigen, the S1 protein was stably expressed in HD11 cells through the lentiviral expression system, and then the exosomes were separated and purified from the cell culture supernatant by ultracentrifugation. The protein immunoblot analysis, electron microscopy and particle size analysis detection showed that stable S1 protein expression can be detected in the exosomes secreted by the recombinant HD11 cells. Recombinant exosomes harboring IBV S1 protein were successfully constructed, which can provide a reference for the functional study of avian macrophage-derived exosomes in immune response and the development of poultry exosome vector vaccines.
-
Key words:
- exosome /
- HD11 cell /
- IBV /
- S1 protein
-
-
[1] ZABOROWSKI M P, BALAJ L, BREAKEFIELD X O, et al. Extracellular vesicles: composition, biological relevance, and methods of study [J]. Bioscience, 2015, 65(8): 783 − 797. doi: 10.1093/biosci/biv084 [2] RAPOSO G, STOORVOGEL W. Extracellular vesicles: exosomes, microvesicles, and friends [J]. The Journal of Cell Biology, 2013, 200(4): 373 − 83. doi: 10.1083/jcb.201211138 [3] COLOMBO M, RAPOSO G, THÉRY C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles [J]. Annual Review of Cell and Developmental Biology, 2014, 30: 255 − 89. doi: 10.1146/annurev-cellbio-101512-122326 [4] BORGES FT, REIS LA, SCHOR N. Extracellular vesicles: structure, function, and potential clinical uses in renal diseases [J]. Braz J Med Biol Res, 2013, 46(10): 824 − 830. doi: 10.1590/1414-431X20132964 [5] BOBRIE A, COLOMBO M, RAPOSO G, et al. Exosome secretion: molecular mechanisms and roles in immune responses [J]. Traffic (Copenhagen, Denmark), 2011, 12(12): 1659 − 1668. doi: 10.1111/j.1600-0854.2011.01225.x [6] RAMACHANDRA L, QU Y, WANG Y, et al. Mycobacterium tuberculosis synergizes with ATP to induce release of microvesicles and exosomes containing major histocompatibility complex class II molecules capable of antigen presentation [J]. Infection and Immunity, 2010, 78(12): 5116 − 5125. doi: 10.1128/IAI.01089-09 [7] FERNANDO F S, DA SILVA MONTASSIER MDF, SILVA K R, et al. Nephritis associated with a S1 variant brazilian isolate of infectious bronchitis virus and vaccine protection test in experimentally infected chickens [J]. International Journal of Poultry Science, 2013, 12(11): 639. doi: 10.3923/ijps.2013.639.646 [8] NII T, ISOBE N, YOSHIMURA Y. Effects of avian infectious bronchitis virus antigen on eggshell formation and immunoreaction in hen oviduct [J]. Theriogenology, 2014, 81(8): 1129 − 1138. doi: 10.1016/j.theriogenology.2014.02.002 [9] YU L, JIANG Y, LOW S, et al. Characterization of three infectious bronchitis virus isolates from China associated with proventriculus in vaccinated chickens [J]. Avian Diseases, 2001, Apr,45(2): 416 − 424. [10] FARSANG A, ROS C, RENSTRöM L H, et al. Molecular epizootiology of infectious bronchitis virus in Sweden indicating the involvement of a vaccine strain [J]. Avian Pathology, 2002, 31(3): 229 − 236. doi: 10.1080/03079450220136530 [11] MCKINLEY E T, HILT D A, JACKWOOD M W. Avian coronavirus infectious bronchitis attenuated live vaccines undergo selection of subpopulations and mutations following vaccination [J]. Vaccine, 2008, 26(10): 1274 − 1284. doi: 10.1016/j.vaccine.2008.01.006 [12] CAVANAGH D. Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus [J]. Avian Pathology, 2003, 32(6): 567 − 582. doi: 10.1080/03079450310001621198 [13] CAVANAGH D, CASAIS R, ARMESTO M, et al. Manipulation of the infectious bronchitis coronavirus genome for vaccine development and analysis of the accessory proteins [J]. Vaccine, 2007, 25(30): 5558 − 5562. doi: 10.1016/j.vaccine.2007.02.046 [14] HONG Y, LEE J, VU T H, et al. Exosomes of lipopolysaccharide-stimulated chicken macrophages modulate immune response through the MyD88/NF-κB signaling pathway [J]. Developmental and Comparative Immunology, 2021, Feb,115: 103908. [15] THÉRY C, AMIGORENA S, RAPOSO G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Current Protocols in Cell Biology, 2006 Apr, chapter 3: unit 3.22. [16] LINDENBERGH M F S, STOORVOGEL W. Antigen presentation by extracellular vesicles from professional antigen-presenting cells [J]. Annual Review of Immunology, 2018, Apr,36: 435 − 459. [17] WANG G, WANG Z, ZHUANG P, et al. Exosomes carring gag/env of ALV-J possess negative effect on immunocytes [J]. Microbial Pathogenesis, 2017, Nov,112: 142 − 147. [18] SU Q, ZHANG Y, CUI Z, et al. Semen-derived exosomes mediate immune escape and transmission of reticuloendotheliosis virus [J]. Frontiers in Immunology, 2021, 12: 735280. doi: 10.3389/fimmu.2021.735280 [19] BANSAL S, PERINCHERI S, FLEMING T, et al. Cutting edge: circulating exosomes with COVID spike protein are induced by BNT162B2 (Pfizer-biontech) vaccination prior to development of antibodies: a novel mechanism for immune activation by mrna vaccines [J]. Immunol, 2021, 207(10): 2405 − 2410. doi: 10.4049/jimmunol.2100637 [20] QURESHI N, VOGEL S, WAY C, et al. The proteasome [J]. Immunologic research, 2007, 31(3): 243 − 260. [21] 宋延华, 刘福安. 鸡传染性支气管炎病毒S1基因在昆虫细胞中表达水平初探[J]. 中国病毒学., 1999, 14(3): 72 − 75. [22] 戴亚斌, 陈德胜, 丁铲, 等. 表达鸡传染性支气管炎病毒JS/95/03株S1蛋白的重组杆状病毒构建[J]. 病毒学报., 2003, 19(1): 86 − 90. [23] 廖明, 辛朝安, 王林川. 鸡传染性支气管炎病毒S1基因在昆虫细胞中的表达[J]. 中国兽医学报., 1997, 17(6): 22 − 26. [24] 李中华, 肖运才, 胡思顺, 等. 传染性支气管炎病毒S1蛋白基因的克隆与原核表达[J]. 中国兽医杂志., 2015, 51(4): 35 − 38. -




 下载:
下载: