-
烟碱型乙酰胆碱受体(Nicotinic acetylcholine receptors,nAChRs)属于配体门控离子通道,由5个独立的亚基组装而成。在哺乳动物中发现有16种不同的亚基用于nAChRs的构成,分别为α1—α7、α9、α10、β1—β4、δ、ε、γ;鸟类及家禽类动物还含有α8亚基[1]。nAChRs能够传递ACh刺激产生的信号,由于分布广泛,它可介导脑部及其外周的多种生理作用[2-3],并且这些受体结构在许多物种中高度保守,可通过异源表达进行相关研究[4]。虽然nAChRs是研究前景很好的治疗靶点,但由于一些亚型表达困难,相应药物和基础科学的研究进展缓慢,尤其是含有α6亚基的受体,它们在任何重组表达系统中都很难正常表达、形成功能通道[5-6]。这也间接导致α6β4* nAChRs(α6β4或包含其他亚基形成的亚型)在分子水平上与配体相互作用的研究尚不多见。过去有学者认为含α6亚基的nAChRs主要存在于中枢神经系统的儿茶酚胺能神经元中,随着研究深入,研究者们发现α6β4* nAChRs具有可调节人和猴肾上腺嗜铬细胞的胞吐[7-8]、控制小鼠海马去甲肾上腺素的释放等作用[9-10]。目前,α6β4* nAChR被认为是一种治疗神经病理性疼痛的新靶点,且可用于抑制成瘾。已经确定α6β4*亚型的受体在大鼠、小鼠背根神经节(dorsal root ganglia,DRG)中有表达。WIESKOPF等在小鼠上使用表达基因组学鉴定出机械性异常性疼痛与DRG中α6*受体的表达水平有关。通过基因编辑,构建α6*受体功能获得和缺失的突变体,发现基因敲除的小鼠机械性异常性疼痛水平增加,同时与神经性、炎性损伤相关的表现与野生型的受体完全不同,推测是由于在DRG伤害感受器中α6* nAChRs与P2X2/3受体的共表达产生相互作用,抑制疼痛信号的传导,发挥镇痛作用[11-14]。DONVITO等[15]的研究证实,α6β4* nAChRs具有调节THC(∆9-tetrahydrocannabinol,∆9-四氢大麻酚)成瘾后戒断的效果,可作为靶点用于THC戒断药物的开发。以上研究结果为α6β4* nAChRs的药理学研究提供了重要思路,且有助于研究神经病理性疼痛的发病机理。
β4亚基在α6β4* nAChRs的功能研究中显示出重要的作用,能够直接影响与配体药物、激动剂的结合活性。通过对比人类和大鼠β4亚基胞外配体结合区序列差异,笔者恰好在形成配体结合口袋的Loop D(54-59)、Loop E(102-118)、Loop F(160-167)附近分别发现52-53,115-116,160-161这3个双差异位点(图1),对于活性影响有较大的可能[16- 17],因此,利用PCR介导的受体定点突变技术,实现一次性将相邻2个位点同时突变,构建了3种双点突变体。将野生型和突变型亚基的DNA通过体外转录的方式得到cRNA,注射入非洲爪蟾卵母细胞内,诱导表达后用双电极电压钳系统检测野生型和突变型nAChRs的表达情况。通过比较野生型和突变型受体对激动剂乙酰胆碱(acetylcholine, ACh)的反应电流值,发现α6/α3β4[S52N,I53V] nAChR在相同浓度ACh刺激下的电流值更大,受体通道的开放程度更高。本研究旨在通过受体结构与功能的研究,找到影响受体敏感度的氨基酸位点,并构建突变体模型,为后续配体与该受体相互作用分子机制的研究打下基础。
-
雌性非洲爪蟾(Xenopus laevis)购自美国Nasco公司,在实验室饲养1个月以上。饲养用水经过滤、沉淀处理,饲养温度17 ℃。载有大鼠α6/α3、β4 nAChRs亚基基因的质粒来自美国犹他大学。由于α6亚基表达困难,故使用α6/α3嵌合体亚基替代(α6亚基的胞外配体结合域替换α3亚基的对应区域产生的嵌合体,其胞外结合域的结构和功能与α6亚基相同,且对配体的结合活性研究无影响)[18-19],利用该嵌合体构建的α6/α3β4 nAChR能正常表达。
质粒提取试剂盒(FastPure Plasmid Mini Kit)购自南京诺唯赞生物科技有限公司;DNA纯化试剂盒(MiniBEST DNA Fragment Purification Kit Ver. 4.0)、DL 15000 Marker、限制性内切酶Nhe I、Dpn I、Q5超保真聚合酶均购自宝生物工程(大连)有限公司;DNA体外转录试剂盒(mMESSAGE-mMACHINE® T7 Transcription Kit)、RNA 纯化试剂盒(MEGAclearTMTranscription Clean-Up Kit)购自美国Thermo Fisher Scientific公司;DNA marker Ⅳ购自天根生化科技(北京)有限公司;HEPES购自生工生物工程(上海)有限公司;乙酰胆碱(acetylcholine,ACh)、阿托品(Atropine)、胶原蛋白酶 (Collagenase)均购自美国 Sigma-Aldrich 公司;其他生化试剂均为国产分析纯。OR2溶液(NaCl、KCl、MgCl2和 HEPES分别为82.5、2.0、l.0、5 mmol·L−1,pH7.5);ND-96溶液(NaCl、KC1、MgCl2、CaCl2和 HEPES分别为96、2.0、1.0、1.8、5 mmol·L−1,pH7.5)。引物的合成和基因序列的测定由生工生物工程(上海)有限公司完成。
-
超微量分光光度计(Nanodrop 2000,美国Thermo Fisher Scientific公司);PCR仪(Mastercycler X50s,德国Eppendorf);小型水平电泳仪(美国 Bio-Rad);Alpha-2200凝胶成像分析系统(美国 ProteinSimple);Drummond微量注射器(Drummond Scientific,Broomall,PA);KCL-2000A恒温恒湿培养箱(日本EYELA);双电极电压钳放大器AxoClamp 900A,数模转换器Axon Digidata1550B(美国 Molecular Devices)。
-
对比大鼠与人类β4亚基的胞外配体结合域序列,确定3处双突变位点(图1中红色方框圈出的位置)。利用PCR介导的受体定点诱变方法,分别将这3处位点的氨基酸编码序列由大鼠β4亚基替换为人类β4亚基。
使用Primer Premier 5.0软件完成突变位点引物的设计,使正反向引物都携带有突变位点且位于中部,引物长度在25~45 bp之间,保证GC含量大于40%,Tm值大于70 ℃(表1)。
表 1 大鼠β4亚基突变引物序列
Table 1. Primer sequence of β4 subunit mutation
突变位点 Mutant site 突变引物与碱基序列 The sequence of primers (5′→3′) S52N,I53V 正向:CCATTCCTGTTTCAGCCAGACATTGGTGGTCATGATCTGTTCTCGC 反向:GCGAGAACAGATCATGACCACCAATGTCTGGCTGAAACAGGAATGG I115V,Q116L 正向:GGGGGCAGCCACAGGACGCTGCCGTTGG 反向:CCAACGGCAGCGTCCTGTGGCTGCCCCC K160M,S161T 正向:CCATGATGGCCGTGGGCGTCATAAGAACCATGTCAATCTCCG 反向:CGGAGATTGACATGGTTCTTATGACGCCCACGGCCATCATGG -
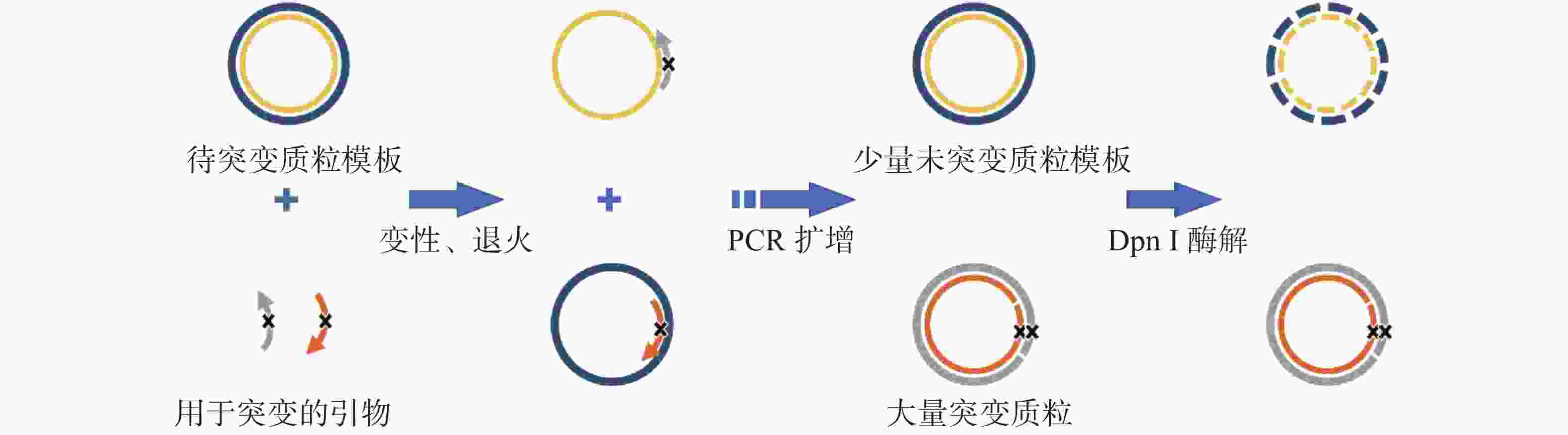
将载有大鼠β4亚基DNA序列的质粒作为模板,与诱导突变引物和Q5超保真聚合酶体系按比例混合,采用PCR方法进行定点诱变(图2)。PCR条件如下:50 μL体系,95 ℃预变性120 s;随后95 ℃变性20 s,60 ℃退火10 s,68 ℃延伸阶段3 min,共循环18次;最后68 ℃延伸5 min。PCR反应完成后,在水浴条件下,在PCR产物中加入1 μL Dpn I,37 ℃反应1 h,水解质粒模板。取少量PCR扩增产物在1.0 %琼脂糖凝胶中90 V电压下电泳20 min,观察电泳结果,验证PCR反应成功。取PCR产物3 μL转化DH5α大肠杆菌感受态细胞,将菌液涂布于含有氨苄青霉素的固体平板培养基上,37 ℃下培养14~18 h。每个平板分别挑取5个菌落,转入含有氨苄青霉素的LB液体培养基中,37 ℃、250 r·min−1 培养12~14 h,提质粒后用Nanodrop测定其浓度,并通过1%的琼脂糖凝胶电泳(条件同上)判断其纯度,测序验证插入序列突变情况。
-
选取测序正确的突变体质粒进行酶切线性化反应。200 μL酶切反应体系如下:突变体质粒20 μg(40~60 μL),限制性内切酶Nhe Ⅰ 10 μL,10×M Buffer 20 μL,剩余体积用ddH2O 补齐,37 ℃反应4 h。酶切后使用DNA纯化试剂盒回收线性化产物。回收的线性质粒使用Nanodrop测定其浓度,并通过1%的琼脂糖凝胶电泳判断其纯度。
-
将线性突变体质粒作为模版,使用试剂盒法进行体外转录。20 μL反应体系如下:线性模版2 μg(5~6 μL);2×NTP/CAP 10 μL;10×Rxn Buffer 2 μL;Enzyme Mix 2 μL;剩余体积用无RNA酶的ddH2O 补齐,37 ℃反应 4~6 h。随后在反应液中加入1 μL Dnase,反应30 min,酶解DNA模版。使用RNA纯化试剂盒回收cRNA产物,Nanodrop测定其浓度,并通过1%的琼脂糖凝胶电泳验证。
-
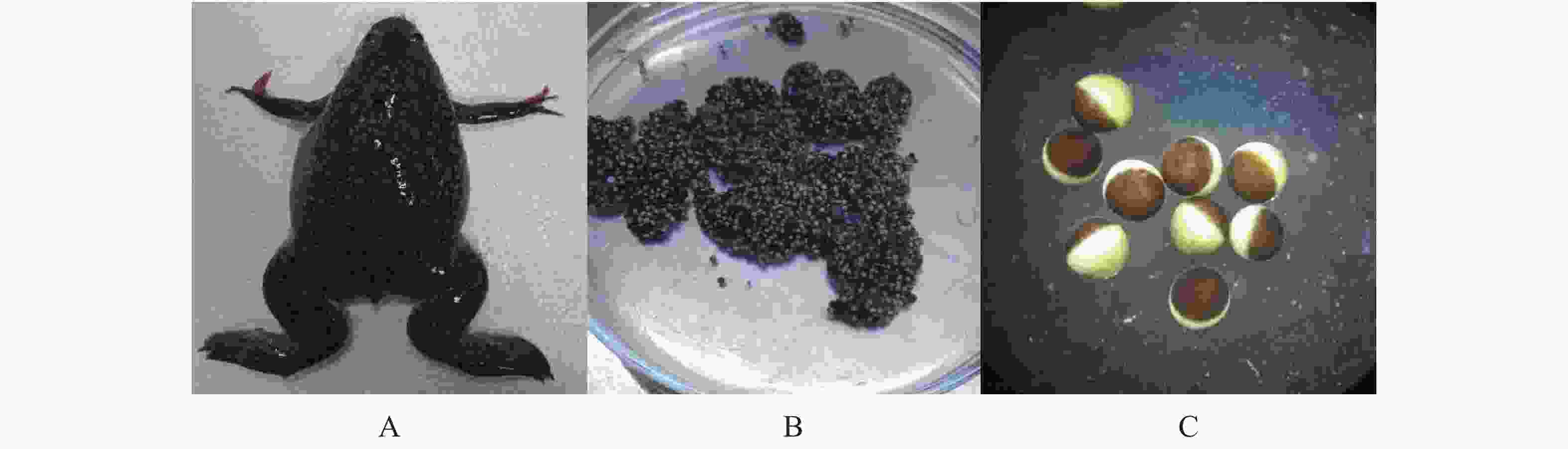
选取状态良好的成熟雌性非洲爪蟾,冰冻麻醉1 h,用手术刀在腹侧剖开小口,取出卵母细胞团块。剪碎团块,使用OR2溶液清洗至澄清。将卵母细胞转移至含有0.5 g·L−1 胶原蛋白酶的OR2溶液中酶解,室温下反应40~50 min,使其完全分离成为互不粘连的单个细胞,再用OR2溶液清洗至少10次后,挑选形态正常饱满的卵母细胞转入含抗ND-96溶液中,在17 ℃、湿度35%的条件下继续培养。
卵母细胞在获取24 h后用于显微注射,实验方法参考熊洋等[20]对α6/α3β4表达研究的优化结果,将野生型或突变型α6/α3与β4 nAChRs亚基的cRNA以1∶1的比例混合,每个亚基的终浓度≥500 ng·μL−1。将混合后的RNA以每个59.8 nL的体积显微注射入非洲爪蟾卵母细胞,在17 ℃、湿度35%条件下继续培养(图3)。
-
显微注射后2~5 d 使用双电极电压钳检测卵母细胞上受体的表达情况。设置钳制电压为−70 mV,灌流速度2~4 mL·min−1,记录ACh刺激细胞产生内向电流的情况。详细过程如下:每个循环总时长60 s,首先给予2 s Ach脉冲刺激,随后使用含有0.1 g·L−1 BSA的ND-96缓冲液灌流冲洗,每个记录程序含3次循环。数据记录软件为pClamp 11.0.3,采样模式为Episodic stimulation,采样频率为Slow 200 Hz。
-
使用不同浓度的ACh作为激动剂(1、10、50、100、250、500 μmol·L−1 和1 mmol·L−1)刺激受体通道开放,检测并记录产生的内向电流值。以1 mmol·L−1 ACh 刺激产生的内向电流作为基准,计算其他浓度的ACh(1~500 μmol·L−1)刺激通道开放的反应率。每组实验数据至少在不同卵母细胞上重复3~6次。所得数据导入GraphPad Prism 6.0 软件使用非线性拟合方程:Response%=100/{1+(EC50/[agonist])nH}。式中Response代表反应率,agonist代表激动剂的内向电流值,nH代表Hill系数,分析拟合并作图。
-
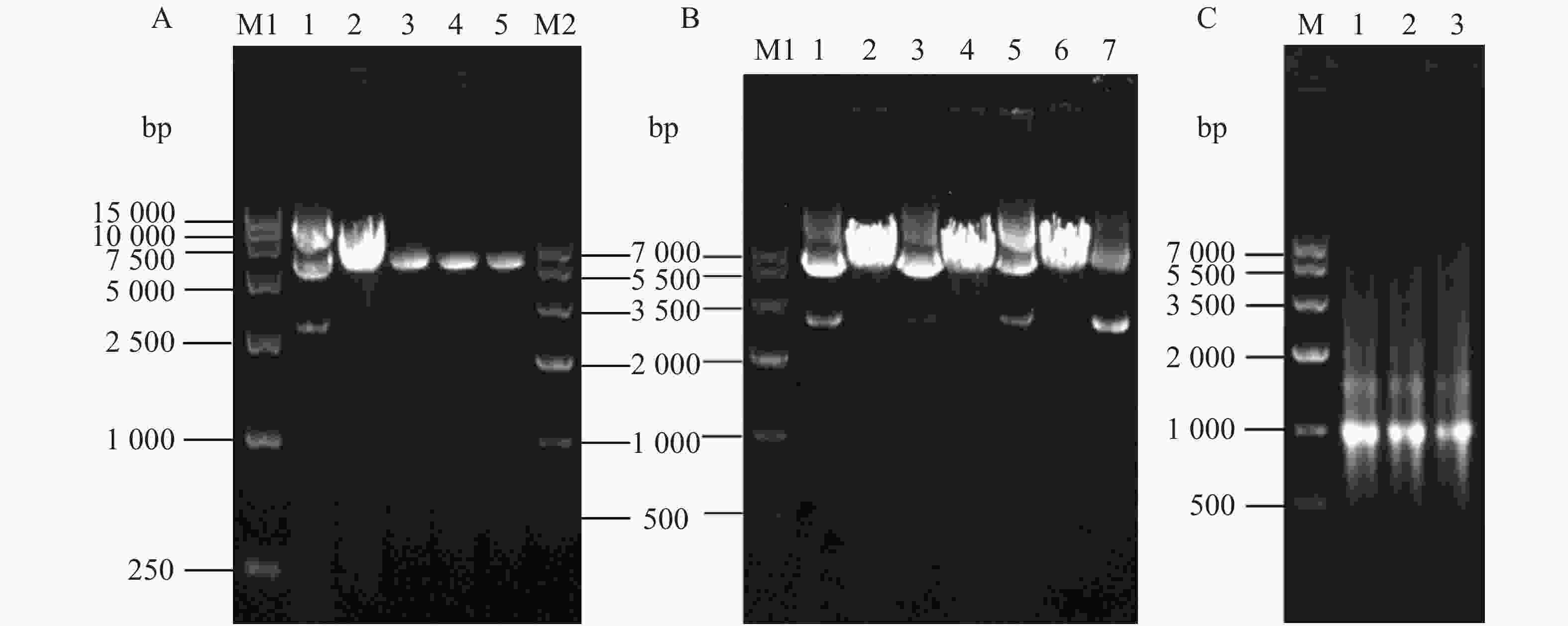
琼脂糖凝胶电泳结果表明,经PCR后,3种突变体基因均有条带产生(图4-A胶孔3、4、5),与线性质粒模板(图4-A胶孔2)的位置一致,可以将PCR产物用于转化实验。
-
使用质粒提取试剂盒提取突变质粒,所得结果经超微量分光光度计测得浓度(表2)。琼脂糖凝胶电泳结果验证质粒纯度良好。插入基因测序结果使用NCBI网站中的BLAST在线序列比对验证,证实3个突变体质粒均构建成功。将测序正确的β4突变体质粒与本体质粒分别进行酶切反应,琼脂糖凝胶电泳验证。环状质粒(图4-B胶孔1、3、5、7)因呈超螺旋结构,在琼脂糖凝胶中空间位阻小,所以移动更快。而线性化的质粒(图4-B胶孔2、4、6)移动较慢。电泳结果中线性化质粒对应泳道在环状质粒对应位置已无条带,证明酶切完全。经超微量分光光度计测得浓度与A260/280值(表2),均在正常范围内,可进行后续实验。
表 2 突变体质粒、线性质粒浓度与A260/280值
Table 2. Mutant plasmid and linear plasmid concentration and A260 /280
质粒 Plasmid 浓度 /(g·L−1) Concentration A260/280 线性质粒 Linear plasmid 浓度 /(g·L−1) Concentration A260/280 S52N, I53V 0.247 5 1.86 S52N, I53V 0.288 2 1.88 I115V, Q116L 0.240 3 1.86 I115V, Q116L 0.291 1 1.88 K160M, S161T 0.231 5 1.85 K160M, S161T 0.226 5 1.86 -
测定体外转录获得的cRNA浓度(表3),均达到500 mg·µL−1。琼脂糖凝胶结果显示,图4-C中胶孔1、2、3相同高度均有对应的较为清晰明亮的条带,证明体外转录成功,可用于下一步卵母细胞显微注射。
表 3 突变体cRNA浓度与A260/280值
Table 3. Mutant cRNA concentration and A260/280
突变位点
Mutant sitecRNA浓度 /(g·L−1)
ConcentrationA260/280 S52N, I53V 0.5915 2.08 I115V, Q116L 0.7097 2.07 K160M, S161T 0.5867 2.08 -
使用双电极电压钳对野生型和3种突变型受体的功能进行检测。α6/α3β4[S52N, I53V]突变型的受体与其他几种相比,表达时间略有提前,在注射后的第3天即达到正常水平。另外2种突变型与野生型的受体表达时间无明显的差异,均在第4天达到正常水平。结果表明,ACh浓度为1 μmol·L−1时均无电流产生,未达到产生内向电流的最小刺激强度。随着ACh浓度的增大,受体接受ACh刺激产生的电流值也随之增大,呈现出先快后慢的变化趋势。对比图5中A、B、C、D的电流轨迹图,突变受体与野生型对ACh的敏感程度相当,可以初步判断,突变并未影响受体的基本结构及功能。当给予相同浓度ACh刺激时,突变型α6/α3β4[S52N, I53V] nAChR相比于野生型和其他的突变型,电流值明显更大,推测是α6/α3β4[S52N, I53V] nAChR离子通道的开放水平更高。

图 5 野生型和突变型α6/α3β4 nAChR对不同浓度ACh的电流图
Figure 5. Current traces of wild-type and mutant α6/α3β4 nAChR evoked by different concentrations of ACh
使用Graphpad Prism 6.0软件对测定结果进行分析,绘制浓度−反应率曲线图,并计算受体对ACh刺激的EC50。对比图6中A、B、C图中的曲线,结果表明,野生型与突变型受体的变化趋势相似。野生型α6/α3β4 nAChR 的EC50是突变型α6/α3β4[S52N, I53V] nAChR的2倍(表4),证明52、53位双点突变,对ACh的激动活性有一定的提升,使α6/α3β4 nAChR与ACh结合后离子通道的开放程度增加。
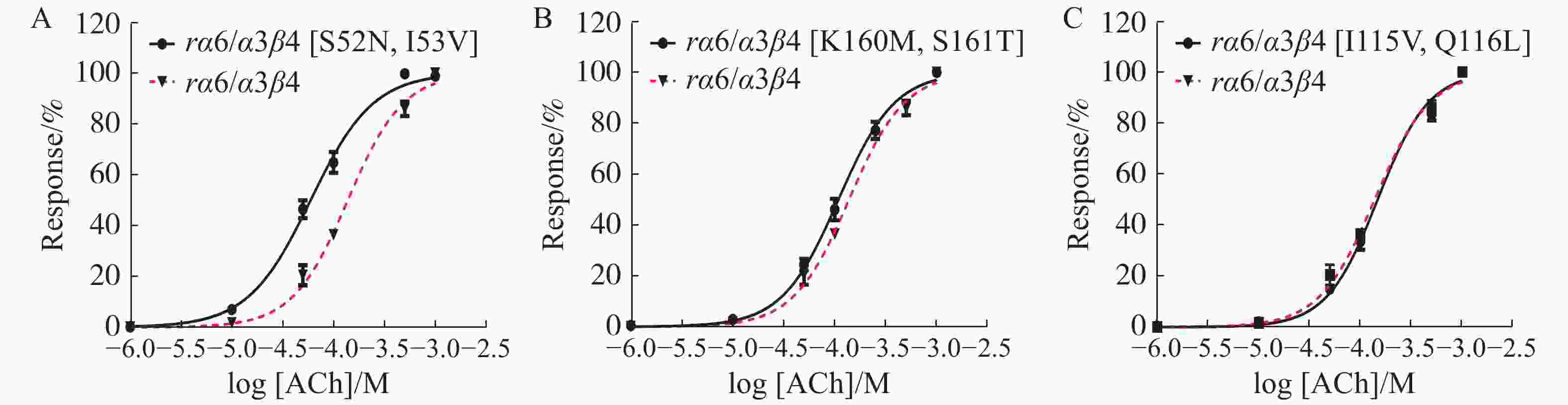
图 6 野生型及突变型α6/α3β4 nAChR对激动剂ACh的浓度−反应曲线Mean±SEM,n=3~6。
Figure 6. Concentration response curve of wild-type and mutant α6/α3β4 nAChR to the agonist ACh Mean ± SEM, n=3~6.
表 4 野生型及突变型α6/α3β4 nAChRs对ACh门控的半数有效浓度
Table 4. Median effective concentration (EC50) of wild type and mutant α6/α3β4 nAChRs for ACh stimulation
受体名称 EC50/ (μmol·L−1) (95% CI) 与α6/α3β4的比值 Hill slope (95% CI) α6/α3β4 138.2 (127.1~150.2) 1 1.592 (1.395~1.790) α6/α3β4[S52N, I53V] 59.58 (53.07~66.89) 0.4 1.407 (1.156~1.658) α6/α3β4[I115V, Q116L] 147.8 (134.6~162.4) 1.1 1.727 (1.490~1.974) α6/α3β4[K160M, S161T] 108.8 (127.6~185.8) 0.8 1.567 (1.276~1.858) 注:EC50值、95% CI (95% confidence interval)、Hill slope(nH)等数据来自浓度−反应曲线图;所有数据来源于至少3个不同的非洲爪蟾卵母细胞。
Note: EC50 value, 95% CI (95% confidence interval), Hill slope (nH) and other data are from the concentration response curve; All data were derived from at least three different Xenopus oocytes. -
α6β4*作为一类特殊的nAChRs受到广泛关注,但含α6亚基nAChRs的异源表达却十分困难。烟碱型乙酰胆碱受体与配体结合的主要结构位于细胞膜外的N-端结合域,通过基因改造,构建α6/α3的嵌合体可以辅助受体正常表达,不影响受体的功能活性。
本研究比较了人类和大鼠的α6和β4两种亚基的胞外N-端结合域的序列,发现人类和大鼠α6亚基的同源性较高,而β4亚基的种属差异性更大。芋螺毒素是一类作用于nAChRs的小分子多肽,可以作为分子探针,研究配体与受体结合的关键位点。HONE等进行了人类(Human)和大鼠(Rat)α6/α3和β4亚基的混合表达实验,构建了Hα6/α3Hβ4、Rα6/α3Rβ4、Hα6/α3Rβ4和Rα6/α3Hβ4这4种受体,并选取3种作用于α6/α3β4 nAChR的芋螺毒素PeIA、PnIA和TxIB作为拮抗剂,分别比较配体对突变受体的阻断作用。结果显示,这3种芋螺毒素对受体的阻断作用具有一致性,由强到弱依次为Hα6/α3Hβ4> Rα6/α3Hβ4> Hα6/α3Rβ4> Rα6/α3Rβ4。该实验从一定程度上说明β4亚基对α6/α3β4 nAChR的配体识别和选择具有重要作用[21]。
本实验利用受体定点突变技术对大鼠β4亚基非保守残基进行受体突变,将其替换人类β4亚基相同位置处的残基,对比序列发现有3处位点均为相邻2个残基的差异。将2个差异位点均设计在突变引物内,经一次突变即得到具有相邻2个残基差异的突变受体,大大缩短了突变体构建的时间,并且为后续大鼠和人类α6/α3β4 nAChR对芋螺毒素活性差异关键位点的筛选,构建了3个双点突变体模型。
在对突变体进行电生理活性检测中,电流值的大小和变化趋势与野生型受体均相似,表明受体基本的结构和功能保持不变。而观察ACh浓度-反应率曲线图,其中1种突变体α6/α3β4[S52N, I53V]相比于野生型,对ACh敏感性更高,EC50值仅为本体的一半。并且在标准浓度(100 μmol·L−1)ACh下,突变体α6/α3β4[S52N, I53V]产生的激发电流值更大。推测可能是由于52位由丝氨酸变为天冬酰胺后更易形成氢键,而53位由异亮氨酸到缬氨酸的改变,导致其空间位阻减小,使得在与ACh结合时,通道的敏感性增加,且开放程度增大。由于在β4亚基上人类和大鼠还存在其他差异位点,因此,α6/α3β4 nAChR对于激动剂ACh和拮抗剂芋螺毒素活性的关键氨基酸位点还有待研究。
Preparation and Functional Study of β4 Subunit Double-point Mutant of α6/α3β4 Nicotinic Acetylcholine Receptors
-
摘要: 在烟碱型乙酰胆碱受体家族中,含α6亚型的受体是比较特殊的一类。研究发现α6β4*亚型(*表示含其他亚基)在神经系统方面具有一定的调节作用,与神经性疼痛、成瘾等多种疾病的发病机制密切相关,可作为潜在的治疗靶点。比对大鼠与人类α6和β4亚基的序列,以野生型基因为模板,采用基因定点突变的方式,成功得到3种相邻位点突变的α6/α3β4受体突变型基因。通过体外转录、显微注射等手段,构建α6/α3β4受体野生型和突变型在非洲爪蟾卵母细胞上的表达模型,并使用双电极电压钳检测受体的表达情况。结果表明,与野生型受体相比,突变体α6/α3β4[S52N, I53V] 对ACh的敏感性有所提升,EC50为59.58 μmol·L−1,是野生型的1/2,而其他两种突变体的敏感性与野生型相同。
-
关键词:
- α6/α3β4烟碱型乙酰胆碱受体 /
- 相邻位点突变 /
- 体外表达 /
- 双电极电压钳
Abstract: The receptor containing α6 subunit is one of the special nicotinic acetylcholine receptors. Recent studies have found that the α6/α3β4 subtypes have a certain regulatory effect on the nervous system. And it is related to the pathogenesis of many diseases, such as neuropathic pain, addiction, etc., which have been regarded as potential therapeutic targets. The sequences of rat and human α6 and β4 subunits were compared, and three mutant α6/α3β4 receptor genes with adjacent site mutations were produced on the basis of wild-type genes by site-directed mutagenesis. The α6/α3β4 receptors and their mutants were expressed on Xenopus oocytes by transcription in vitro, microinjection and other methods. And the functions of the receptors were detected by using the two-electrode voltage voltage-clamp system. The results indicated that the mutant receptor α6/α3β4 [S52N, I53V] was more sensitive to ACh, with its EC50 being 59.58 μmol·L−1, which is half of the wild-type receptor. Meanwhile, the other two mutant receptors had similar sensitivities to the wild type. -
图 4 定点突变PCR产物、突变体亚基质粒酶切及转录后cRNA检测的琼脂糖电泳
A.1:野生型rat β4质粒;2:线性rat β4质粒;3~5:突变体β4 [S52N, I53V]、β4 [I115V, Q116L]、β4 [K160M, S161T]; B.1、3、5、7:突变体β4[S52N, I53V]、[I115V, Q116L]、[K160M, S161T]、野生型β4亚基质粒;2、4、6: 突变体β4 [S52N,I53V]、[I115V, Q116L]、[K160M, S161T]线性质粒;C: 1~3:突变体β4 [S52N, I53V]、β4 [I115V, Q116L、β4 [K160M, S161T] cRNA;M1: DL15 000 DNA marker;M: DNA marker IV。
Fig. 4 Agarose electrophoresis of PCR site-directed mutation products, linear mutant plasmid after digestion and cRNA
A.1: Wild-type rat β4 plasmid; 2: Linear rat β4 plasmid; 3-5: β4 subunit mutant after PCR site-directed mutation [S52N, I53V ], [I115V,Q116L], [K160M,S161T]; B. 1, 3, 5, 7: Plasmids of β4 subunit mutants [S52N,I53V], [I115V, Q116L], [K160M, S161T] and wild-type subunit; 2, 4, 6 : Linear plasmids of β4 subunit mutant [S52N, I53V], [I115V, Q116L], [K160M, S161T]; C: 1-3: cRNA of β4 subunit mutant [S52N,I53V], [I115V, Q116L], [K160M, S161T]; M1: DL15 000 DNA marker; M: DNA marker IV.
表 1 大鼠β4亚基突变引物序列
Table 1 Primer sequence of β4 subunit mutation
突变位点 Mutant site 突变引物与碱基序列 The sequence of primers (5′→3′) S52N,I53V 正向:CCATTCCTGTTTCAGCCAGACATTGGTGGTCATGATCTGTTCTCGC 反向:GCGAGAACAGATCATGACCACCAATGTCTGGCTGAAACAGGAATGG I115V,Q116L 正向:GGGGGCAGCCACAGGACGCTGCCGTTGG 反向:CCAACGGCAGCGTCCTGTGGCTGCCCCC K160M,S161T 正向:CCATGATGGCCGTGGGCGTCATAAGAACCATGTCAATCTCCG 反向:CGGAGATTGACATGGTTCTTATGACGCCCACGGCCATCATGG 表 2 突变体质粒、线性质粒浓度与A260/280值
Table 2 Mutant plasmid and linear plasmid concentration and A260 /280
质粒 Plasmid 浓度 /(g·L−1) Concentration A260/280 线性质粒 Linear plasmid 浓度 /(g·L−1) Concentration A260/280 S52N, I53V 0.247 5 1.86 S52N, I53V 0.288 2 1.88 I115V, Q116L 0.240 3 1.86 I115V, Q116L 0.291 1 1.88 K160M, S161T 0.231 5 1.85 K160M, S161T 0.226 5 1.86 表 3 突变体cRNA浓度与A260/280值
Table 3 Mutant cRNA concentration and A260/280
突变位点
Mutant sitecRNA浓度 /(g·L−1)
ConcentrationA260/280 S52N, I53V 0.5915 2.08 I115V, Q116L 0.7097 2.07 K160M, S161T 0.5867 2.08 表 4 野生型及突变型α6/α3β4 nAChRs对ACh门控的半数有效浓度
Table 4 Median effective concentration (EC50) of wild type and mutant α6/α3β4 nAChRs for ACh stimulation
受体名称 EC50/ (μmol·L−1) (95% CI) 与α6/α3β4的比值 Hill slope (95% CI) α6/α3β4 138.2 (127.1~150.2) 1 1.592 (1.395~1.790) α6/α3β4[S52N, I53V] 59.58 (53.07~66.89) 0.4 1.407 (1.156~1.658) α6/α3β4[I115V, Q116L] 147.8 (134.6~162.4) 1.1 1.727 (1.490~1.974) α6/α3β4[K160M, S161T] 108.8 (127.6~185.8) 0.8 1.567 (1.276~1.858) 注:EC50值、95% CI (95% confidence interval)、Hill slope(nH)等数据来自浓度−反应曲线图;所有数据来源于至少3个不同的非洲爪蟾卵母细胞。
Note: EC50 value, 95% CI (95% confidence interval), Hill slope (nH) and other data are from the concentration response curve; All data were derived from at least three different Xenopus oocytes. -
[1] ALBUQUERQUE E X, PEREIRA E F, ALKONDON M, et al. Mammalian nicotinic acetylcholine receptors: from structure to function [J]. Physiol Rev, 2009, 89(1): 73 − 120. doi: 10.1152/physrev.00015.2008 [2] GOTTI C, CLEMENTI F. Neuronal nicotinic receptors: from structure to pathology [J]. Progress in Neurobiology, 2004, 74(6): 363 − 396. doi: 10.1016/j.pneurobio.2004.09.006 [3] PICCIOTTO M R. Nicotine as a modulator of behavior: beyond the inverted U [J]. Trends in Pharmacological Sciences, 2003, 24(9): 493 − 499. doi: 10.1016/S0165-6147(03)00230-X [4] DANI J A, BERTRAND D. Nicotinic acetylcholine receptors and nicotinic cholinergic mechanisms of the central nervous system [J]. Annual Review of Pharmacology and Toxicology, 2007, 47: 699 − 729. doi: 10.1146/annurev.pharmtox.47.120505.105214 [5] LETCHWORTH S R, WHITEAKER P. Progress and challenges in the study of alpha6-containing nicotinic acetylcholine receptors [J]. Biochemical Pharmacology, 2011, 82(8): 862 − 872. doi: 10.1016/j.bcp.2011.06.022 [6] WANG J, KURYATOV A, LINDSTROM J. Expression of cloned alpha6* nicotinic acetylcholine receptors [J]. Neuropharmacology, 2015, 96(Pt B): 194 − 204. [7] HERNANDEZ-VIVANCO A, HONE A J, SCADDEN M L, et al. Monkey adrenal chromaffin cells express alpha6beta4* nicotinic acetylcholine receptors [J]. PLoS One, 2014, 9(4): e94142. doi: 10.1371/journal.pone.0094142 [8] PEREZ-ALVAREZ A, HERNANDEZ-VIVANCO A, MCINTOSH J M, et al. Native alpha6beta4* nicotinic receptors control exocytosis in human chromaffin cells of the adrenal gland [J]. FASEB J, 2012, 26(1): 346 − 354. doi: 10.1096/fj.11-190223 [9] AZAM L, MASKOS U, CHANGEUX J P, et al. Alpha-conotoxin BuIA[T5A; P6O]: a novel ligand that discriminates between alpha6ss4 and alpha6ss2 nicotinic acetylcholine receptors and blocks nicotine-stimulated norepinephrine release [J]. FASEB J, 2010, 24(12): 5113 − 5123. [10] AZAM L, MCINTOSH J M. Characterization of nicotinic acetylcholine receptors that modulate nicotine-evoked [3H]norepinephrine release from mouse hippocampal synaptosomes [J]. Molecular Pharmacology, 2006, 70(3): 967 − 976. doi: 10.1124/mol.106.024513 [11] HONE A J, MEYER E L, MCINTYRE M, et al. Nicotinic acetylcholine receptors in dorsal root ganglion neurons include the alpha6beta4* subtype [J]. FASEB J, 2012, 26(2): 917 − 926. doi: 10.1096/fj.11-195883 [12] HONE A J, MCINTOSH J M. Nicotinic acetylcholine receptors in neuropathic and inflammatory pain [J]. FEBS Lett, 2018, 592(7): 1045 − 1062. doi: 10.1002/1873-3468.12884 [13] WIESKOPF J S, MATHUR J, LIMAPICHAT W, et al. The nicotinic alpha6 subunit gene determines variability in chronic pain sensitivity via cross-inhibition of P2X2/3 receptors [J]. Sci Transl Med, 2015, 7(287): 272 − 287. [14] LIMAPICHAT W, DOUGHERTY D A, LESTER H A. Subtype-specific mechanisms for functional interaction between alpha6beta4* nicotinic acetylcholine receptors and P2X receptors [J]. Mol Pharmacol, 2014, 86(3): 263 − 274. doi: 10.1124/mol.114.093179 [15] DONVITO G, MULDOON P P, JACKSON K J, et al. Neuronal nicotinic acetylcholine receptors mediate (9) -THC dependence: Mouse and human studies [J]. Addiction biology, 2020, 25(1): e12691. [16] ZHANGSUN D, ZHU X, WU Y, et al. Key residues in the nicotinic acetylcholine receptor beta2 subunit contribute to alpha-conotoxin LvIA binding [J]. J Biol Chem, 2015, 290(15): 9855 − 9862. doi: 10.1074/jbc.M114.632646 [17] CUNY H, KOMPELLA S N, TAE H S, et al. Key structural determinants in the agonist binding loops of human beta2 and beta4 nicotinic acetylcholine receptor subunits contribute to alpha3 beta4 subtype selectivity of alpha-conotoxins [J]. J Biol Chem, 2016, 291(45): 23779 − 23792. doi: 10.1074/jbc.M116.730804 [18] KURYATOV A, OLALE F, COOPER J, et al. Human α6 AChR subtypes: subunit composition, assembly, and pharmacological responses [J]. Neuropharmacology, 2000, 39(13): 2570 − 2590. doi: 10.1016/S0028-3908(00)00144-1 [19] MCINTOSH J M, AZAM L, STAHELI S, et al. Analogs of alpha-conotoxin MII are selective for alpha6-containing nicotinic acetylcholine receptors [J]. Mol Pharmacol, 2004, 65(4): 944 − 952. doi: 10.1124/mol.65.4.944 [20] 熊洋, 朱晓鹏, 吴勇, 等. α6/α3β4乙酰胆碱受体在非洲爪蟾卵母细胞中的表达[J]. 热带生物学报, 2020, 11(4): 391 − 398. [21] HONE A J, TALLEY T T, BOBANGO J, et al. Molecular determinants of alpha-conotoxin potency for inhibition of human and rat alpha6beta4 nicotinic acetylcholine receptors [J]. J Biol Chem, 2018, 293(46): 17838 − 17852. doi: 10.1074/jbc.RA118.005649 -




 下载:
下载: