-
丙氨酸脱氢酶(alanine dehydrogenase,ALD,EC 1.4.1.1)是一种氧化还原酶,使丙氨酸可逆转化为丙酮酸[1]。编码ALD的基因为ald基因。结核分枝杆菌(M.tuberculosis)的ald基因在E. coli中表达后具有丙酮酸胺化活性;而当ald基因在M. tuberculosis中失活时,会导致细菌ALD活性丧失[2]。因此,ald基因是微生物中ALD活性必需的[1]。丙氨酸脱氢酶在自然界中分布广泛,存在于细菌、植物和真核藻类中,在微生物的氮、碳代谢中起重要作用[3]。ALD将脱氨/胺化作用与核苷酸辅因子(NAD+)的还原/氧化联系起来,从而与微生物中多种能量消耗/产生过程相关[4]。丙氨酸脱氢酶在孢子形成过程中以L−丙氨酸为主要能源,通过柠檬酸循环供应能量[5],同时参与固氮作用(氨同化),确保生物体内氮源充足[6-7],也可以平衡机体内的糖代谢和氨基酸代谢[8]。此外,丙氨酸脱氢酶作为新的抑制剂靶标也具有特殊的医学意义[9],抑制ALD会导致肽聚糖层合成所需的L−丙氨酸不足,从而阻碍致病细菌的生长[10]。因此,基于丙氨酸脱氢酶的生物学特性开发的生物抑菌剂,能够对细菌尤其是致病菌的生长产生一定的抑制作用[11]。
维氏气单胞菌(Aeromonas veronii)是一种革兰氏阴性菌,广泛存在于自然环境中,是感染鱼类的最常见致病菌之一。目前已证实,维氏气单胞菌可感染罗非鱼、斑点叉尾、草鱼等20多种水生生物,病鱼主要有脏器出血、严重腹水等症状[12]。此外,维氏气单胞菌还能够感染狐、熊猫等哺乳动物,导致其精神沉郁,肠胃炎,肝脏病变[13]。该菌也可以导致人类疾病,人食用了被污染的水产品和畜禽产品后,可引发腹泻、脑膜炎和败血症等,免疫力低下者甚至死亡[14]。因此,维氏气单胞菌被定义为一种人−兽−鱼共患的致病菌,从而引起人们的警惕与重视。为了后续在维氏气单胞菌中开展ALD相关研究,开发潜在特异性抑菌剂,笔者通过基因重组技术成功构建Flag-ALD融合表达质粒,在大肠杆菌表达体系中对其进行诱导表达,并通过SDS-PAGE和western blot技术检测外源表达蛋白。本研究构建的重组载体为后续进一步探究ALD蛋白在维氏气单胞菌中的调控功能夯实了基础,有利于揭示丙氨酸脱氢酶在各种代谢调控通路中起的关键作用。以ALD为新的切入点,有助于揭示维氏气单胞菌的致病机制,为预防和治疗由该病原菌引起的水产病害提供新的途径和思路。
-
本实验用的菌株与质粒见表1。
表 1 实验材料及来源
Table 1. Strains and plasmids used in this study
实验材料 Burst material 相关属性 Related attributes 来源 Source 菌株
StrainsE. coli BL21 野生型,用于表达外源蛋白表达 实验室保存 E. coli DH5α 野生型,用于质粒克隆 实验室保存 Aeromonas veronii 野生型,分离自发病鱼体 实验室保存 质粒
PlasmidspACYDuet 大肠杆菌蛋白表达载体,含有左霉素抗性基因 实验室保存 pACYDuet-Flag-ald pACYDuet重组质粒,包含T7启动子和维氏气单胞菌融合Flag标签的 ald 基因 本实验构建 -
限制性核酸内切酶NcoⅠ,EcoRⅠ和T4DNA连接酶选购自美国NEB公司;2×PhantaMaxMaster Mix,DL5000 DNA Marke、质粒提取试剂盒、胶回收试剂盒、PCR纯化试剂盒购自中国Vazyme公司;双色预染蛋白Mark、5×蛋白质加样缓冲液购自中国生工公司;用于Western blot的anti-Flag抗体、山羊抗小鼠lgG H&L(Alexa Fluor ®488)购自美国abcam公司;其他试剂均为国产分析纯。
-
把维氏气单胞菌C4的基因组DNA作为模板,用引物对Flag-ALD-F/ALD-R扩增ald目的基因(Flag-ALD-F:5′-CATGCCATGGGCGATTACAAGGATGACGACGATAAGATGATTATCGGTGTACCTAA-3′;ALD-R:5′-CGGAATTCTCAGTTCAGCAGGGTCAGGG-3′)。PCR反应体系为50 μL,体系包括:上下游引物各1 μL,模板1 μL,2×PCR mix25 μL,ddH2O 22 μL。PCR扩增条件为:预变性94 ℃ 10 min,变性94 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 80 s,总计循环30次,终延伸72 ℃ 10 min,4 ℃停止反应。PCR产物用1%琼脂糖凝胶电泳分离检测,对目的条带进行割胶纯化回收。
-
将纯化后的目的片段与pACYCDuet空载质粒分别用限制性核酸内切酶NcoⅠ与EcoRⅠ进行双酶切处理,酶切体系为50 μL,包括:内切酶NcoⅠ和EcoRⅠ各1 μL,Cutsmart缓冲液5 μL,目的基因和质粒各600 ng,ddH2O 30 μL。将酶切产物用试剂盒纯化回收并用T4 DNA连接酶放在22 ℃金属浴中连接30 min,连接体系包括:pACYCDuet质粒30 ng,目的基因90 ng,T4 DNA连接酶1 μL,Cutsmart缓冲液1 μL,ddH2O 10 μL。将连接产物电转化至已经制备好的E. coli DH5α感受态细胞内,将转化细菌在37 ℃复苏1 h后涂布到含25 mg·L−1左霉素的LB固体培养基上,37 ℃恒温培养过夜后,挑取转化子的单菌落至LB培养基中振荡培养,提取质粒。用载体特异性引物对pACYCDuet-F/pACYCDuet-R进行菌落PCR(pACYCDuet-F:5′-TAATACGACTCACTATAGGG-3′;pACYCDuet-R:5′-TGCTAGTTATTGCTCAGCGG-3′),以验证阳性转化子,将验证正确的阳性转化子送至上海生工生物工程有限公司测序。
-
将测序成功的pACYCDuet-Flag-ald重组载体电转化至E. coli BL21感受态中,挑取单菌落至含25 mg·L−1 氯霉素的5 mL LB培养基中37 ℃恒温振荡培养12 h。将其菌液按初始OD600值为0.01的接种量转接到200 mL LB培养基中(含25 mg·L−1氯霉素),37 ℃培养至OD600值为0.4时加入终浓度0.1 mmol·L−1的异丙基−β−D−1−硫代半乳糖吡喃糖苷(IPTG)诱导外源蛋白大量表达,每隔1 h取菌液,6 000 r·min−1离心10 min收集菌体,在收集的菌体中加入50 μL 1×蛋白上样缓冲液(250 mmol·L−1 Tris-HCl,pH 6.8,10%SDS,0.5%溴酚蓝,50%甘油,7.5%DTT),吹打混匀后,100 ℃金属浴20 min,13 000 r·min−1离心10 min,分离上清和沉淀。向沉淀中加入20 μL 1×蛋白加样缓冲液,吹打混匀后,100 ℃水浴锅20 min。各取10 μL上清和沉淀蛋白提取液,用12%SDS-PAGE凝胶进行电泳分析,考马斯亮蓝R-250染色1 h显示电泳结果。
-
将含有外源表达蛋白的细胞全蛋白提取物通过12%SDS-PAGE凝胶进行电泳分离,在250 mA的恒定电流下通过湿转法转膜90 min,将全蛋白提取物转移到NC膜上。用5%脱脂奶粉封闭液(10 mmol·L−1 Tris-HCI,100 mmol·L−1 NaCl,25 mmol·L−1 NaF,0.1%Tween-20,pH7.4)室温封闭硝酸纤维素膜3 h,然后用anti-Flag抗体4 ℃孵育过夜,TBST (10 mmol·L−1 Tris-HCI,135 mmol·L−1 NaCl,2.5 mmol·L−1 KCI,0.1%Tween-20,pH 7.4)洗膜3次,每次10 min,之后用荧光标记的山羊抗小鼠lgG H&L(Alexa Fluor ®488)避光常温孵育2 h,1X TBST洗膜3次,每次10 min,最后在Typhoon FLA 9500(GE,USA)多功能激光扫描仪上扫描荧光标记的NC膜,检测目的蛋白表达情况。
-
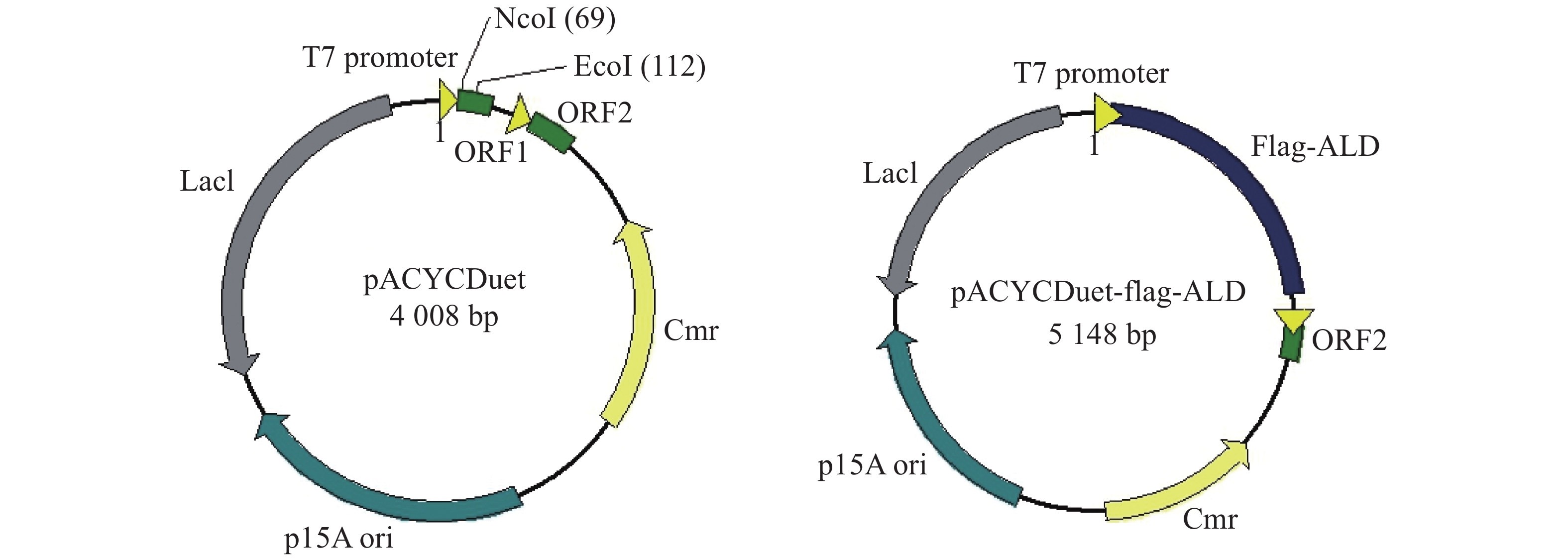
为了便于检测在E. coli中大量表达的ALD蛋白,笔者在ald基因N端融合Flag标签,通过检测Flag标签来验证ALD蛋白的表达。E. coli BL21是常用的大肠杆菌工程菌株,通常与含有T7启动子的质粒搭档,用于诱导蛋白的过量表达。从图1可知,本实验选择pACYCDuet载体在E. coli BL21中表达Flag-ALD蛋白,质粒含有T7启动子,经IPTG诱导可大量表达目标蛋白。
图 1 pACYCDuet空载体与携带外源片段的pACYCDuet-Flag-ald 重组质粒图谱
Figure 1. The plasmid profiles of pACYCDuet and pACYCDuet-Flag-ALD
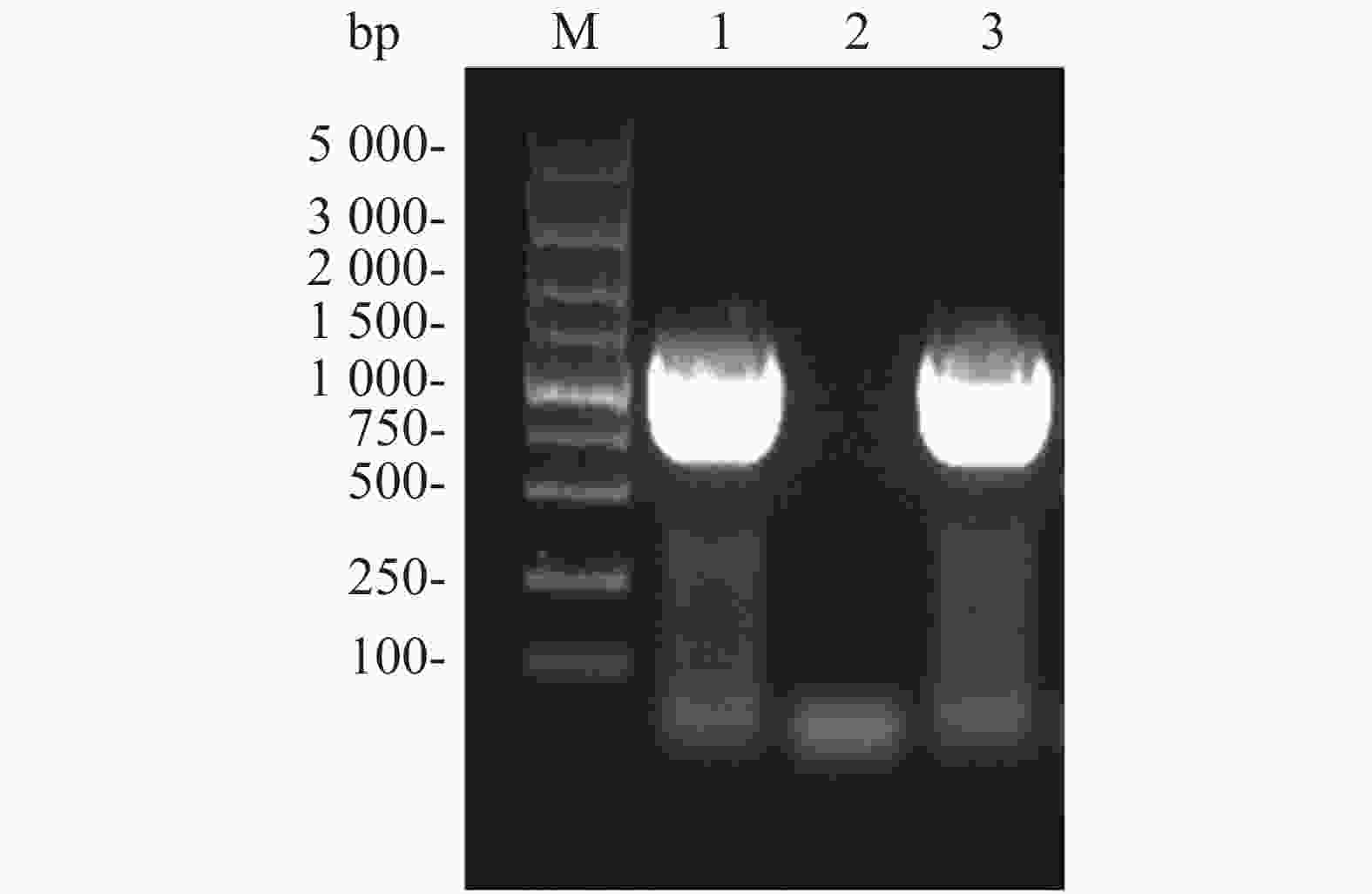
Flag标签含有8个氨基酸,核苷酸序列为24 bp,将其核苷酸序列并入用于扩增ald基因的上游引物的5'端,经PCR扩增即可获得Flag-ALD融合片段。ald基因序列长度为1 116 bp,则编码Flag-ALD融合片段的核苷酸序列理论长度为1 140 bp。PCR产物经过1%琼脂糖凝胶电泳分析,结果显示,大约1 100 bp处存在1条明亮单一的目的条带,可用于后续实验(图2A)。通过割胶回收纯化PCR产物后,与pACYCDuet空载体均用限制性核酸内切酶NcoⅠ和EcoRⅠ进行双酶切,并对酶切产物进行纯化回收。对酶切产物进行1%琼脂糖凝胶电泳分析(图2B),从图2B可知,酶切后的目的片段长度在1 000~1 500 bp之间(泳道1),酶切后载体的泳动速度比酶切之前载体的泳动速度慢(泳道2和泳道3),表明载体已被成功酶切,可用于后续实验。
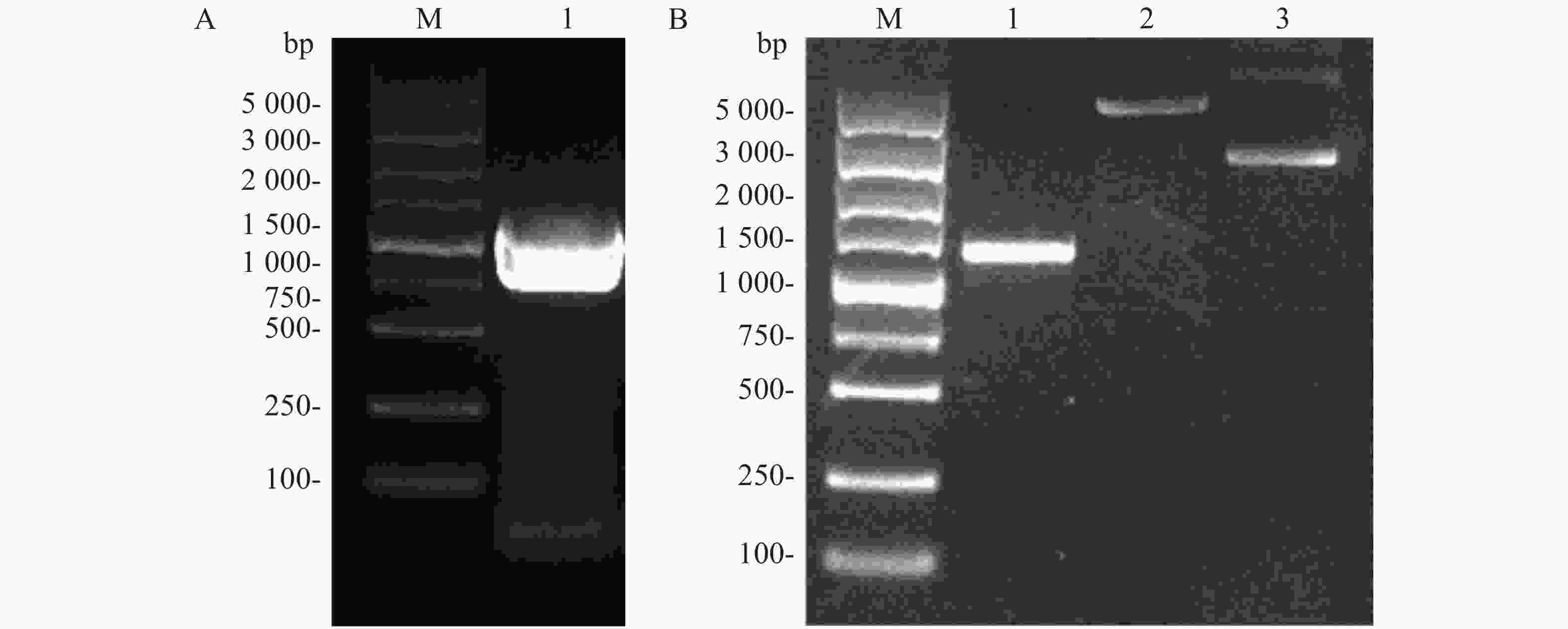
图 2 ald 基因PCR扩增结果(A)和目的基因及pACYCDuet质粒双酶切结果(B)
Figure 2. PCR amplification of ALD gene (A) and double restriction digestion of the target gene and pACYCDuet plasmid (B)
通过酶切连接构建融合表达载体pACYCDuet-Flag-ald,将其电转化至E. coli DH5α 感受态中,并通过含25 mg·L−1 左霉素的抗性平板筛选阳性克隆。挑取候选阳性克隆菌落,以其为模板进行菌液PCR,以验证阳性转化子。菌液PCR结果表明,以阳性克隆载体为模板,能够扩增获得大约1 000 bp的目的产物(图3,泳道1和3)。从阳性转化子中提取质粒,由上海生工生物工程有限公司测序,测序结果表明,重组载体构建成功。
-
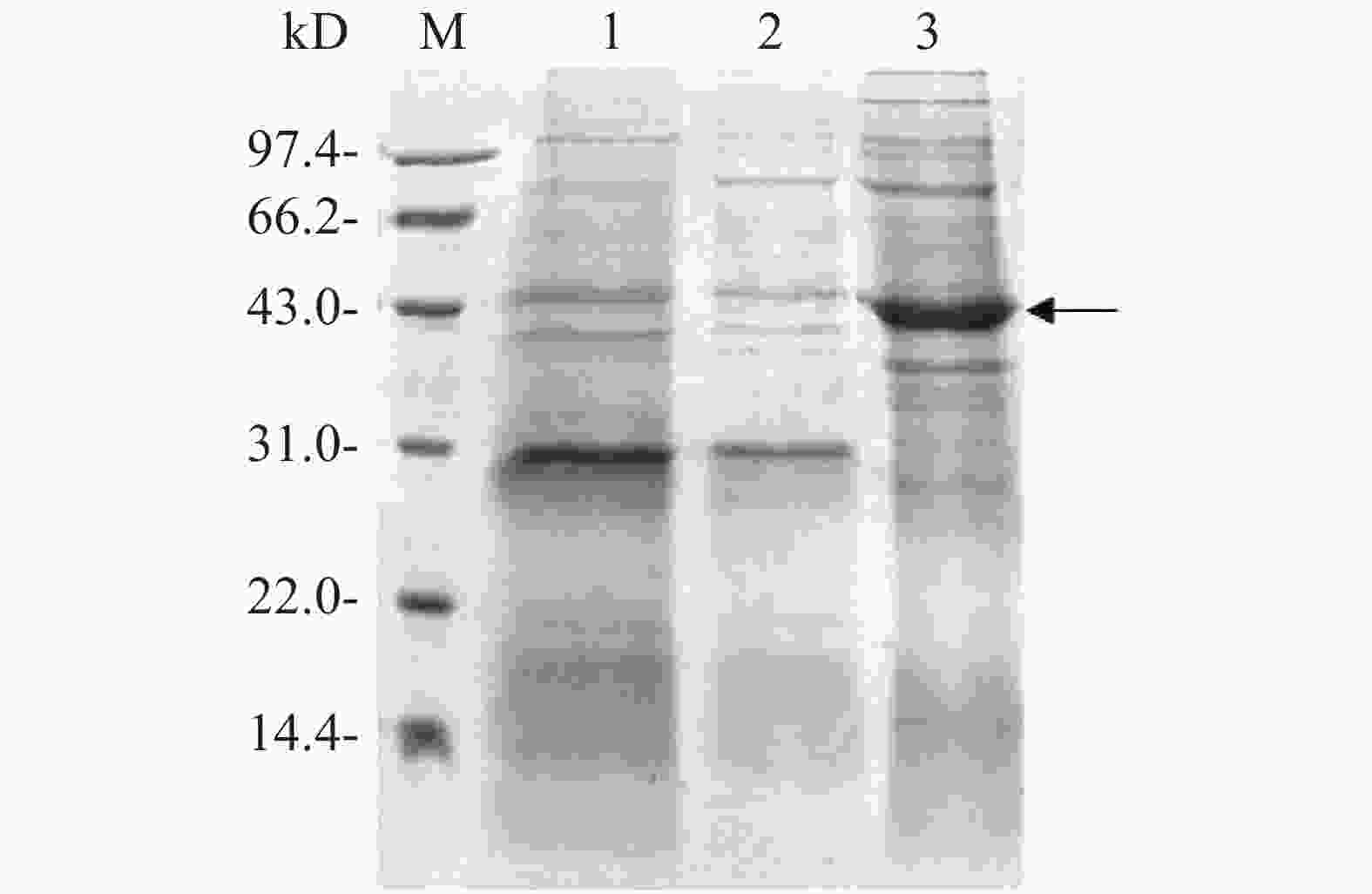
将测序结果正确的融合表达载体电转化至E. coli BL21中,加入0.1 mmol·L−1 IPTG诱导目的蛋白表达。用热裂解法裂解细菌,超速离心后,分别收集上清液和沉淀进行SDS-PAGE凝胶电泳分析,对凝胶进行考马斯亮蓝染色后观察,从图4可知,与没有添加IPTG诱导组(泳道1)相比,加入IPTG诱导2 h后,菌体裂解上清液在位于约42 kD处(泳道3)出现显著的目的蛋白条带(图4箭头所示),而沉淀中没有观察到目的蛋白表达(泳道2),表明融合蛋白Flag-ALD以可溶性形式成功表达。
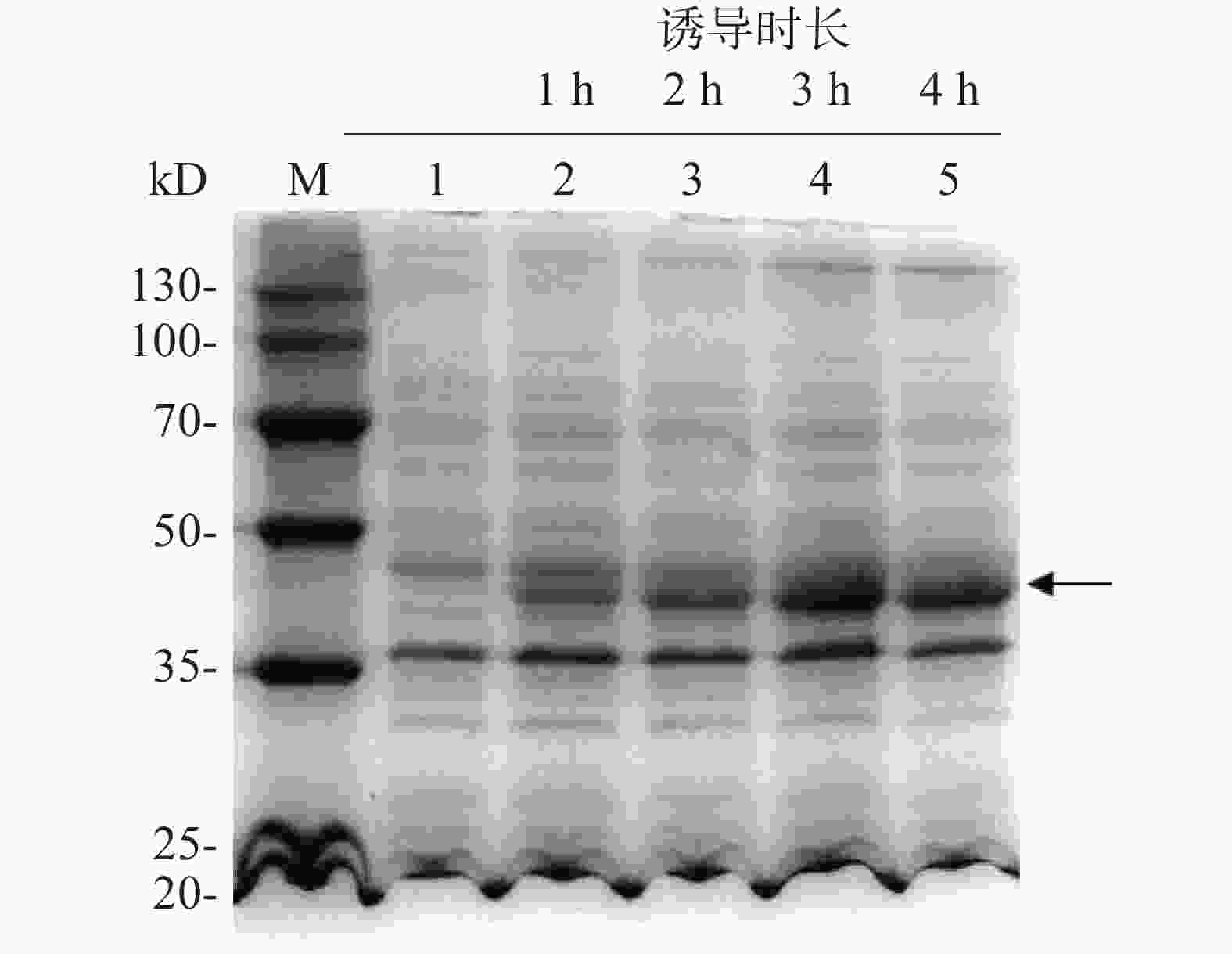
为了探索IPTG诱导的最佳时间,每隔1 h取1次菌液,用热裂解法裂解细菌,离心后取上清液进行SDS-PAGE凝胶电泳分析,随后考马斯亮蓝染色,结果表明(图5),与未添加IPTG的组(泳道1)相比,加入IPTG诱导后(泳道2~5),伴随着诱导时间增加,诱导表达的目的蛋白浓度逐渐增加(箭头所示),且诱导3 h后即使诱导时长增加,蛋白表达量也保持大致相同。
-
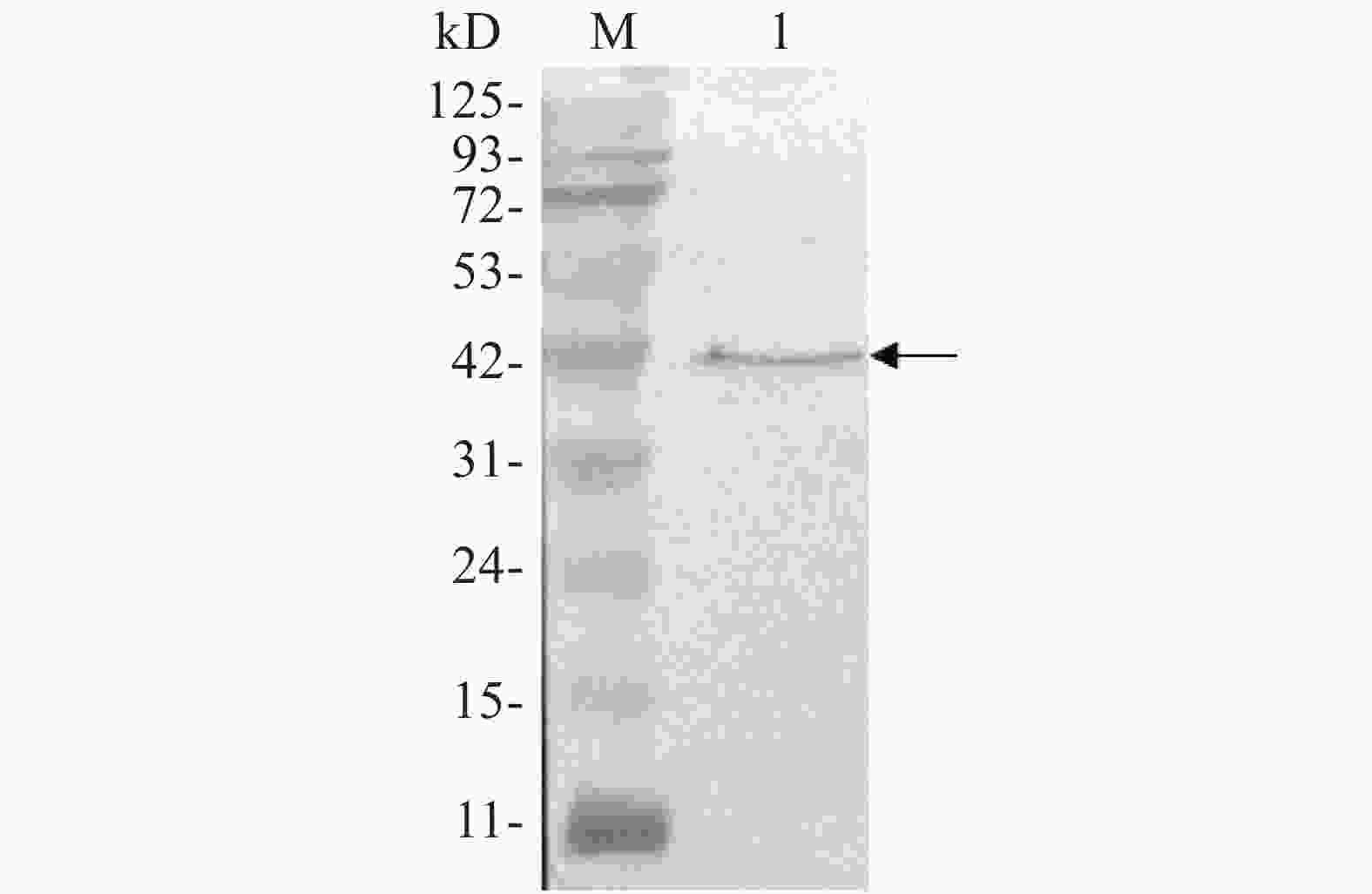
用anti-Flag抗体对携带Flag标签的靶标蛋白进行Western blot,结果在42 kD处检测到1条特异条带(图6),Flag-ALD融合蛋白的相对分子质量为41.8 kD,Western blot结果与预期相符,说明Flag-ALD目的蛋白已经成功表达。
-
维氏气单胞菌是一种新型的人、鱼共患的病原菌,致病性强,可导致广泛的水生生物感染,对水源生物和人类健康存在一定的危害[13]。因此,研究维氏气单胞菌的致病机制,寻找抑制剂靶标,研究新型抑菌剂变得尤为重要。丙氨酸脱氢酶是一种生理酶,ALD在微生物体内的主要作用为产生丙氨酸[15],为肽聚糖的合成提供原料[16]。研究表明,巨大芽孢杆菌[17]和嗜碱性假坚强芽孢杆菌[18] OF4中的ALD蛋白都曾在大肠杆菌中外源表达,通过基因克隆技术构建原核表达载体pET-OF4Ald,经硫酸铵分级沉淀、分子筛柱层析等方法获得纯化后蛋白。上述研究为维氏气单胞菌来源的ALD蛋白在大肠杆菌中外源表达提供了理论基础,但均未对外源蛋白进行标记,需要使用较为复杂的纯化方法,而且也不利于后续直接检测外源蛋白的表达
本实验以维氏气单胞菌的丙氨酸脱氢酶为研究对象,通过分子克隆获得Flag-ALD融合表达载体,并在大肠杆菌中大量表达该蛋白。由于ALD的单克隆抗体没有商品化且制备周期较长,为了方便ALD蛋白的检测,本研究采取的策略是在其N端融合Flag标签,通过检测Flag标签就可以反映ALD蛋白在大肠杆菌中表达的表达情况。选择Flag标签作为融合标签是因为Flag标签全长8个氨基酸,分子质量不大,对目的蛋白的空间结构和表达没有影响,且anti-Flag抗体较常见,易获得。通过SDS-PAGE凝胶电泳分析可知,得到的重组蛋白ALD以可溶性蛋白的形式存在,菌体裂解后的沉淀中基本不含目的蛋白。通过对诱导蛋白表达条件的改良可知,在加入0.1 mmol·L−1 IPTG诱导3 h后,目的蛋白的表达量基本达到最大,这为后续实验需大量表达目的蛋白提供了最佳表达条件。本研究获得的ALD外源表达蛋白,可用于开发生物抑菌剂,以酶蛋白为靶标,开发合适的抑菌剂从而有效地抑制细菌滋生,为开发病原菌维氏气单胞菌的生物抑制剂提供了新的切入点。同时,也为病原菌的致病机制及病害防治提供了一条研究途径。
Reconstruction and Protein Expression of Flag-ALD Fusion Vector
-
摘要: 维氏气单胞菌(Aeromonas veronii)是感染鱼类的最常见致病菌之一,为了解维氏气单胞菌中丙氨酸脱氢酶(alanine dehydrogenase,ALD,EC 1.4.1.1)的调控功能,笔者通过分子克隆获得 Flag-ALD 融合表达载体,并在大肠杆菌中大量表达该蛋白。即以维氏气单胞菌C4基因组DNA为模板,采用PCR方法扩增获得N端带有Flag标签的ald基因,将带有标签的目的基因与原核表达载体pACYCDuet连接,并将重组质粒pACYCDuet-Flag-ald 转化到大肠杆菌(E.coli)BL21中。添加异丙基−β−D−1−硫代半乳糖吡喃糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)诱导重组蛋白大量表达。SDS-PAGE分离与Western blot结果表明,来源于维氏气单胞菌的Flag-ALD重组蛋白在E.coli中以可溶性形式成功表达。本实验构建的Flag标记靶标蛋白可为研究丙氨酸脱氢酶在维氏气单胞菌中的功能以及在生物抑菌剂方面的应用提供技术支持。Abstract: Alanine dehydrogenase (ALD, EC 1.4.1.1) is a microbial enzyme, which plays an important role in the transformation of alanine to pyruvate, carbon metabolism, nitrogen metabolism, and energy metabolism in microorganism. In order to study the function of ALD protein in Aeromonas veronii that causes important aquatic diseases, C4 genomic DNA of A. veronii was used as a template to amplify ALD gene with Flag tag on the N-terminal by PCR. The target gene was incorporated into the expression vector pACYCDuet, and the recombinant plasmid pACYCDuet-Flag-ALD was transformed into E. coli BL21. The recombinant protein was induced by Isopropyl-beta-D-thiogalactopyranoside (IPTG). SDS-PAGE and Western blot showed that the recombinant protein of Flag-ALD was successfully expressed in a soluble form in E. coli. The results laid a foundation for the expression of exogenous ALD protein. The flag labeled target protein may provide a technical support for the further study on the function of alanine dehydrogenase in A. veronii and the development of bacteriostatic agents.
-
Key words:
- alanine dehydrogenase /
- gene cloning /
- recombinant plasmid /
- protein expression
-
图 2 ald 基因PCR扩增结果(A)和目的基因及pACYCDuet质粒双酶切结果(B)
A. M:DL5 000 DNA Marker;1:目的基因PCR产物;B. M:DL5 000 DNA Marker,B. 1:酶切后目的基因;2:酶切后的质粒;3:酶切前的质粒。
Fig. 2 PCR amplification of ALD gene (A) and double restriction digestion of the target gene and pACYCDuet plasmid (B)
A. M: DL5 000 DNA Marker; 1: PCR product of target gene; B. M: DL5 000 DNA Marker; 1: Digested target gene; 2: Digested plasmid; 3: Undigested plasmid.
图 4 融合蛋白Flag-ALD的诱导表达
M:14.4~97.4 kD低分子量蛋白Marker;1:IPTG诱导前全菌蛋白;2:IPTG诱导后菌体裂解沉淀;3:IPTG诱导后菌体裂解上清液。
Fig. 4 Induced expression of the fusion protein Flag-ALD
M: Protein marker of lower molecular weight of 14.4−97.4 kD; 1: Bacterial lysis before induction; 2: Pellets of bacterial lysates after induction by IPTG; 3: Supernatant of bacterial lysates after induction by IPTG.
图 5 IPTG诱导时长对外源目标蛋白表达的影响
M:20~130 kD低分子质量蛋白Marker;1:IPTG诱导前全菌蛋白;2,3,4,5:IPTG诱导不同时间后菌体裂解上清液。
Fig. 5 Effect of IPTG-based inducing time on the expression of target protein
M: Protein Marker of lower molecular weight of 20−130 kD; 1: Bacterial lysis before induction; 2, 3, 4, 5: Supernatant of bacterial lysates after induction by IPTG for different time durations.
表 1 实验材料及来源
Table 1 Strains and plasmids used in this study
实验材料 Burst material 相关属性 Related attributes 来源 Source 菌株
StrainsE. coli BL21 野生型,用于表达外源蛋白表达 实验室保存 E. coli DH5α 野生型,用于质粒克隆 实验室保存 Aeromonas veronii 野生型,分离自发病鱼体 实验室保存 质粒
PlasmidspACYDuet 大肠杆菌蛋白表达载体,含有左霉素抗性基因 实验室保存 pACYDuet-Flag-ald pACYDuet重组质粒,包含T7启动子和维氏气单胞菌融合Flag标签的 ald 基因 本实验构建 -
[1] DAVE U C, KADEPPAGARI R K. Alanine dehydrogenase and its applications – A review [J]. Critical Reviews in Biotechnology, 2019, 39(5): 648 − 664. doi: 10.1080/07388551.2019.1594153 [2] MULLER P, WERNER D. Alanine dehydrogenase from bacteroids and free living cells of Rhizobium japonicum [J]. Zeitschrift Für Naturforschung C, 1982, 37(10): 927 − 936. doi: 10.1515/znc-1982-1013 [3] SIRANOSIAN K J, IRETON K, GROSSMAN A D. Alanine dehydrogenase (ald) is required for normal sporulation in Bacillus subtilis [J]. Journal of Bacteriology, 1993, 175(21): 6789 − 6796. doi: 10.1128/JB.175.21.6789-6796.1993 [4] KARA S, HOLLMANN F, ANSORGE M B, et al. Recent trends and novel concepts in cofactor-dependent biotransformations [J]. Applied Microbiology and Biotechnology, 2014, 98(4): 1517 − 1529. doi: 10.1007/s00253-013-5441-5 [5] BAYSAL S H, YASA I, USLAN A.H Screening and simple purification of alanine dehydrogenase in Bacillus strains [J]. Preparative Biochemistry and Biotechnology, 2002, 32(3): 277 − 285. doi: 10.1081/PB-120013474 [6] FENG Z, CACERES N E, SARATH G, et al. Mycobacterium smegmatis L-Alanine Dehydrogenase (Ald) is required for proficient utilization of alanine as a sole nitrogen source and sustained anaerobic growth [J]. Journal of Bacteriology, 2013, 184(18): 5001 − 5010. [7] LAHMI R, SENDERSKY E, PERELMAN A, et al. Alanine dehydrogenase activity is required for adequate progression of phycobilisome degradation during nitrogen starvation in Synechococcus elongatus PCC 7942 [J]. Journal of Bacteriology, 2006, 188(14): 5258 − 5265. doi: 10.1128/JB.00209-06 [8] 何广正, 马宁, 刘东, 等. 细菌来源丙氨酸脱氢酶的研究进展[J]. 科学与财富, 2011(6): 121 − 123. [9] SAXENA S, SAMALA G, DEVI P B, et al. Design and development of novel Mycobacterium tuberculosis L-alanine dehydrogenase inhibitors [J]. European Journal of Medicinal Chemistry, 2015, 92: 401 − 414. doi: 10.1016/j.ejmech.2014.12.046 [10] SAXENA S, DEVI P B, SONI V, et al. Identification of novel inhibitors against Mycobacterium tuberculosis L-alanine dehydrogenase (MTB-AlaDH) through structure-based virtual screening [J]. Journal of Molecular Graphics and Modelling, 2013, 47: 37 − 43. [11] PERNIL R, HERRERO A, FLORES E. Catabolic function of compartmentalized alanine dehydrogenase in the heterocyst-forming Cyanobacterium anabaena Strain PCC 7120 [J]. Journal of Bacteriology, 2010, 192(19): 5165 − 5172. doi: 10.1128/JB.00603-10 [12] 曾范利, 赵丹, 康元环, 等. 不同动物源性维氏气单胞菌气溶素基因的克隆及比较分析[J]. 中国兽医杂志, 2014, 48(8): 6 − 10. doi: 10.3969/j.issn.0529-6005.2014.08.002 [13] 李伟杰, 赵耘, 刘燕, 等. 狐狸源致病性维氏气单胞菌的分离鉴定及耐药性分析[J]. 中国预防兽医学报, 2012, 34(4): 45 − 50. [14] 刘慧敏, 陈富超, 李春雷, 等. 痰热清注射液联合阿奇霉素序贯疗法治疗小儿肺炎支原体肺炎的疗效与安全性的Meta分析[J]. 中医药导报, 2014, 20(9): 45 − 50. doi: 10.3969/j.issn.1672-951X.2014.09.021 [15] GIFFIN M M, SHI L B, GENNARO M L, et al. Role of Alanine dehydrogenase of Mycobacterium tuberculosis during recovery from hypoxic nonreplicating persistence [J]. Plos One, 2016, 11(5): e0155522. doi: 10.1371/journal.pone.0155522 [16] JEONG J A, OH J I. Alanine dehydrogenases in mycobacteria [J]. Journal of Microbiology, 2019, 57(2): 81 − 92. doi: 10.1007/s12275-019-8543-7 [17] LEUCHTENBERGER W, HUTHMACHER K, DRAUZ K. Biotechnological production of amino acids and derivatives: current status and prospects [J]. Applied Microbiology and Biotechnology, 2005, 69(1): 1 − 8. doi: 10.1007/s00253-005-0155-y [18] HE G, XU S, WANG S, et al. A conserved residue of L-alanine dehydrogenase from Bacillus pseudofirmus, Lys-73, participates in the catalytic reaction through hydrogen bonding [J]. Enzyme and Microbial Technology, 2018, 110: 61 − 68. doi: 10.1016/j.enzmictec.2017.10.001 -




 下载:
下载: