-
槟榔(Areca catechu L.),别名傧郎、宾门等,是棕榈科多年生常绿乔木,原产马来西亚,广泛分布于南亚、东南亚[1]。我国主要栽种于海南岛、台湾、广东、广西和福建等地。槟榔是一种具有较高药用价值的中药,位居我国“四大南药”之首[2],主要用于治疗寄生虫病、消化不良、腹胀、腹痛、腹泻、水肿和黄疸等疾病[3]。同时,槟榔也是深受消费者喜爱的咀嚼食品[4]。据估计,在中国、南亚和东非等国家和地区,每天有超过4亿人以不同的食用方式咀嚼槟榔[5-6]。然而,咀嚼槟榔也具有一定的健康风险,例如嚼食槟榔与口腔癌关系密切[7],槟榔果的水提物和槟榔碱能显著地上调口腔黏膜成纤维细胞中c-jun原癌基因的表达[8],槟榔果的水提物能通过上调细胞间黏附分子−1(ICAM-1)的表达,而对体外培养的人类口腔黏膜成纤维细胞产生明显的增生作用,从而导致口腔黏膜下纤维化[9]。
槟榔的促消化、抗氧化、抗寄生虫、抗抑郁等药用活性与其包含的多种代谢产物密切相关[10]。槟榔中的化学成分主要包括糖类、脂质、蛋白质、粗纤维、多酚,同时包含0.2%~1.7%的生物碱[11]。PENG等[1]鉴定了槟榔中的59种化合物,包括生物碱、类黄酮、单宁、三萜和脂肪酸等,并发现吡啶类生物碱和缩合单宁是槟榔中的特征代谢物。槟榔中的吡啶类生物碱主要有槟榔碱、槟榔次碱、去甲基槟榔碱和去甲基槟榔次碱等4种,另外,还包含槟榔副碱、烟酸、烟酸甲酯、烟酸乙酯、N−甲基−1,2,5,6−四氢吡啶−3−羧酸乙酯、N−甲基哌啶−3−羧酸甲酯、N−甲基哌啶−3−羧酸乙酯、异去甲基槟榔次碱、高槟榔碱等9种生物碱[1]。近年来,随着分离手段的改进和检测技术的提高,TANG等[12]从槟榔中发现了3种新的生物碱,Arecatemine A、Arecatemine B和Arecatemine C,CAO等[13]报道了2种新的生物碱,分别为3−羧甲基丁酯吲哚1−N−β−D−吡喃葡萄糖苷和3−甲氧基−4−羟基苯基6−O−(2−氨基−1−氧代−3−苯基丙基)−β−D−吡喃葡萄糖苷。
目前,对槟榔碱的研究和报道主要集中在槟榔碱的药理、毒理活性及化学工艺合成上[14-16],其合成通路尚不清楚,这制约了对槟榔碱代谢调控与进化分子机理的深入研究,也阻碍了食用型低槟榔碱含量槟榔和药用型高槟榔碱含量槟榔的选育。代谢组学是研究物质合成通路的有效手段[17]。代谢组学本质上是指某一生物、组织或细胞中的所有低分子量代谢产物进行定性与定量分析的一门科学[18]。代谢组学研究中较常见的分析手段有色谱法、质谱法、核磁共振波谱法、紫外吸收光谱法和红外吸收光谱法等[19]。应用最广泛、最有效的是气相色谱−质谱(GC-MS)和液相色谱−质谱(LC-MS)[20]。色谱与质谱联用实现了从利用色谱进行物质分离到利用质谱进行物质鉴定的整个流程。其中,LC-MS能分析极性与相对分子质量较高及热稳定性差的化合物,具有前处理简单、检测范围广和检测效率高等优势,是现阶段代谢组学最常用的检测手段[21]。LC-MS检测的优势使其适合作为代谢通路解析的工具。因此,可利用基于LC-MS的代谢组学研究槟榔代谢物,并解析槟榔碱的合成通路。
本研究利用HPLC-OBITRAP-MS对槟榔各组织进行了非靶向代谢组检测,获得了大量的代谢信号,通过对代谢信号中二级碎片的结构注释,鉴定了超过150种代谢物,首次发现槟榔中存在糖基化的槟榔次碱。通过对代谢数据的定量分析,发现了氨基酸和生物碱空间分布的特异性。通过查阅槟榔碱结构类似物天然合成途径的文献,参考KEGG数据库中的信息,再结合实验获得的代谢物数据,推测了槟榔碱的可能合成途径,旨在为进一步探究槟榔碱的物质结构、来源、槟榔药理活性和毒理机制等提供参考。
HTML
-
在海南大学热带作物学院基地的槟榔种植区,随机采摘大小、果形基本一致的成熟槟榔果实12枚(重复3次),将果实分解为果皮、果壳和果仁。采摘同种不同株槟榔树的根、茎、叶各3份,混合不同株的样品后,随机分为3个生物学重复。将样品进行液氮冷冻处理后,在−80 ℃超低温冰箱保存备用。
-
主要试剂:甲醇、乙腈和乙酸(德国Merck公司)、去离子水(Millipore纯化系统处理)、代谢样品内标利多卡因(上海新亚药业有限公司)、4种生物碱标准品(美国Sigma-Aldrich公司)。标准品用φ=70%的甲醇溶剂进行溶解,配置好的标准品置于−20 ℃冰箱避光储存。
主要仪器:BM 500高性能球磨仪(奥地利Anton Paar公司),Delta 2-24 LSC plus冷冻干燥机(德国Christ公司),5427型高速冷冻离心机(德国Eppendorf公司),高效液相色谱−轨道离子阱质谱仪(美国Thermo公司)等。
-
不同组织的槟榔样品真空冷冻干燥7 d后,用BM500球磨仪研磨成粉末(频率30 Hz、持续时间1.5 min)。称取100 mg研磨好的干粉样品,加入1.2 mL含有0.1 mg·L−1利多卡因内标的φ=70%甲醇提取液,涡旋30 s,低温静置10 min,重复上述操作3次后,放入4 ℃冰箱继续萃取代谢产物12 h,10 000 g 4 ℃离心10 min,取上清液,用0.22 μm的滤膜过滤后,放入进样瓶中即可用于LC-MS进行代谢物检测分析。
-
选取UPLC-Thermo Scientific Q EXACTIVE plus系统中Full MS/dd-MS2的模式进行代谢物检测。仪器:高效液相色谱(UltiMate 3000)−四级杆−Orbitrap(Q EXACTIVE plus)高分辨质谱(美国赛默飞世尔科技有限公司)。色谱条件:色谱柱为shim-pack VP-OSD(pore size 5.0 um)C18(日本岛津公司),流动相为水(含φ=0.04%乙酸)和乙腈(含φ=0.04%乙酸)。洗脱梯度:V水∶V乙腈= 95∶5,0 min;V水∶V乙腈= 5∶95,10.0 min;V水∶V乙腈= 5∶95,11.0 min;V水∶V乙腈= 95∶5,11.1 min;V水∶V乙腈= 95∶5,15.0 min。流速为0.35 mL·min−1;柱温为40 ℃,进样量为2 μL。质谱条件:ESI(电喷雾离子源);正离子模式;鞘气辅助流速比例为40;辅助气流速比例为15;喷雾电压3 000 V;毛细管温度360 ℃;S-lens电压55.0 V;辅助气加热温度350 ℃;离子扫描范围质荷比m/z 67~1 000。
-
利用Compound discover(Compound Discover 3.1.0.305,Thermo)软件对检测数据进行定量分析。首先,在软件中创建新的定量分析方法,导入原始的下机数据,根据样品类型对检测数据进行分类,最后,选择合适的工作流(workflow),调整相应参数进行提取质谱图、色谱峰对齐、物质定性和相对定量等分析。主要参数设置如下:前体离子扫描范围0~2 000 Da,信噪比阈值大于1.5,最大转换时间2 min,最小峰强度106,保留时间的误差范围0.1 min。利用TBtools软件中的主成分分析(principle component analysis,PCA)功能完成不同组织部位代谢物特征积累的分析。利用R 3.5.1和pheatmap包来完成热图的绘制,利用Origin 2018来完成色谱图和质谱图的绘制。利用ChemSketch 12.0完成代谢通路流程图的绘制。
1.1. 材料
1.2. 试剂与仪器
1.3. 样品准备与提取
1.4. 仪器条件与参数
1.5. 数据处理及分析
-
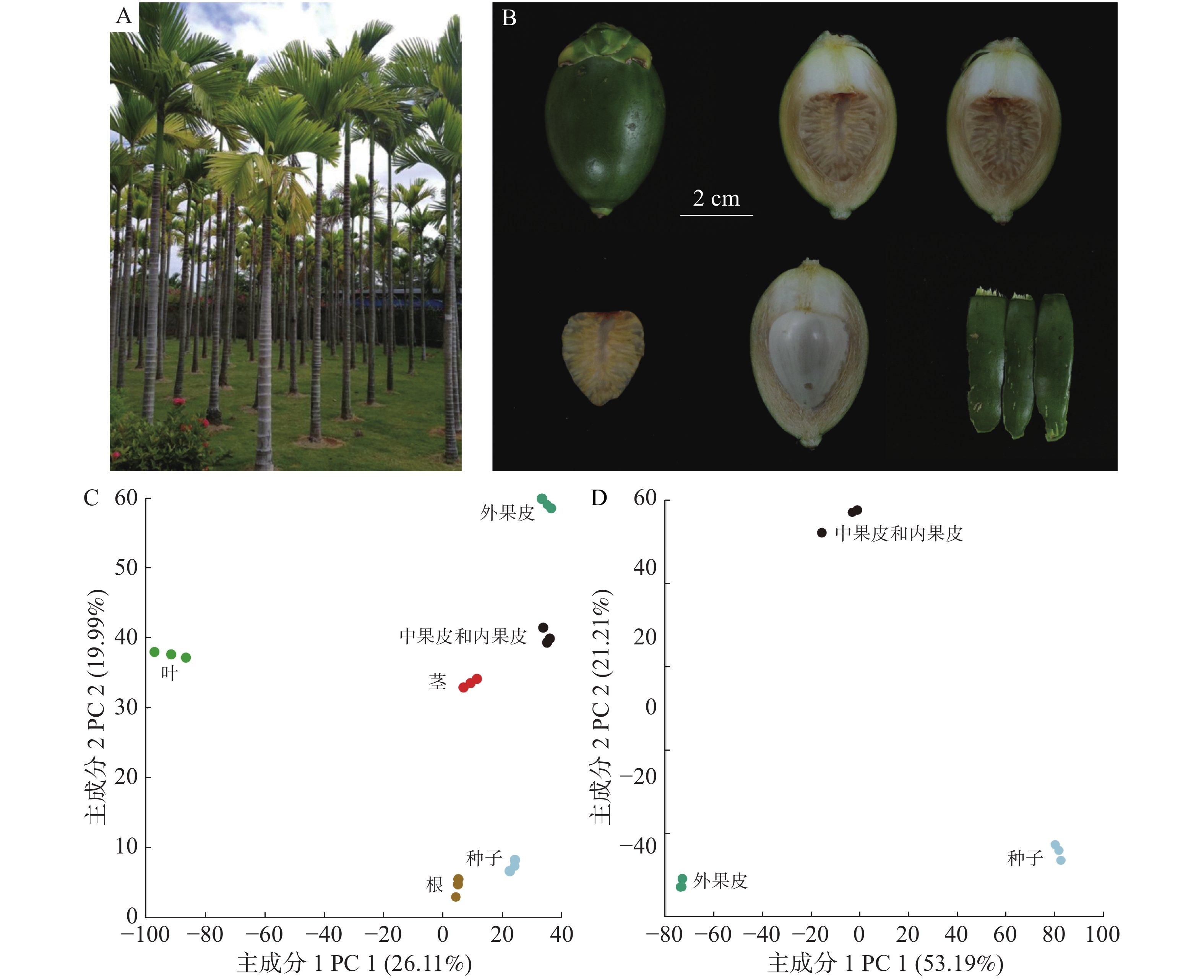
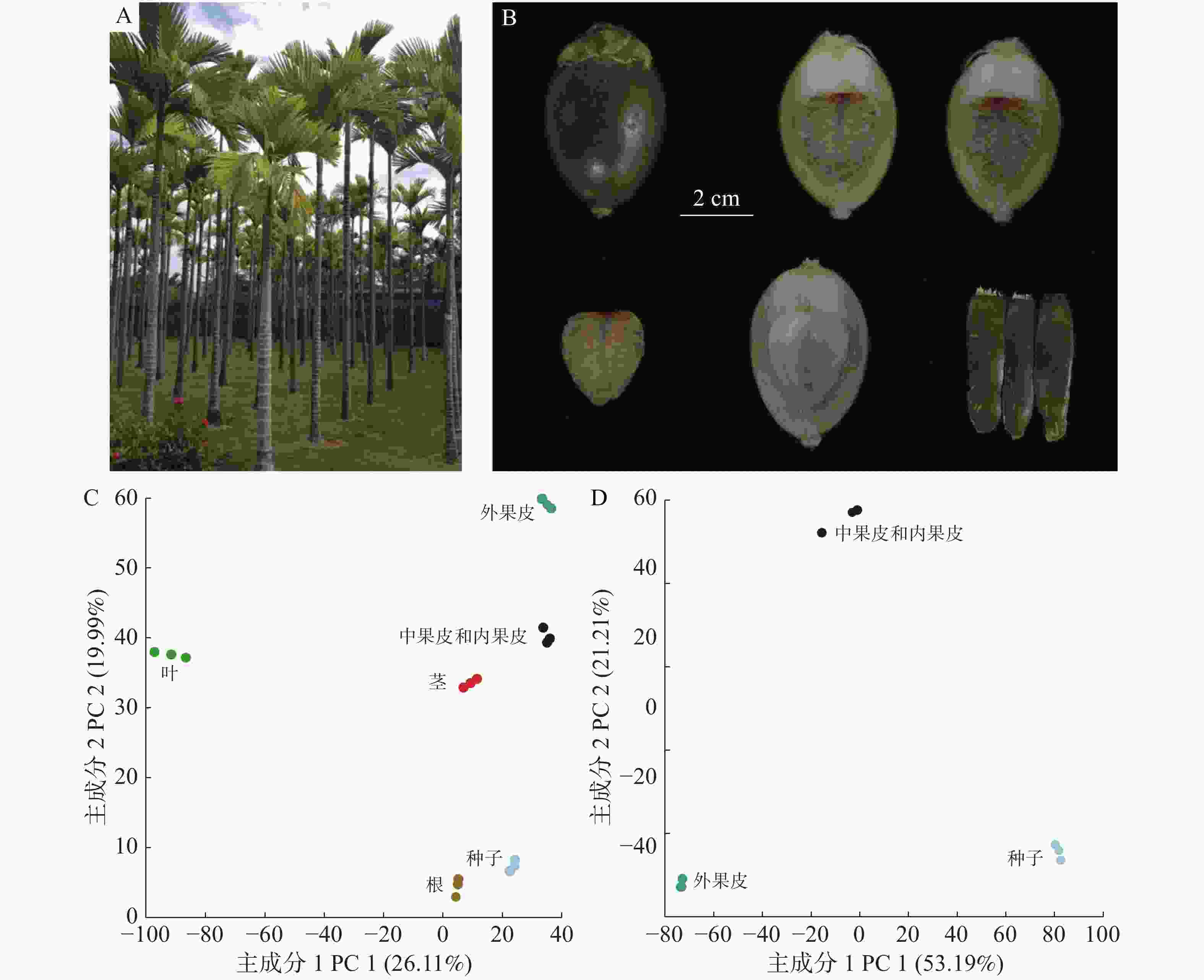
为研究槟榔全株(图1-A)的代谢差异,采集了正常生长时期槟榔的根(Root)、茎(Stem)、叶(Leaf)和果实,把槟榔果实的外果皮(Esocarp)、中果皮(Mesocarp)和内果皮(Endocarp)种子(Seed)进行分离(图1-B)。
正离子模式下进行非靶向代谢检测,所有组织共得到18 386个代谢信号,去除Q1、RT和碎片信息一致的重复信号以及没有碎片信息的信号,以7 508个代谢信号的定量信息进行PCA分析,结果发现,通过PC1和PC2可以明显区分不同组织,表明根、茎、叶、外果皮、中果皮和种子在代谢水平上有明显的差异(图1-C),PC1能非常显著地区分叶和其他组织。果实的PCA分析同样也显示出了外果皮、中果皮和种子的代谢差异(图1-D)。
-
槟榔中代谢物的定性可通过标准品比对、代谢数据库匹配和谱图解析3种方式进行。首先将4种槟榔碱标准品按与槟榔样品相同的色谱和质谱条件进行HPLC-ORBITRAP-MS/MS检测。与之前槟榔样品的代谢数据进行比对,质荷比m/z、RT和碎片裂解模式均相同的为同一物质,发现各组织槟榔样品中均含有槟榔碱、槟榔次碱、去甲基槟榔碱和去甲基槟榔次碱。通过m/z Cloud数据库、m/z Vault数据库和ChemSpider数据库进行在线匹配,m/z Cloud数据库和m/zVault数据库分别匹配到得分大于60分的276个和199个代谢物,ChemSpider数据库匹配得到1 956个代谢物,由于ChemSpider数据库只有一级碎片匹配,因此,结果并不具有较好的可靠性。之后对匹配的结果进行去重和检查,共鉴定得到152个代谢物,主要为氨基酸及其衍生物、生物碱、类黄酮、脂质、核苷酸和吲哚及其衍生物。其中,生物碱之一的葫芦巴碱首次在槟榔中被鉴定到。
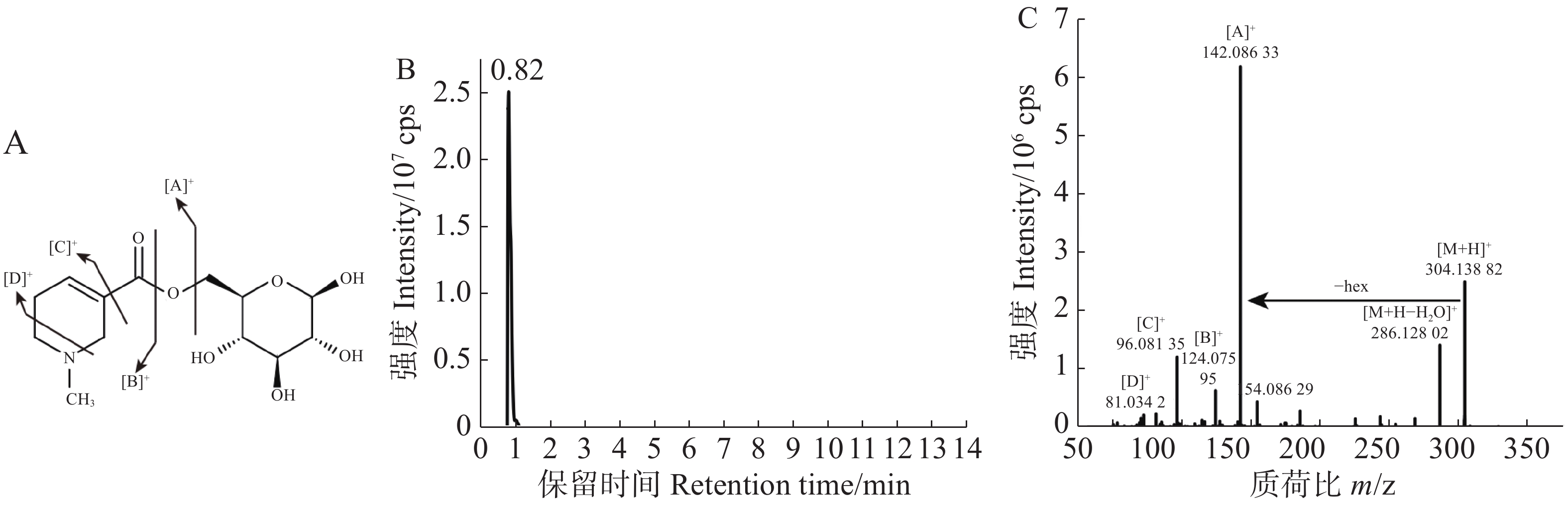
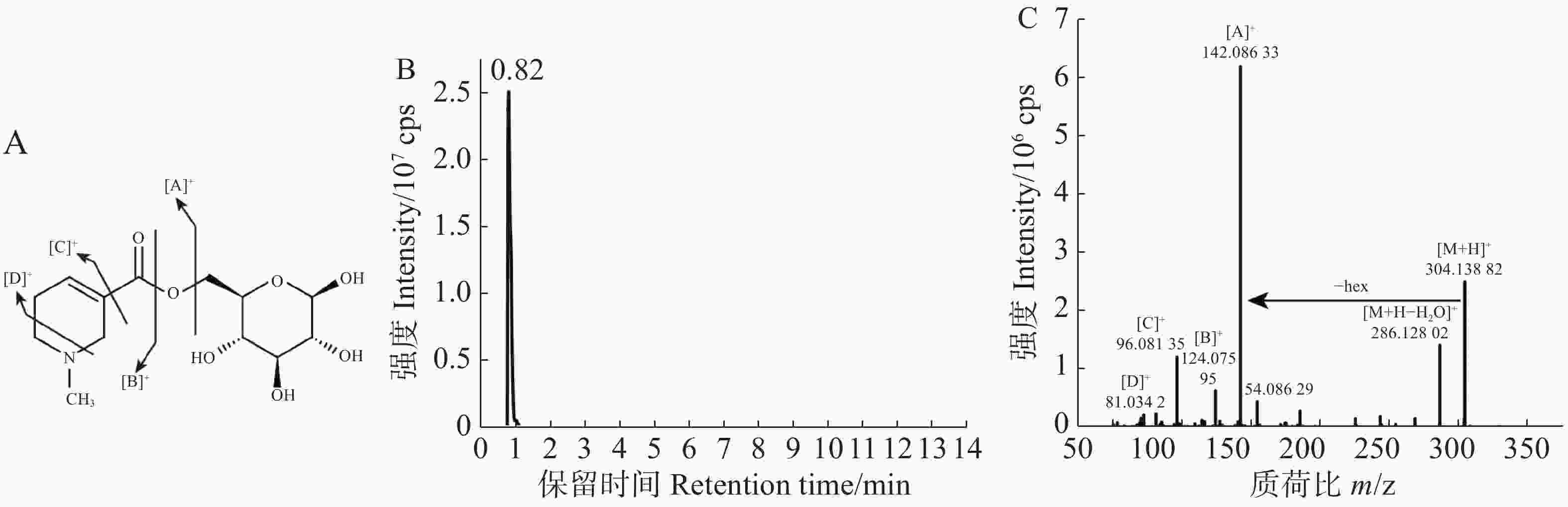
对于仍未注释的物质,通过谱图解析进行定性[22-23]。常见的槟榔生物碱可分为哌啶环上有甲基取代的槟榔生物碱和无甲基取代的槟榔生物碱两类,依据槟榔碱和槟榔次碱的标准品可知前者母核的特征碎片为124.076 2和81.034 0,对于槟榔次碱来说,其他碎片为96.081 3,由此可得槟榔次碱的裂解模式为:首先脱一分子水得到124.076 2的特征碎片,在此基础上哌啶环上的1个C-N键和1个C-C键断裂,得到81.034的碎片,同时哌啶环掉落得到96.081 3的碎片。对于槟榔碱来说,其他碎片为113.059 6和96.081 3。因此,可以利用特征碎片结合保留时间来合理推测槟榔碱衍生物。从7 508个代谢信号中,筛选二级碎片包含124和81的并且强度为前10的代谢信号,共得到102个代谢物,进一步筛选二级谱图后,得到18个潜在的槟榔碱衍生物,1个因保留时间相比于槟榔碱提前0.21 min,且二级碎片完全一致,被注释为槟榔副碱。在这18个潜在的槟榔碱衍生物中,发现了1个糖基化的槟榔次碱,槟榔次碱己糖苷,结构和主要的碎片断裂模式如图2-A所示,该物质的保留时间(图2-B)相比于槟榔次碱提前,并且含有162.052 5的六碳糖中性丢失(图2-C)。本实验利用标准品比对、代谢数据库匹配和谱图解析的方式共解析了158种代谢物。
-
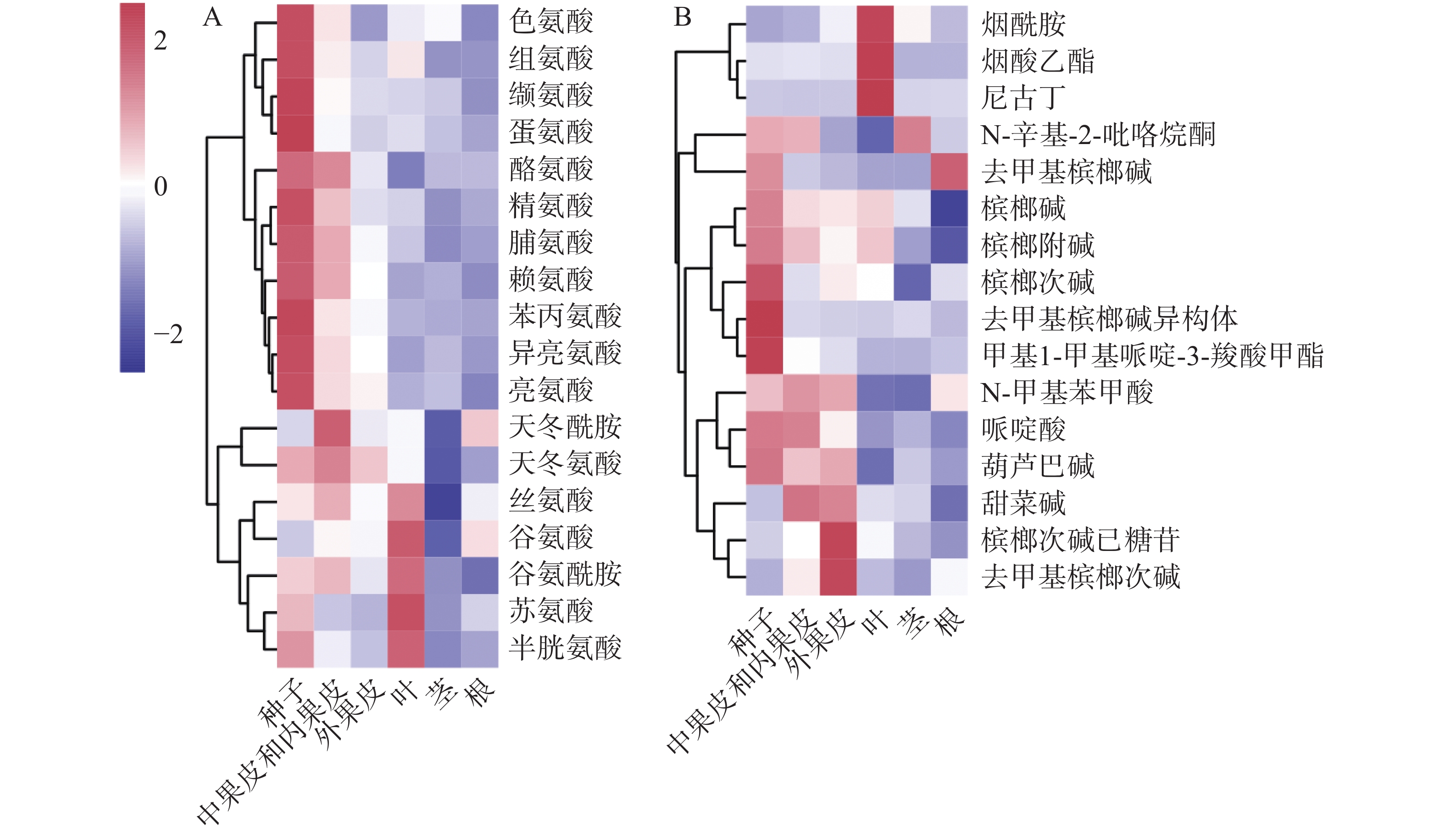
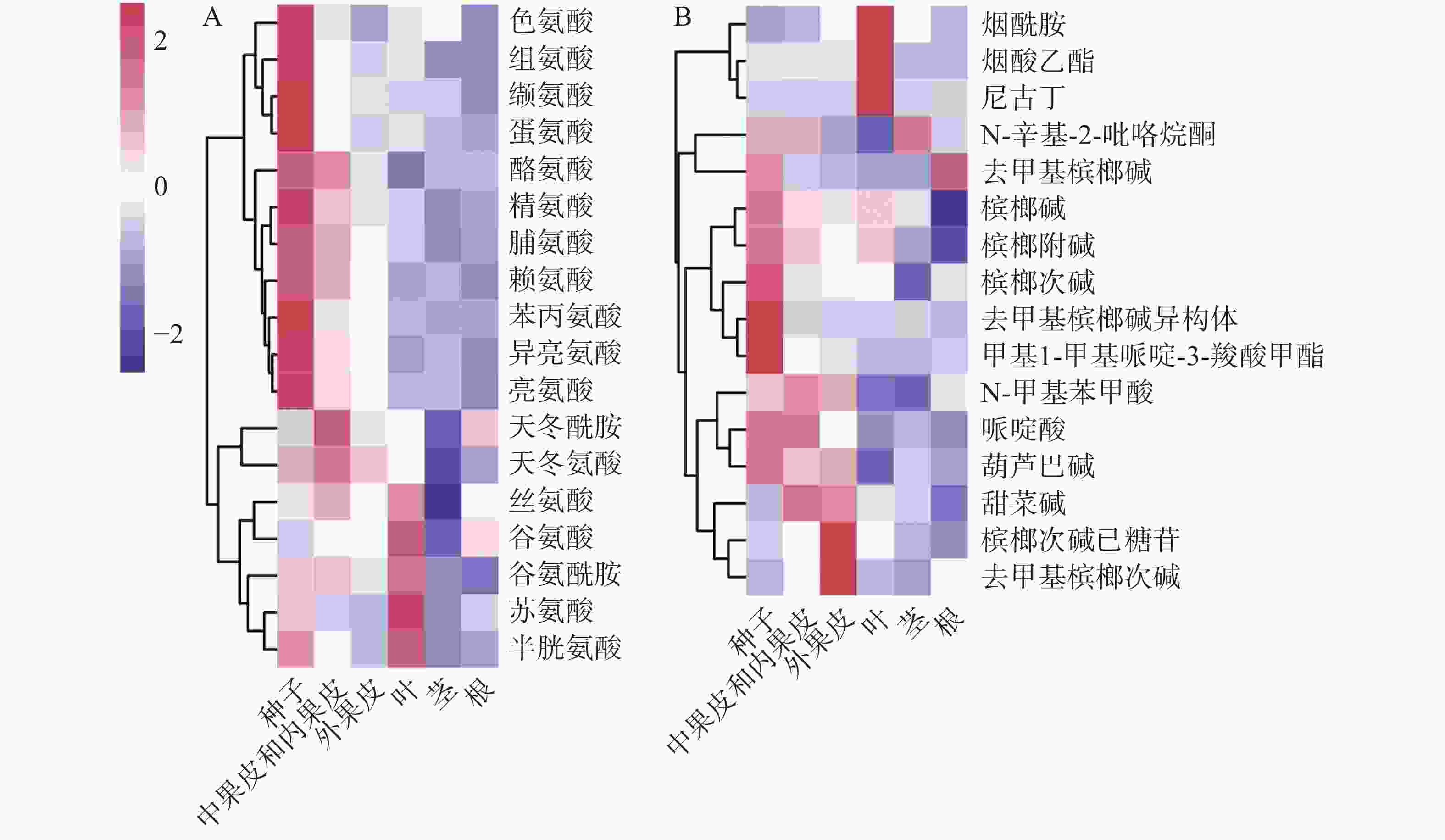
基于对定性的代谢物进行相对定量。从图3可知,槟榔各组织中,共检测到18种氨基酸。从对氨基酸含量的聚类(图3-A)来看,主要分为三类,一类在种子中具有高含量,并且生殖器官(果实、种子)中的含量高于营养器官(根、茎、叶),包括芳香族氨基酸(酪氨酸、色氨酸和苯丙氨酸)和支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)等;一类在中果皮和内果皮中含量较高,为天冬氨酸和天冬酰胺,天冬氨酸作为槟榔碱生物合成的前体物质,其在生殖器官中的含量也高于营养器官;另一类在叶片中含量最高,为丝氨酸、谷氨酸、谷氨酰胺、苏氨酸和半胱氨酸。除甘氨酸外,其他氨基酸在果实中具有较高的含量(种子中含量最高,中果皮次之,外果皮最低)。生物碱的热图(图3-B)显示,烟酸衍生物(烟酰胺、烟酸乙酯、尼古丁)在叶片中含量较高,槟榔次碱己糖苷和去甲基槟榔次碱在外果皮中含量较高,其他生物碱均显示出在果实中尤其是种子中有较多的积累。
-
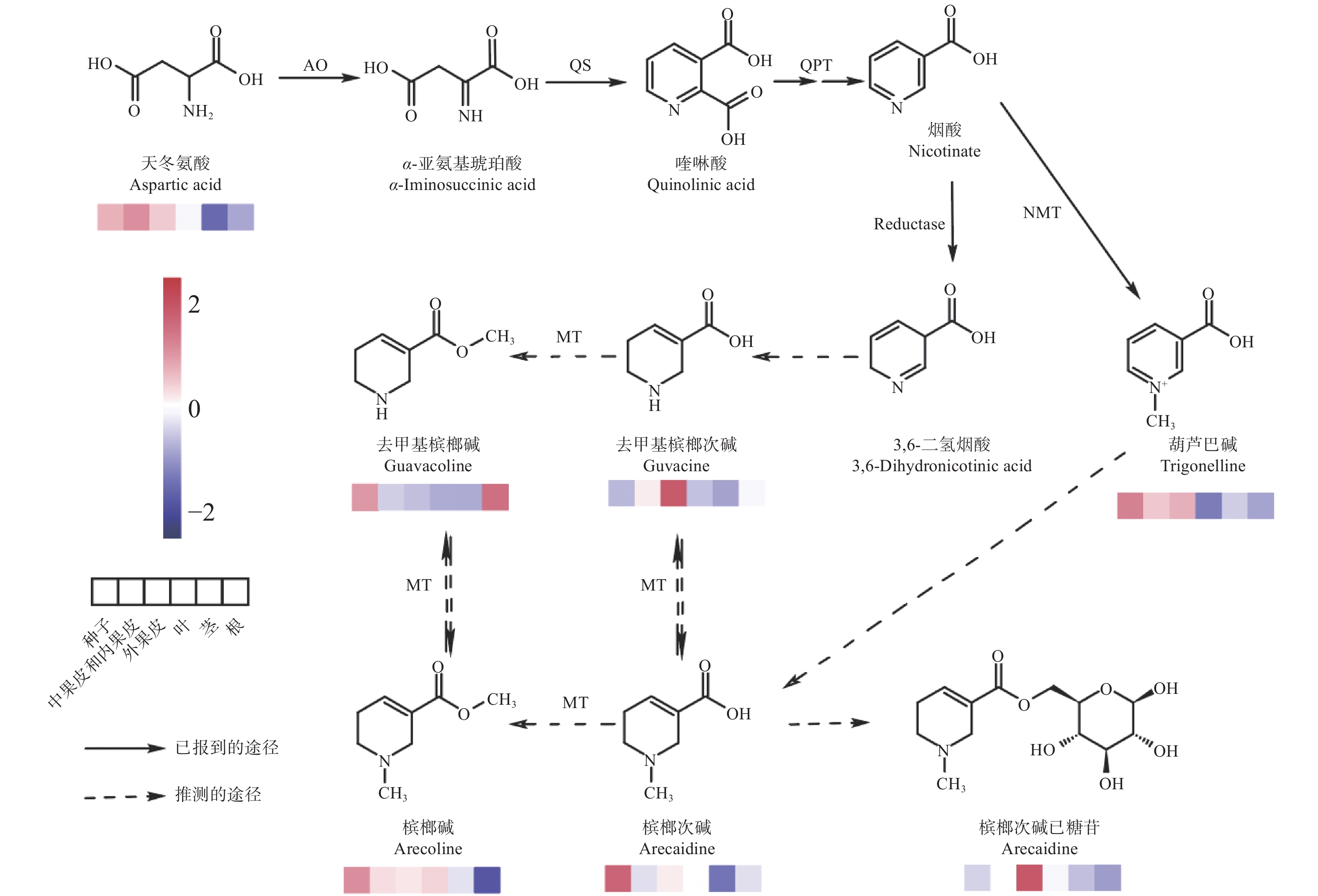
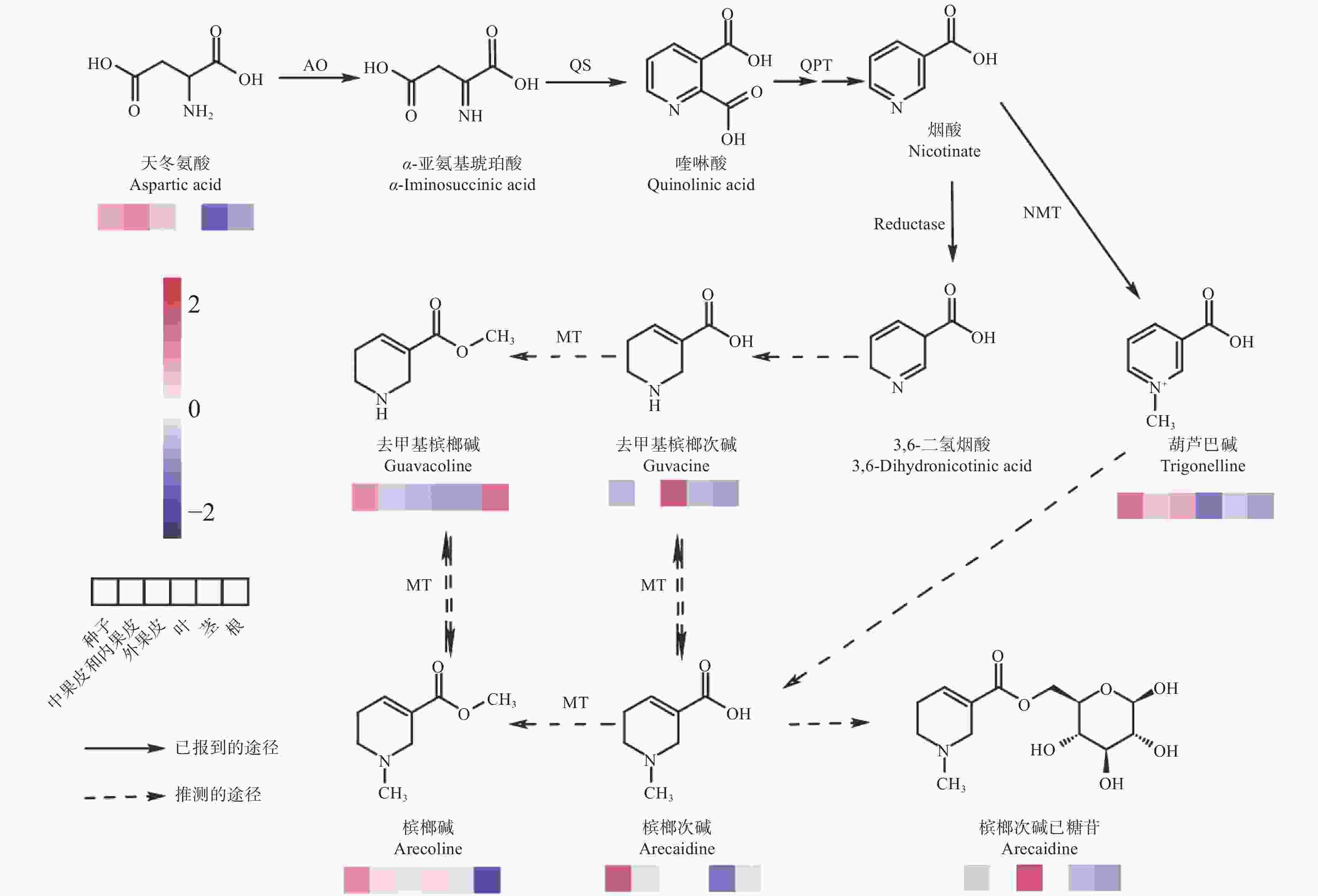
由于检测到高含量的葫芦巴碱,基于葫芦巴碱与槟榔碱的结构相似性,笔者合理推测了一条槟榔碱的合成途径(图4)。槟榔碱均含有被还原的吡啶环结构,其合成由烟酸(nicotinic acid)作为基本骨架。吡啶环的合成途径起始于L−天冬氨酸,其在天冬氨酸氧化酶(aspartate oxidase, AO)催化下氧化形成α−亚氨基琥珀酸(α-iminosuccinic acid)[24]。然后,α−亚氨基琥珀酸和3−磷酸甘油醛在喹啉酸合成酶(quinolinate synthase, QS)催化下形成了喹啉酸(quinolinic acid)[24],接着喹啉酸在喹啉酸磷酸核糖基转移酶(quinolinic acid phosphoribosyltransferase, QPT)的催化作用下形成烟酸单核苷酸(NAMN),以此进入吡啶核苷酸循环,进而形成烟酸[25]。紧接着,在烟酸 N−甲基转移酶(nicotinate N-methyltransferase, NMT)的作用下,烟酸转化为葫芦巴碱[26]。
烟酸与去甲基槟榔次碱的结构非常相似,区别仅是烟酸为吡啶环而去甲基槟榔次碱为哌啶环,故推测去甲基槟榔次碱由烟酸衍生而来。通过检索KEGG数据库,发现在莨菪烷、哌啶和吡啶类生物碱的生物合成途径中还存在烟酸还原为3,6−二氢烟酸的步骤,结合去甲基槟榔次碱的结构,推测这一步骤在槟榔中也存在。3,6−二氢烟酸在还原酶和异构酶的作用下生成去甲基槟榔次碱,去甲基槟榔次碱在甲基转移酶的作用下生成去甲基槟榔碱。同时葫芦巴碱与槟榔次碱的结构也十分相似,区别为葫芦巴碱为吡啶环而槟榔次碱为哌啶环,故推测槟榔次碱由葫芦巴碱衍生而来。葫芦巴碱在还原酶和异构酶的作用生成槟榔次碱,槟榔次碱在甲基转移酶的作用下生成槟榔碱。同时,可能还存在1个与NMT类似功能的甲基转移酶,行使母核四氢吡啶和母核甲基四氢吡啶的相互转化。由于检测到了槟榔次碱己糖苷,说明有1个糖基转移酶催化槟榔次碱的糖基化步骤。
2.1. 槟榔各组织的表型及代谢物轮廓分析
2.2. 槟榔中代谢物的定性分析
2.3. 槟榔碱合成前体物质的空间分布
2.4. 槟榔碱的通路解析
-
从氨基酸和生物碱的空间分布可以看到,几乎所有的氨基酸、大部分生物碱在种子中的含量高于外果皮、中果皮和内果皮,并且对于人体所需的8种必需氨基酸。除苏氨酸外,其余7种均在种子中含量最高,说明种子的营养价值高于其他组织,但用于食用的槟榔加工品常常舍弃种子的部分,只包含外果皮、中果皮和内果皮。这对槟榔加工有了新的见解:在工艺允许的情况下,保留种子的部分更能提高营养价值。天冬氨酸的积累模式与葫芦巴碱、槟榔碱较为类似,均为在果实中尤其是种子中含量较高,进一步证实了本研究提出的槟榔碱合成途径的合理性,但同时也发现,去甲基槟榔次碱和槟榔次碱己糖苷的积累模式与其他生物碱有较大的差异。
现有文献表明,葫芦巴碱在豆类、咖啡和月橘中有积累[25,27-28],同时,也揭示了葫芦巴碱的代谢途径(咖啡、绿豆、马铃薯和水稻)[29-31],笔者在槟榔中检测到葫芦巴碱,才有了推测槟榔碱合成途径的物质基础。槟榔碱合成途径中,天冬氨酸至葫芦巴碱和3,6−二氢烟酸的合成途径较清楚,在水稻、烟草中均有此步骤,较保守,且其中的酶在烟草等物种中已经鉴定。槟榔碱目前仅在槟榔属植物中报道,是槟榔中主要的生物碱,而在烟草中烟碱是主要的生物碱,故可以比较两者的异同,烟碱吡啶环的结构与槟榔碱吡啶环的结构类似,两者合成途径中均利用烟酸作为前体,不同的是,烟碱途径中烟酸的吡啶环与吡咯烷环缩合成烟碱,而槟榔碱途径中不存在缩合的步骤,吡啶环通过还原异构的方式形成槟榔次碱。在烟碱代谢途径中,催化喹啉酸形成烟酸前体烟酸单核苷酸的喹啉酸磷酸核糖基转移酶(QPT)是限速步骤[32],在槟榔碱的合成途径中,QPT也可能是限速步骤。
槟榔碱对消化系统疾病具有正面作用,但对口腔黏膜具有负面作用。随着槟榔碱代谢途径的解析,将有助于培育食用型低槟榔碱含量槟榔和药用型高槟榔碱含量槟榔,促进槟榔产业可持续发展。






 DownLoad:
DownLoad: